C1orf 61对肝细胞肝癌细胞迁移能力的影响及作用机制研究
邹强生 魏贞 蒋婷 李姗
肝细胞肝癌是一种病死率较高的原发性肝癌,癌细胞排列形成实性团块状,周围富有扩张的血窦,且癌细胞界限不清,大小一致[1]。肝细胞肝癌流行病学调查显示,发病地区以非洲、东亚地区为主,大洋洲、南北美洲、欧洲等发病率较低[2]。C1orf 61是一种促进肝癌发生和发展的较为重要的因子,随着肝癌病程的延长,C1orf 61表达水平逐渐升高。且有研究表明,C1orf 61可促进细胞的增殖和克隆;C1orf 61和骨肉瘤、骨髓瘤及肝细胞肝癌的发生发展有关,C1orf 61在正常骨组织中的表达量高于异常骨组织,在骨骼瘤疾病中表达量较低,但在正常肝组织中与之相反,在正常肝组织中的表达相对较低,在肝硬化或者肝癌组织中的表达水平中显著升高[3]。研究C1orf 61是否参与肝细胞肝癌的发生发展,在本文实验中观察C1orf 61对肝细胞肝癌细胞迁移能力的影响及作用机制。
1 材料与方法
1.1 材料
1.1.1 研究细胞:肝细胞肝癌细胞HepG2细胞,购于武汉普诺赛生命科技有限公司,本次研究中的相关事宜均获得我院伦理委员会批准。
1.1.2 主要试剂:小鼠抗人C1orf 61抗体(购于美国Gene Copoeia),兔抗人E-cadherin抗体(购于义翘神州生物技术有限公司),MTT试剂盒、Transwell试剂盒(均购自于武汉博士德生物工程有限公司);PBS缓冲液(购自于北京中杉金桥生物技术有限公司)。
1.2 方法
1.2.1 细胞培养:将冻存的肝细胞肝癌细胞HepG2细胞取出后,快速采用40℃温度火浴,迅速摇晃均匀到融化,加入2 ml的培养基[10%PBS,10%~15%56 ml胎牛血清,1%的5.56 ml双抗(青链霉素),500 ml RPMI-1640培养基],1 000 r/min,离心5 min处理,弃上清液,使用完全培养液重悬,之后进行传代至培养瓶中,培养基加至5 ml,在CO2培养箱中培养(湿度饱和95%。温度37℃、CO2浓度5%),第2天换液,当培养瓶中细胞融合率达80%~90%进行传代。
1.2.2 转染及分组:取对数生长期HepG2细胞,每孔中大约20×104个HepG2细胞,接种于6孔板中,对其进行培养,培养24 h后,按照转染试剂说明书进行,转染后在培养箱中培养6 h后,更换为含有10%胎牛血清的DMEM培养基继续培养。转染后继续培养48 h后,提取细胞蛋白。分为转染C1orf 61阳性处理组(HepG2-C1orf 61组)和转染C1orf 61阴性对照组(HepG2-NC组)。
1.2.3 Western blot检测C1orf 61、p-STAT3、p-Akt蛋白的相对表达:将采集到的细胞,使用PBS缓冲液清洗3遍以上,分离缓冲液,加入IP细胞裂解液,裂解处理35 min,之后提取总蛋白,BCA测定蛋白浓度。取20 μg/孔蛋白质,通过10%的SDS-PAGE凝胶进行电泳,加入适量浓缩的SDS-PAGE蛋白缓冲液15 min;100 V,电泳10 min,之后再将电转膜浸泡在10%的牛奶中,37℃环境下摇床上封闭1.5 h;与一抗结合,加入TBST稀释按1∶1 000稀释一抗β-actin(内参照),在4℃的环境下孵育过夜保存;24 h后用TBST缓冲液清洗,与二抗结合在室温下孵育1 h,再次用TBST缓冲液清洗反复清洗。最后加入显影剂将其浸在底物溶液中进行显色,严格按照显影定影试剂盒操作说明书进行。
1.2.4 细胞划痕实验检测HepG2细胞迁移能力:将HepG2细胞接种到18孔板中,当细胞增长到90%时,使用100 μl的枪头,垂直划出3条直线。之后经过PBS缓冲液进行清洗2~3次,分别加入0.5%的血清培养基,观察24 h后,使用倒置显微镜观察各组细胞的迁移变化。
1.2.5 Transwell小室检测细胞侵袭能力:将处于对数生长期的HepG2细胞取出,调整细胞密度为3×105/ml,并使用浓度为1%的血清培养基重悬细胞,将100 μl 的细胞悬液加入每一个小室中。在培养板上放入Transwell小室,加入无血清培养基,静置0.5 h后使基质胶再水化。向Transwell小室中加入细胞悬液,混合血清培养基在饱和湿度环境下培养24 h,之后进行染色处理,将其取出用PBS缓冲液漂洗,使用多聚甲醛将其固定后采用结晶紫染色法进行染色,每一组均染色15 min,最后用PBS漂洗3次。使用显微镜对随机选取的5个小孔视野拍照,每一组均重复进行3次的细胞数目统计步骤。
1.2.6 RT-PCR、Western blot检测转染后E-cadherin mRNA和蛋白的表达:采用荧光定量RT-PCR技术进行检测,严格按照定量PCR仪的操作说明书进行。依次加入2.5 μl稀释10倍的PCR缓冲液,1.5 μl MgCl2溶液,0.5 μl上游引物和下游引物,最后加水配成总体积为25 μl的反应体系。在94℃环境中反应1 min;55℃环境中反应1 min;72℃环境中反应1 min,进行35个循环,72℃环境中反应延长5 min,重复最少3次。采用2-ΔΔCt方法计算出需要检测的E-cadherin mRNA表达水平。Western blot检测方法同1.2.3。

2 结果
2.1 转染后2组细胞C1orf 61蛋白相对表达量比较 HepG2-C1orf 61组C1orf 61蛋白相对表达量高于HepG2-NC组,差异有统计学意义(P<0.05)。见表1。


组别C1orf 61HepG2-C1orf 61组1.57±0.23HepG2-NC组 0.73±0.04t值11.38P值<0.05
2.2 转染后2组细胞迁移能力比较 HepG2-C1orf 61组HepG2细胞迁移距离均小于HepG2-NC组,迁移数量均多于HepG2-NC组,差异有统计学意义(P<0.05)。见表2,图1。
2.3 转染后2组细胞p-STAT3和p-Akt蛋白相对表达量比较 HepG2-C1orf 61组p-STAT3、p-Akt蛋白相对表达量高于HepG2-NC组(P<0.05)。见表3。

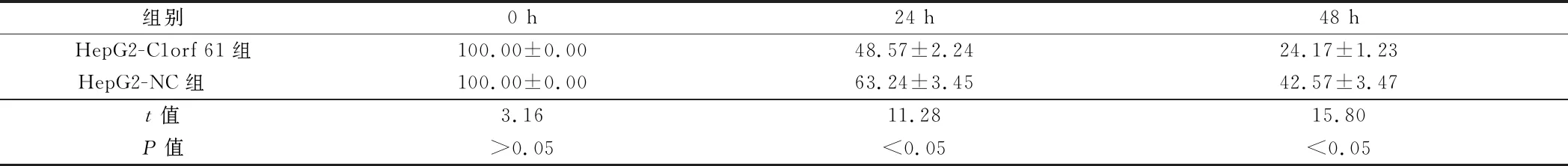
组别0 h24 h48 hHepG2-C1orf 61组100.00±0.0048.57±2.2424.17±1.23HepG2-NC组 100.00±0.0063.24±3.4542.57±3.47t值3.1611.2815.80P值>0.05<0.05<0.05

图1 转染后2组细胞迁移能力比较(×100)


组别p-STAT3p-AktHepG2-C1orf 61组0.96±0.121.02±0.19HepG2-NC组 0.52±0.040.46±0.02t值11.009.27P值<0.05<0.05
2.4 转染后2组细胞E-cadherin mRNA、E-cadherin蛋白相对表达量比较 转染后,HepG2-C1orf 61组E-cadherin mRNA、E-cadherin蛋白相对表达量均低于HepG2-NC组,差异有统计学意义(P<0.05)。见表4。


组别E-cadherin mRNAE-cadherinHepG2-C1orf 61组0.54±0.030.62±0.04HepG2-NC组 1.23±0.140.98±0.12t值15.249.00P值<0.05<0.05
2.5 转染后2组细胞侵袭能力比较 HepG2-C1orf 61组细胞侵袭能力显著高于HepG2-NC组,差异有统计学意义(P<0.05)。见表5,图2。


组别0 h24 h48 hHepG2-C1orf 61组6.12±0.5020.45±2.4750.57±5.24HepG2-NC组 5.23±0.5713.56±1.0238.59±3.23t值3.718.156.15P值>0.05<0.05<0.05

图2 转染后2组细胞侵袭能力比较(结晶紫染色×400)
3 讨论
肝细胞肝癌患者在就诊时常常为中晚期,患者预后较差,且治疗效果往往不理想,且大多数患者治疗失败与肿瘤发生转移相关[4,5]。肝细胞肝癌是较为常见的恶性程度较高的肿瘤,我国是世界上肝细胞肝癌发病率较高的国家,且新发例数大于占世界总肝癌新发例数的一半左右[6,7]。在本文研究实验中,对C1orf 61与肝细胞肝癌细胞迁移的关系及可能的作用机制进行研究,以为临床上肝细胞肝癌的治疗提供新方向。
C1orf61又名CROC-4,位于1号染色体长臂22区,在肝细胞肝癌的发生发展过程中基因频繁发生突变的区段。C1orf61中含有丰富的丝氨酸和苏氨酸,同时包含Wallker A、SH3结构域,其中Wallker A结构域能对C1orf61和DNA进行介导使其结合,对基因转录进行调控;SH3结构域可对C1orf61和分子间进行介导,使其相互作用,对激酶催化活性进行调节,从而对信号转导途径产生影响。C1orf61在人脑中的表达较高,而在其他组织中的表达较低,主要在丘脑、尾状核、海马体等部位中呈现高表达,参与脑发育的过程;C1orf 61在肝脏的形成中有着重要的作用,人体胚胎在发育4~9周时是肝脏形成较为重要的时期,且随着胚胎发育进程的增加,C1orf 61在第4周时开始出现升高的趋势,之后到达峰值,最终在第9周C1orf 61开始呈现低表达。通过组织芯片技术对C1orf 61在肝癌组织中的表达进行检测,结果显示,C1orf 61在肝癌组织中的表达高于正常肝组织,并且C1orf 61表达量随着肝癌病程的增加逐渐增加,C1orf 61和肝癌的发展密切相关。另有研究发现C1orf 61在肝癌细胞中的表达量较高,能促进肝癌细胞的增殖和克隆,促进肝癌细胞的迁移。C1orf 61可通过上皮间质转化相关基因蛋白诱导上皮间质转化的发生。在本文研究实验中,将C1orf 61转染至肝细胞肝癌HepG2细胞中,建立HepG2-C1orf 61组和空载体HepG2-NC组,对2组细胞转染后C1orf 61进行检测,结果显示,HepG2-C1orf 61组细胞中C1orf 61蛋白相对表达量显著高于空载体组,此结果说明C1orf 61在肝细胞肝癌HepG2细胞中呈现异常的高表达量,参与肝细胞肝癌的发生过程。
肝细胞肝癌的转移与较多的基因和蛋白分子、转移相关信号通路出现异常有关,上皮间质转化是一种癌细胞获得迁移能力的较为重要的分子机制,属于一种较为复杂的动态变化过程[8]。细胞骨架的重构是发生上皮间质转化的途径,表现为上皮细胞通过上皮间质转化获得间质细胞的表型[9-11]。上皮间质转化在胚胎发育、组织重建及癌症转移过程中有着重要的作用,主要的特征表现为E-cadherin、角蛋白及β-catenin表达下调和间质细胞表型的N-cadherin、波形蛋白的上调,通过上述因子蛋白的异常表达对上皮间质转化的转录因子和细胞因子进行上调作用[12,13]。在本文研究实验中,对转染E-cadherin后的细胞进行检测,使用RT-PCR、Western blot方法进行检测,结果显示,两种检测均显示HepG2-C1orf 61组细胞中E-cadherin表达均较高,此结果可能是由于C1orf 61通过诱导上皮间质转化的即可能与对E-cadherin表达进行调控有关。E-cadherin为E-钙黏蛋白,在上皮间质转化中作为重要的标志分子存在[14-16]。E-cadherin的主要功能为对细胞间紧密连接的完整性进行维持,对细胞的侵袭、转移进行抑制,但细胞中出现低表达的E-cadherin时会诱导上皮间质转化的发生[17,18]。有研究表明,肝细胞生长因子会通过对Snail的诱导促进肝癌细胞发生上皮间质转化的发生[19]。在本文研究中,对转染后细胞中p-STAT3和p-Akt表达量进行检测,结果显示,HepG2-C1orf 61组p-STAT3、p-Akt蛋白相对表达量高于HepG2-NC组,此结果表明,C1orf 61能够激活p-STAT3和p-Akt的表达,从而促进细胞的EMT和细胞迁移。通过p-STAT3和p-Akt的选择性抑制剂及在基因水平持续性激活或抑制p-STAT3和p-Akt的活性,观察细胞迁移能力的变化。结果表明,p-STAT3和p-Akt在C1orf 61诱导的细胞迁移中发挥了关键作用。而激活p-STAT3和p-Akt的活性是依赖NRP2受体进行的。隋承光等[20]在其研究实验中认为过表达的miR100主要通过上调E-cadherin的表达,对上皮间质转化进行抑制。在本文研究实验中,对HepG2转染后检测细胞迁移能力,结果显示,HepG2-C1orf 61组细胞迁移能力显著高于空载体组,且E-cadherin表达较高,此结果提示,C1orf 61促进肝细胞肝癌细胞迁移的机制可能与E-cadherin的表达有关。但目前临床上对于C1orf 61通过激活p-STAT3、p-Akt的表达来作用于E-cadherin促进肝细胞肝癌细胞迁移的研究较少,仍需进一步研究验证。
综上所述,C1orf 61可促进肝细胞肝癌的迁移,其作用机制可能为C1orf 61激活p-STAT3和p-Akt的表达后,促进肝细胞肝癌细胞的EMT,进而促进细胞迁移。

