撒坝猪AIDA基因编码区克隆、序列特征分析及组织表达量检测
吕敏娟,崔艺佳,李明丽,周晓霞,严达伟,董新星
(云南农业大学 动物科学技术学院,云南 昆明 650201)
AIDA(axin interactor, dorsalization associated)基因,最初认为是一种轴突连接分子,在酶的合成中起重要作用[1]。后围绕敲除AIDA基因的易胖小鼠研究发现:AIDA基因编码的AIDA蛋白能够控制脂肪吸收的效率[2]。AIDA基因能够与磷酸肌肽结合,或通过环状结构与细胞膜结合来发挥作用[3]。内质网相关蛋白降解(endoplasmic reticulum associated degradation, ERAD)是位于内质网(endoplasmic reticulum, ER)中的一种蛋白降解系统[4],以一种底物依赖性的方式执行特殊细胞的功能[5-8]。AIDA基因是通过ERAD促进小肠细胞内脂肪合成酶的降解。在热中性条件下,对敲除AIDA基因的小鼠喂食高脂肪食物时,小鼠体内的脂肪酸会进行再酯化,三酰甘油急剧增加,但是脂肪的生成并没有增加[1]。因此, AIDA蛋白介导的内质网降解途径可以通过降解脂肪合成途径过程中的代谢酶,限制膳食脂肪在肠道的吸收,来抵御机体肥胖。
撒坝猪肌内脂肪含量高,肉质优良[9-10],但脂肪率较高,在动物脂肪市场需求大幅下降、猪肉市场优质优价机制尚未健全的情况下,其养殖比较效益受到了一定影响。鉴于AIDA基因与脂肪的吸收有关,本研究对撒坝猪AIDA基因编码序列进行克隆及序列特征分析,旨在揭示撒坝猪AIDA基因编码区序列的生物信息学特征,运用实时荧光定量PCR技术检测该基因在mRNA水平上的表达规律,丰富AIDA基因的数据库信息,为撒坝猪AIDA基因与脂肪性状相关的遗传机制研究提供一定依据。
1 材料与方法
1.1 样品采集
采集撒坝猪、大河猪、杜洛克、大白猪和长白猪的耳组织样,每个品种各90头(公母各半),装入装有75%乙醇的离心管中。采集撒坝猪脾脏、胰脏、背脂、肾脏、肺、大脑、肝脏、心脏、背最长肌和大白猪的背脂、背最长肌,用于各组织表达分析检测。
1.2 方法
1.2.1 引物设计 以GenBank中猪AIDA基因序列(登录号:NC_010452.4)为模板,使用Primer premier 5.0软件设计引物(见表1):分别扩增10个外显子,涵盖了AIDA基因的CDS区域。所设计的引物由北京擎科(昆明)生物技术有限公司合成。
1.2.2 基因组DNA提取 采用动物基因组 DNA 提取试剂盒(TSINGKE)从耳组织样品中提取DNA,储于-80 ℃冰箱保存备用。
1.2.3 RNA提取与cDNA合成 采用Trizol法分别提取撒坝猪的脾脏、胰脏和背脂等9种组织以及大白猪的背脂和背最长肌的RNA,并反转录为cDNA,质控合格后保存备用。
1.2.4 PCR扩增与测序 PCR反应体系为25 μL,包含ddH2O18 μL,10×buffer(Mg2+)2.5 μL,上下游引物各0.5 μL(10 μmol/L),dNTPs2.0 μL(2.5 mmol/L),Taq聚合酶(5 U/μL)0.5 μL,DNA模板(50 ng/μL)1.0 μL。PCR反应程序为:94 ℃预变性4 min,然后94 ℃变性30s→退火30s→72℃延伸30s,30个循环后,于72 ℃后延伸8 min,4 ℃终止反应。退火温度依次依引物而异(见表1)。PCR产物采用1.0%琼脂糖凝胶电泳检测。
经检测后的PCR扩增产物送至北京擎科(昆明)生物技术有限公司进行序列测定,测序结果经比对拼接后,获得撒坝猪AIDA基因完整CDS序列。

表1 AIDA基因分段扩增引物Table 1 AIDA gene fragment amplification primer
1.2.5 分析软件 采用上述得到的CDS序列,经一系列预测分析获得AIDA基因的生物学信息。预测项目及软件如表2所示。
1.2.6 实时荧光定量PCR检测 分别取撒坝猪和大白猪不同组织的cDNA,以GAPDH基因为内参,实时荧光定量PCR检测AIDA基因在不同组织中的表达。取0.2 ml PCR管,配制如下反应体系,每个反转录产物配制3管,反应体系为25 μL:2×qPCR Mix 12.5 μL,7.5 μM 上下游引物2.0 μL(表3),cDNA 2.5 μL,RNase-free水 8.0 μL。PCR反应条件为:95 ℃,10 min为模板的预变性阶段;95 ℃,15 s,60 ℃,60 s,共40个循环为模板的扩增阶段,60 ℃→95 ℃,每15 s缓慢升温0.3 ℃,建立熔解曲线阶段。结果用2-△△Ct法进行计算。
表2 分析软件Table 2 Analysis tools
2 结果与分析
2.1 AIDA基因多态性分析
对大白猪、长白猪、撒坝猪、杜洛克、大河猪等5种猪的AIDA基因编码区进行扩增、测序比对得出:AIDA基因在5个猪种间没有发生错义突变,在长白猪群体中发现2个同义突变(C20554T,G20560A),大白猪群体中发现3个同义突变(C20554T,G20560A,G34355A),撒坝猪中检测到1个同义突变(T7243C)。经过SeqMan软件对撒坝猪各个外显子进行拼接,利用DANMAN软件翻译,得到CDS的完整序列及氨基酸序列(图1)。
表3 实时荧光定量PCR引物序列信息Table 3 Real-time fluorescence quantitative PCR primer sequence information
2.2 AIDA基因氨基酸序列理化特性预测与分析
氨基酸是构成生物功能大分子蛋白质的基本组成单位,是动物营养所需蛋白质的最基本物质[11]。经ProtParam在线软件预测显示,撒坝猪AIDA蛋白由306个氨基酸组成,分子重34.973ku,其中亮氨酸(Leu)所占比例最高(11.1%),色氨酸(Trp)所占比例最低(0.7%),如表4。撒坝猪AIDA蛋白基本理化性质如表5所示。其中AIDA蛋白的不稳定指数为86.08,属于不稳定蛋白(注:不稳定系数小于40,说明是稳定蛋白,反之则是不稳定蛋白[12])。总平均亲水性为-0.541,属于亲水蛋白。运用ExpAsy服务器上的Protscale程序预测撒坝猪AIDA蛋白的疏水性,结果如图2。
2.3 AIDA蛋白信号肽预测与分析
信号肽在蛋白分泌的过程中起重要作用,分泌性蛋白质合成后由信号肽引导其穿过合成所在的细胞到其他组织细胞中[13]。运用SignalP软件对撒坝猪AIDA蛋白的信号肽进行预测。通过图3可知,S<0.5,因此,撒坝猪AIDA蛋白不存在信号肽。

表4 AIDA蛋白的氨基酸组分Table 4 Amino acid component of AIDA protein

表5 AIDA蛋白的基本理化性质Table 5 Basic physical and chemical properties of AIDA protein
图2撒坝猪AIDA蛋白质疏水性预测结果
Fig.2 The hydrophobicity profile of AIDA in pigs analyzed by Prot Scale in Saba pig
2.4 AIDA蛋白跨膜结构预测与分析
对撒坝猪AIDA蛋白跨膜结构进行分析,预测结果如图4。撒坝猪AIDA蛋白不存在跨膜结构。
2.5 AIDA蛋白亚细胞定位
通过在线软件PsortⅡ分析预测猪AIDA基因编码蛋白的亚细胞定位[14],结果如表6:该蛋白主要分布在细胞质,其次为细胞质膜,在细胞壁和胞外少量分布。因此,可以推断出撒坝猪AIDA蛋白主要在细胞质中发挥作用。
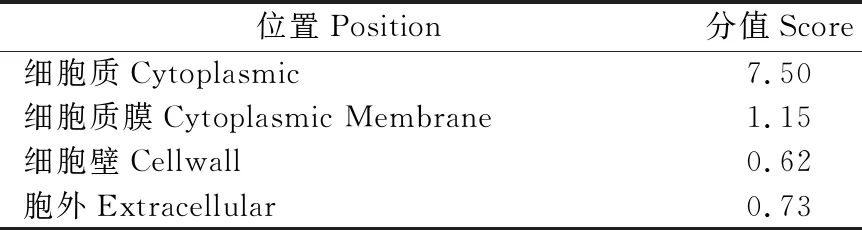
表6 撒坝猪AIDA蛋白亚细胞定位分值Table 6 Location score of AIDA in Saba pigs
2.6 AIDA蛋白卷曲螺旋预测与分析
卷曲螺旋主要存在于一些转录因子、结构蛋白以及酶中,在细胞与外界环境之间的物质与信息交换中可以发挥重要功能[15]。由图5可见,在14、21、28三个窗口宽度下均检测到AIDA蛋白含有两个典型的卷曲螺旋结构。
2.7 AIDA蛋白糖基化位点、磷酸化位点预测
运用 NetNGlyc 1.0 预测撒坝猪AIDA蛋白N糖基化位点(图6),发现有1个糖基化位点,位于第51个氨基酸处,NLSE为0.579。由图7可见,当潜在磷酸化位点的阈值为0.5时,AIDA蛋白存在29个潜在的磷酸化位点,其中包含11个丝氨酸(Ser)位点、14个苏氨酸(Thr)位点、4个酪氨酸(Tyr)位点。在撒坝猪AIDA蛋白上可能有unsp、PKC、CaM-II、GSK3等15种保守的蛋白激酶结合位点,在221处unsp分值最高,为0.996。
2.8 AIDA蛋白二级结构预测
由图8可见,AIDA蛋白α-螺旋区域有106个氨基酸,占34.64%,β转角区域有12个氨基酸,占3.92%,无规卷曲区域有139个氨基酸,占45.42%,延伸链区域有49个氨基酸,占16.01%。
2.9 AIDA蛋白三级结构预测
采用Phyre2对AIDA蛋白同源建模获得三级结构模型,撒坝猪的AIDA蛋白经折叠、弯曲等一系列复杂的过程形成如图9所示的三级结构。
2.10 AIDA基因的分子进化分析
对绵羊(XM_004013613.3)、山羊(XM_018060188.1)、牛(NM_001205634.1)、鸡(NM_001277540.2)、猴(NM_001283182.1)、鼠(NM_181732.4)、人(NM_022831.3)和猪(XM_003130513.6)的AIDA基因编码序列进行同源性分析,结果显示,猪AIDA基因编码区序列与绵羊、黄牛、鸡、山羊、人、猴、鼠的同源性分别为94.2%、94.4%、84.9%、94.4%、94.1%、93.8%、91.0%(图10)。
对8个物种进行进化树分析结果见图11。由图11知,撒坝猪与绵羊、山羊、黄牛的亲缘关系较近。
2.11 撒坝猪AIDA基因CpG Plot预测
运用CpG Plot在线软件预测撒坝猪AIDA基因的CpG Island,结果显示撒坝猪AIDA基因没有CpG island。
2.12 AIDA基因组织表达分析
由图12可知,AIDA基因在大白猪的背最长肌和背脂中表达量要高于撒坝猪。图13可知,撒坝猪AIDA基因在不同组织中的表达量不同,在胰中的表达量明显高于其他组织,AIDA基因表达量从高到低依次为胰脏、脾脏、背脂、肾脏、肺脏、大脑、肝脏、心脏和背最长肌。
S.撒坝猪;Y.大白猪;LD.背最长肌;BF.背脂
S. Saba pig;Y. Yorkshire;LD. Longest back muscle;BF. Backfat
3 讨 论
动物脂肪沉积是脂肪合成和分解代谢平衡后的结果,受到脂肪合成、分解和脂肪酸转运等方面的影响[16]。肠道内消化的脂肪含量是控制食欲的关键部分[17-18],脂肪进入体内后,首先在小肠里水解成脂肪酸和单酰甘油,之后被小肠上皮细胞摄入,在小肠上皮细胞中又重新合成脂肪,形成脂蛋白并从小肠上皮细胞分泌,进入淋巴循环通过血管输送到全身,被各个器官利用或储存。脂肪合成途径的代谢酶大多都定位于内质网。内质网相关蛋白降解(ERAD)是位于内质网(ER)中的一种蛋白降解系统,能够控制蛋白质的组成,及时清理ER中未折叠的蛋白质[3]。ERAD的失调会导致各种疾病的发生,如神经疾病和代谢综合征[19]。从机理上讲,AIDA能够与ERAD机制中的E3连接酶HRD1相互作用,下调TAG合成途径中的限速酶,从而改变TAG合成途径中酶的活性,导致脂肪吸收失调[20-22]。研究表明,对于敲除AIDA基因的小鼠,虽然能够正常发育,但成年小鼠在中性温度条件下生长时,即使采食正常的食物,也会严重肥胖,喂食高脂肪食物则会加剧肥胖程度[1]。而导致小鼠肥胖的主要原因可能是敲除AIDA基因的小鼠对膳食脂肪的高效率吸收。AIDA介导的ERAD是通过选择性下调TAG合成酶来防止脂肪过度吸收,合成和储存的第一道防线。检测AIDA基因在草原红牛不同组织中的表达量发现AIDA基因在肾脏、肌肉和脂肪中表达量占有较高比重[23],三者均是脂代谢的重要场所[24]。
本研究发现,AIDA基因在5种猪群中没有发现错义突变,推测是样本的来源单一,血缘相对较窄,也可能是样本量不足,导致低频的基因型未被检测到,同时也说明AIDA基因可能较为保守。AIDA基因在大白猪背最长肌和背脂中的表达量分别是撒坝猪的1.2倍、2.55倍(P<0.01)。检测AIDA基因在撒坝猪各组织的表达量发现,AIDA基因在胰脏中的表达量最高。胰脏分为胰腺和胰岛,胰腺分泌的胰液经胰管进入十二指肠,其中含有胰脂肪酶,胰脂肪酶能将中性脂肪分解成甘油和脂肪酸,使得膳食脂肪被充分的消化和吸收[25]。推测猪体内的AIDA基因可能与前人的研究结果一致,在脂肪代谢、脂肪吸收和脂肪沉积中发挥着重要作用。
4 结 论
AIDA基因在5个猪种间没有发生错义突变,有较高的保守性。属于亲水性蛋白,没有信号肽、跨膜结构和CpG Island,有2个卷曲螺旋结构、29个磷酸化位点和1个糖基化位点,与绵羊、山羊、黄牛的亲缘关系较近。AIDA基因在大白猪背最长肌和背脂中的表达量显著高于撒坝猪,且在胰脏中的表达量高于其他组织。

