鸡传染性贫血病毒VP3蛋白的原核表达及其单克隆抗体的研制
史静柯,王 鹏,霍臣智,宋 昊,杨海蓉,朱韩钰,许文琳,袁慧莎,叶建强,5,钱 琨,秦爱建,邵红霞
(1.扬州大学 教育部禽类预防医学重点实验室,扬州225009;2.扬州大学 江苏省动物预防医学重点实验室,扬州225009;3.扬州大学 江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州225009;4.扬州大学兽医学院,扬州225009;5.扬州大学农业科技发展研究院,扬州225009)
鸡传染性贫血病毒(Chicken infectious anemia virus,CIAV)属于圆环病毒科环形病毒属。CIAV感染主要引起雏鸡生长迟缓,肌肉内和皮下出血,骨髓造血组织和淋巴组织萎缩,导致贫血和免疫抑制[1-5]。自1979年Yuasa等[2]首次报道以来,CIAV目前已在全球范围内流行,正危害国内外养鸡业健康持续发展[6-7]。由于骨髓造血细胞以及胸腺T细胞是CIAV感染靶细胞,CIAV感染被认为与鸡群对疫苗的免疫失败,继发感染,抗病毒、抗细菌能力下降直接有关,然而对CIAV致病分子机理知之甚少。CIAV是一种无包膜的二十面体单链DNA病毒,基因组全长约为2.3 kb,含有3个开放阅读框(open reading frame,ORF),编码VP1、VP2和VP3种蛋白质。VP1是CIAV的衣壳蛋白[8],具有较强免疫原性,可诱导机体产生病毒中和抗体。VP2是一种支架蛋白,可协助VP1蛋白形成正确构象,暴露VP1中和表位[9]。VP3是一种非结构蛋白,也称为凋亡素,VP3蛋白能诱导多种肿瘤细胞的凋亡,被认为与CIAV感染引起的T细胞凋亡,淋巴组织萎缩,进而导致的免疫抑制密切相关。然而目前对VP3蛋白在CIAV感染,感染导致的免疫抑制及其诱导细胞凋亡的分子基础、信号通路及其关键分子均有待进一步挖掘。本研究通过一步克隆将CIAV的VP3基因连接到原核表达载体pGEX-6p-1上,成功制备rGSTVP3融合蛋白的基础上,研制出抗VP3的特异性单克隆抗体,为进一步探究VP3在CIAV致病中作用及其诱导肿瘤凋亡机制提供了生物材料。
1 材料与方法
1.1 病毒、细胞以及质粒 CZC-1602-CIAV毒株、小鼠骨髓瘤细胞(SP2/0)、MSB1细胞、DF-1细胞、pGEX-6p-1原核表达载体、pcDNA3.1-VP3质粒由本实验室保存。
1.2 实验动物 6~7周龄的ICR和Balb/c小鼠均由扬州大学比较医学中心提供。
1.3 CIAV-VP3基因及pGEX-6p-1线性化载体PCR扩增
1.3.1 PCR引物设计 根据GenBank中已发表的鸡传染性贫血病毒的基因序列(GenBank登录号:M55918)设计并合成了一段针对CIAV-VP3的特异性引物,同时设计一段pGEX-6p-1载体线性化引物,由南京金斯瑞生物科技有限公司合成。CIAVVP3特异性引物,CIAV-VP3-F:5'-GTTCCAGG GGCCCATGAACGCTCTCCAAGAAG-3',CIAVVP3-R:5'-GTTTTCACCGTCATTACAGTCTTA TACACCTTC-3';pGEX-6p-1载体线性化引物,pGEX-6p-1-F:5'-TAATGACGGTGAAAACCTCT GACACATGC-3',pGEX-6p-1-R:5'-CATGGGCC CCTGGAACAGAACTTCCAGAT-3'。
1.3.2 PCR扩增 CIAV-VP3的扩增:模板为本实验室分离的CIAV-CZC1602毒株,PCR扩增体系为:10×LaTaqPCR Buffer(Mg2+plus)2.5 μL,dNTP mixture(2.5 mmol/L)2 μL,上、下游引物各1 μL(10 pmol/μL),DNA模板0.5 μL,LaTaq(5 U/μL)0.2 μL,ddH2O 17.8 μL;PCR反应条件:95℃预变性3 min;95℃变性30 s,50℃退火45 s,72℃延伸45 s,35个循环;72℃再延伸10 min。
pGEX-6p-1载体线性化扩增:以pGEX-6p-1载体质粒作为模板,PCR扩增体系:10×LaTaqPCR Buffer(Mg2+plus)2.5 μL,dNTP mixture(2.5 mmol/L)2 μL,上、下游引物各1 μL(10 pmol/μL),DNA模板0.5 μL,LaTaq(5 U/μL)0.2 μL,ddH2O 17.8 μL;PCR反应条件为:95℃预变性5 min;95℃变性30 s,55℃退火45 s;72℃延伸3 min,35个循环;72℃再延伸10 min。
1.4 pGEX-6p-1-VP3原核表达载体的构建 将PCR扩增得到的目的片段与pGEX-6p-1线性化载体回收后测定浓度,按CloneExpressTMⅡ One Step Cloning Kit说明书进行同源重组连接反应,然后转化DH5α感受态细胞。次日挑取单菌落进行PCR鉴定,挑选疑似阳性菌落提取质粒,送南京金斯瑞生物科技有限公司进行测序验证。
1.5 pGEX-6p-1-VP3原核表达载体诱导表达及其纯化 将验证正确的含pGEX-6p-1-VP3重组质粒的BL21的阳性克隆,转接于LB培养基中,37℃、250 rpm振荡培养过夜。次日将重组菌按照1∶100(V/V)的比例接种到含Amp+(100 μg/mL)的2×YT液体培养基中,37℃、225 rpm振荡培养约2.5 h至D550达到0.6~1.0时,向菌液中加入终浓度为1 mmol/L的IPTG,28℃、150 rpm,诱导培养5 h,同时设置pGEX-6P-1空载体细菌作对照。将诱导表达后的菌液6000×g离心10 min,弃上清液,收集细菌沉淀;用适量1×PBS将细菌重悬,6000×g离心10 min,弃去上清液,重复洗涤3次;随后在在冰浴上进行超声波裂解(Sonics,vibra cellTM),30 HZ裂解2 min每次间隔10 s,充分裂解诱导表达后的细菌,4℃条件下10 000×g离心10 min,分别收集上清液和沉淀,进行SDS-PAGE和Western blot鉴定分析。将细菌破碎后收集的重组蛋白用GE公司生产的GST-琼脂糖凝胶FF柱进行纯化,通过SDS-PAGE鉴定判断蛋白纯化效果,并将纯化获得的重组蛋白命名为rGST-VP3。
1.6 小鼠免疫及融合 将纯化后的rGST-VP3蛋白作为免疫原与弗氏佐剂等体积混合,充分乳化后腹腔免疫6~7周龄Balb/c小鼠,50 μg/只。每次免疫间隔时间为10 d,三免后使用不加佐剂的100 μg rGST-VP3进行加强免疫,72~96 h之间按照常规融合方式进行细胞融合。
1.7 间接免疫荧光法(indirect immunofluorescence assay,IFA)筛选 取生长状态良好的DF-1细胞铺满96孔细胞板,次日待其长至约80%时,按照Trans IT转染试剂操作说明书,将 pcDNA3.1-VP3质粒转染至DF-1细胞。37℃、5%CO2细胞培养箱中继续培养24~72 h,然后用预冷的丙酮:乙醇(3∶2)固定液固定5 min,通风厨中吹干备用。首先用PBS洗3次,吸取100 μL杂交瘤上清液作为一抗,37℃孵育45 min,弃去杂交瘤上清液,并用PBS洗涤3次;加入1∶200倍稀释的FITC标记羊抗鼠IgG作为二抗,100 μL/孔,37℃避光孵育45 min,用PBS洗涤3次;洗涤后的板子内加入50%的甘油,50 μL/孔,置于荧光显微镜进行观察。以融合前的Balb/c小鼠血清为阳性对照,ICR小鼠血清为阴性对照。
1.8 单克隆抗体的亚类鉴定 按照Thermo公司的免疫球蛋白标准亚类快速鉴定试剂盒说明书,进行单克隆抗体的亚类鉴定。
1.9 Western blot验证 将纯化的rGST-VP3蛋白与5×蛋白上样缓冲液混合并煮沸5 min,进行SDS-PAGE凝胶电泳,然后电转移至硝酸纤维素膜上,用5%脱脂奶粉室温封闭2 h,一抗为阳性杂交瘤上清液,37℃孵育1 h,二抗为HRP标记的羊抗鼠IgG,37℃孵育1 h,避光显色,用化学发光仪扫描结果并拍照保存。
2 结果
2.1 原核重组质粒 pGEX-6p-1-VP3鉴定 菌落PCR产物经琼脂糖凝胶电泳后可以见到一条大小约366 bp条带(图1),与预计大小相符。测序结果进一步表明VP3基因已被插入到pGEX-6p-1表达载体中,方向正确且阅读框完整,无碱基突变。以上结果说明已成功构建VP3原核表达重组质粒pGEX-6p-1-VP3。
2.2 VP3重组蛋白的表达和纯化效果 将破碎后的重组菌上清和沉淀进行SDS-PAGE分析表明,在35 kDa左右出现特异性条带,而且目的条带主要存在于细菌破碎后的上清液中(图2)。Western blot结果显示,以病毒免疫小鼠血清做一抗,在35 kDa左右出现一条条带(图3),与预期结果相符。将诱导表达后细菌进行超声破碎后,上清液中菌体以GST-琼脂糖凝胶FF柱进行纯化,纯化效果较好(图4)。

图1 重组载体PCR鉴定Fig.1 PCR identification of recombinant vector

图2 诱导表达SDS-PAGE结果Fig.2 SDS-PAGE results of induced expression
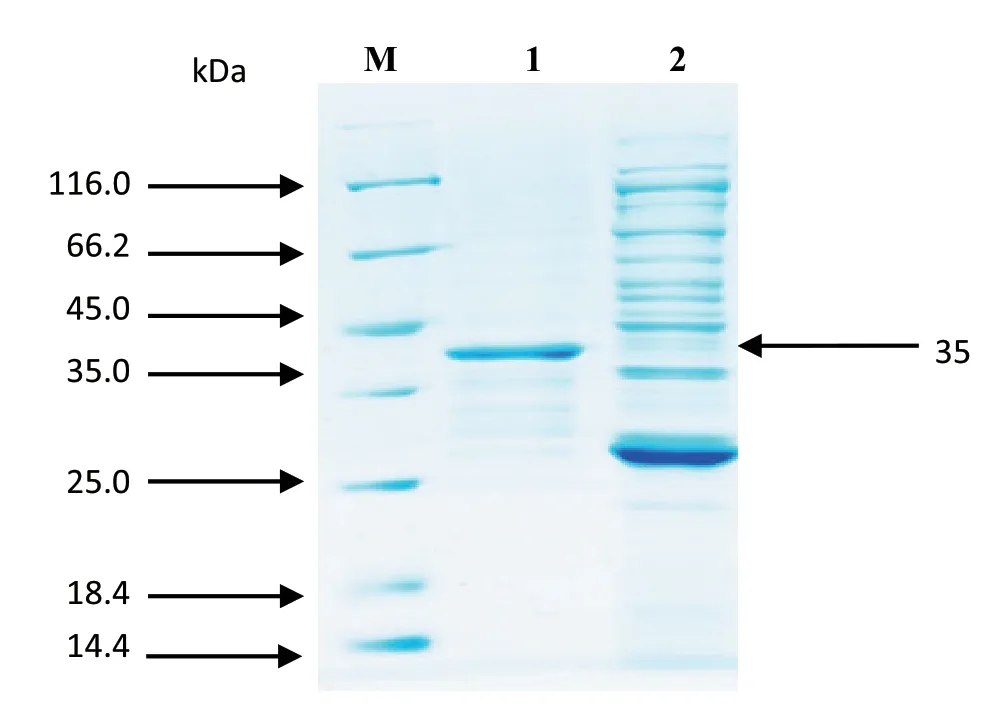
图3 纯化后的重组蛋白rGST-VP3 SDS-PAGE结果Fig.3 SDS-PAGE results of rGST-VP3 purified
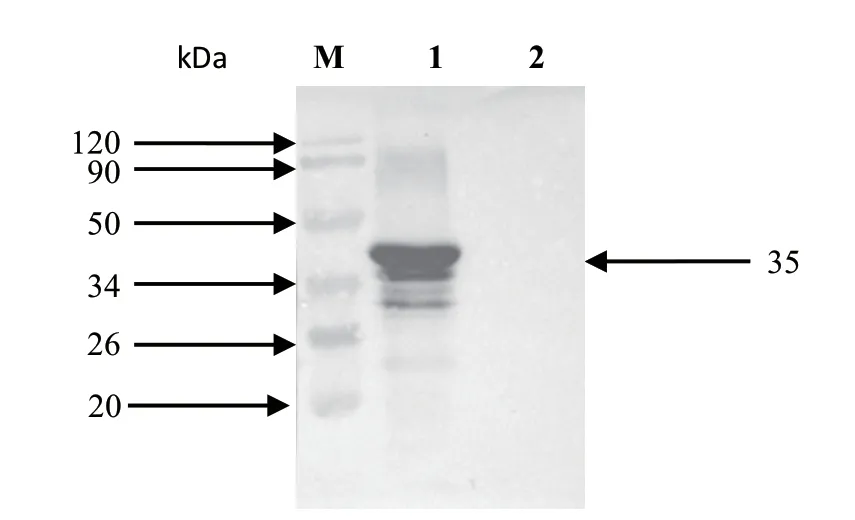
图4 纯化的重组蛋白rGST-VP3的Western blot结果Fig.4 Western blot results of rGST-VP3 purified
2.3 抗VP3蛋白特异性单克隆抗体筛选及特性 以转染pcDNA3.1-VP3的DF-1细胞为抗原,通过IFA方法筛选出了2株与CIAV-VP3反应的阳性杂交瘤细胞株,分别挑取一个单克隆细胞建株命名为CIAVVP3-4G8和CIAV-VP3-4D7,具体IFA荧光结果如图5所示。将2株阳性杂交瘤细胞连续3次亚克隆,所有单克隆孔阳性率为100%。亚类鉴定发现,获得的两株单抗CIAV-VP3-4G8和CIAV-VP3-4D7重链均为IgG1,轻链均为Kappa。CIAV-VP3-4D7和CIAV-VP3-4G8的腹水间接免疫荧光效价分别为1∶102 400与1∶12 800。Western blot结果进一步证实,单克隆抗体CIAV-VP3-4D7和CIAV-VP3-4G8均能识别rGST-VP3(图6)。
3 讨论

图5 CIAV-VP3-4G8和CIAV-VP3-4D7间接免疫荧光结果Fig.5 IFA results of CIAV-VP3-4G8 and CIAV-VP3-4D7
鸡传染性贫血病毒的VP3通常被称为凋亡素,可选择性地诱导肿瘤细胞凋亡,但不能诱导正常细胞的程序性死亡[10-12]。当正常细胞发生癌变,转化成肿瘤细胞时,凋亡素便可以选择性杀死肿瘤细胞。凋亡素是一种含有121个氨基酸的小蛋白质,分子量大小为13 kDa左右,编码基因ORF2位于CIAV基因组的486~849 nt,含有两个人富含脯氨酸的区域,一个疏水区域和两个带正电荷的区域[13]。有相关研究显示,凋亡素诱导的细胞凋亡过程不需要肿瘤抑制因子P53的参与,不但不能被原癌基因bc1-2的表达产物抑制反而能被其过表达所促进[14-15]。这些研究表明,凋亡素及其相关产品开发有望成为治疗肿瘤疾病有效药物。
目前国内外对于凋亡素的研究较多,但CIAVVP3单克隆抗体研制的报道较少。1990年,McNulty等[16]以纯化的CIAV作为免疫原,以间接免疫荧光的方式筛到能够分泌针对CIAV单克隆抗体的杂交瘤细胞株。2006年,陆桂丽等[17]利用His-VP3作为免疫原,并以包被His-VP3蛋白建立ELISA方法进行筛选,获得了抗VP3蛋白单克隆抗体。本研究采用的一步克隆法构建pGEX-6p-1-VP3重组表达载体,与传统方法相比极大的简化了实验操作过程。重组表达载体带有GST纯化标签,而且经过诱导表达后的目的条带主要以可溶性的形式存在,通过GST-FF琼脂糖凝胶柱成功对其进行了纯化,获得了大量的纯化蛋白。以构建的rGST-VP3重组蛋白作为免疫原,用转染VP3真核质粒的DF-1细胞作为检测原,通过IFA方法筛选抗VP3的单克隆抗体,确保了所获得单克隆抗体的特异性。获得的2株单克隆抗体CIAVVP3-4G8和CIAV-VP3-4D7不仅同时具有IFA以及Western blot反应性,而且能同时识别原核表达的VP3蛋白以及DF-1细胞中表达的VP3蛋白。抗VP3单克隆抗体CIAV-VP3-4G8和CIAV-VP3-4D7的研制,为进一步探究VP3在CIAV诱导免疫抑制中作用及VP3诱导肿瘤细胞凋亡分子机制提供了工具。单克隆抗体CIAV-VP3-4G8和CIAV-VP3-4D7识别表位鉴定及其它生物学特性研究也正在开展中。

图6 CIAV-VP3-4D7(A)和CIAV-VP3-4G8(B)Western blot 鉴定结果Fig.6 Western blot results of CAV-VP3-4D7(A) and CIAV-VP3-4G8(B)
——一道江苏高考题的奥秘解读和拓展

