1株番鸭源奇异变形杆菌的分离鉴定及其毒力基因分析
俞赵荣,杨侃侃,王元红,张 谦,苏 莉,鲁智敏,张学琪,刘自敏,李传峰,刘光清,王 勇,李永东
(1.安徽农业大学动物科技学院,合肥230036;2.宁波市疾病预防控制中心,宁波315010;3.中国农业科学院上海兽医研究所,上海200241)
奇异变形杆菌(Proteus mirabilis,P.mirabilis)是一种重要的人畜共患的条件性致病菌,属于肠杆菌科变形杆菌属的革兰氏阴性菌,菌体呈球状、杆状、球杆状、长杆状,其结构无芽孢和荚膜,有鞭毛及菌毛[1-2]。可引起人和动物感染,诱发腹泻、尿道炎,肾盂肾炎、菌血症、脑膜炎等疾病,严重时导致死亡[3-4]。目前国内外不断有关于奇异变形杆菌的金属蛋白酶、“雾蔓”迁徙能力、溶血素等毒力基因的相关报道[5]。近年来,奇异变形杆菌的临床分离率呈逐步上升趋势,对人和畜禽养殖的危害越来越大[6]。
2018年4月,滁州地区某鸭场送检12只发病和病死的雏番鸭,临床症状主要表现为精神沉郁、呼吸困难、咳嗽、流泪、站立不稳、排浅绿或者灰白稀粪等。剖检时可见肝脏严重出血,肺脏、喉头气管充血出血,肠道粘膜脱落,肾肿。本研究从送检的病死雏番鸭内脏中分离到1株细菌,对其进行16S rRNA基因扩增、生化鉴定、药敏试验以及动物致病试验。综合鉴定,该菌为强耐药性和致病性的奇异变形杆菌。目前关于番鸭源奇异变形杆菌的研究报道较少。本研究通过相关毒力基因检测分析,了解其毒力基因型,旨在确定引起此次雏番鸭暴发死亡的病原,以便开展更有效的防控工作,同时为番鸭源奇异变形杆菌临床诊断、临床用药及遗传变异研究提供参考。
1 材料与方法
1.1 主要实验材料 病料样品来源于2018年4月安徽省凤阳县某番鸭养殖场送检的10日龄病死番鸭。细菌的药敏纸片购自杭州微生物试剂有限公司;酵母浸粉、胰蛋白胨、麦康凯琼脂、三糖铁琼脂、琼脂粉、微量生化发酵管均购自杭州天和微生物试剂有限公司;rTaqDNA聚合酶、pMD18-T载体、DH5α感受态细胞购自大连宝生物有限公司;小提质粒试剂盒、细菌基因组DNA提取试剂盒、琼脂糖凝胶DNA回收试剂盒均购自天根生化科技(北京)有限公司;相关毒力基因和16S rRNA基因引物均由南京擎科生物科技有限公司合成;昆明(KM)小鼠购自安徽医科大学实验动物中心。
1.2 病原的分离纯化 无菌采集病死雏番鸭的肝脏和脾脏,接种于血平板上,在37℃条件下培养24 h后,挑取疑似菌落涂片,革兰氏染色镜检后,接种于普通琼脂平板上。再挑取单个菌落接种于麦康凯平板和普通琼脂平板上,37℃培养24 h,观察分离菌的生长特性。
1.3 生化鉴定 使用肠杆菌科细菌微量生化发酵管,按照伯杰氏细菌手册进行生化特性鉴定。
1.4 药敏试验 采用K-B纸片扩散法进行无菌操作,先将分离纯化的细菌接种到LB液体培养基中,于37℃、150 r/min过夜培养。吸取菌液均匀涂布于普通琼脂平板上。轻贴药敏片于培养基上,37℃培养24 h后,测量抑菌圈的直径。
1.5 16S rRNA基因扩增及遗传进化树分析 按照细菌基因组DNA提取试剂盒的使用说明提取细菌的DNA模板。以其为模板扩增细菌16S rRNA基因。F:5'-AGAGTTTGATCMTGGCTCAG-3';R:5'-GGTTACCTTGTTACGACTT-3'。PCR扩增反应总体系为20 μL,反应条件:94℃变性5 min;94℃变性30 s,55℃延伸30 s,72℃退火1 min,35个循环;72℃延伸10 min。通过1%琼脂糖凝胶电泳鉴定。按照胶回收试剂盒的说明书回收纯化PCR产物,连接至pMD18-T载体,转化DH5α感受态细胞,选择阳性克隆,提取质粒送至南京擎科生物科技有限公司测序。将测序成功的16S rRNA基因序列运用BLAST程序进行检索,选取10株核苷酸同源性较高的序列,采用DNAStar 6.0软件中的MegAlign与测序结果进行同源性分析,运用Clustal X2软件进行多序列比对分析,使用MEGA 7.0的邻接法构建系统发育树。
1.6 毒力相关基因的扩增及序列分析 参照文献[7],设计ureC、zapA、mrpA、ucaA、rsbA、pmfA、atfA、atfC等8种毒力基因引物,引物由南京擎科生物科技有限公司合成。退火温度及引物序列见表1,PCR反应体系参考1.5。以提取的细菌DNA为模板分别扩增上述8种毒力基因,并将测序获得的8种毒力基因序列运用BLAST依次进行对比分析,与GenBank中6株核苷酸同源性较高的序列,利用DNAStar 6.0软件中的MegAlign与测序的序列进行同源性比对,再以MEGA 7.0进行氨基酸序列分析并建立系统发育树。

表1 引物序列及PCR扩增条件Table 1 Sequences of primers and amplification conditions
1.7 动物致病性试验 取100 μL的菌液加入LB液体培养基,于37℃的条件下振荡培养24 h,用比浊法测定分离菌浓度,并使用平板计数法测定其菌落形成单位,将菌液稀释至1.5×108CFU/mL。7日龄健康雏番鸭14只,随机分为感染组和对照组,每组7只,感染组雏番鸭肌肉注射1 mL/只上述菌液,对照组雏番鸭肌肉注射1 mL/只LB液体培养基。每天观察记录雏番鸭的发病死亡情况,并从死亡雏番鸭的脏器中再次分离病原菌。
2 结果
2.1 细菌的分离及形态特征 经麦康凯平板上分离培养后,分离菌的菌落呈圆形、扁平、无色、湿润、半透明状。而在普通琼脂平板上培养后,菌落呈圆形,大小不一。革兰氏染色可见到形状不一的革兰氏阴性菌,多为两端钝圆的长杆菌和短杆菌(图1)。
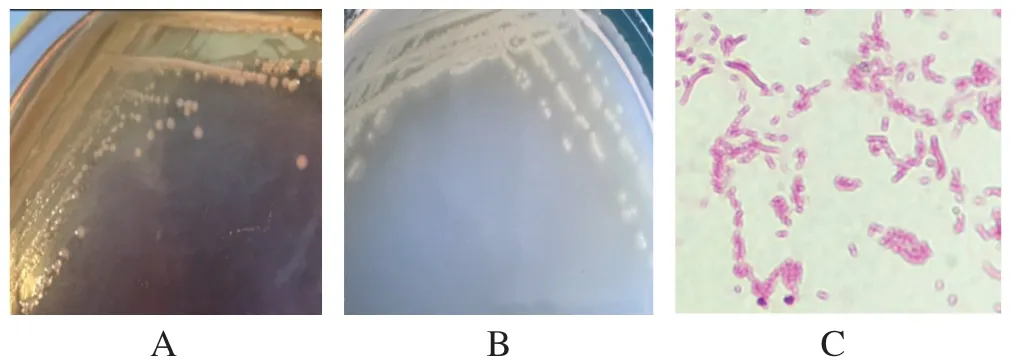
图1 分离菌的形态特征Fig.1 Morphological characteristics of isolated bacteria
2.2 生化鉴定结果 分离菌的生化鉴定结果显示,分离菌株发酵葡萄糖,产酸产气;尿素、硫化氢、明胶及MR试验阳性;吲哚、VP、七叶苷试验阴性;不发酵麦芽糖、乳糖、蔗糖、山梨醇和卫矛醇。初步判定该分离菌为奇异变形杆菌,命名为AHcz-1株。
2.3 16S rRNA基因的PCR扩增及遗传进化分析 以提取细菌DNA为模板扩增分离菌的16S rRNA基因。结果显示,PCR扩增出一条约1500 bp的特异性条带,与预期结果一致(图2),测序结果显示其大小为1453 bp。将测序获得的16S rRNA基因序列使用NCBI中的BLAST进行检索,结果与奇异变形杆菌的同源性达99%以上,挑选10株核苷酸同源性较高的参考菌株进行同源性分析和系统发育分析,结果显示:分离株AHcz-1与日本株(AB932526.1)和美国株(CP029133.1)的同源性均为100%;系统发育树显示分离株AHcz-1与日本株(AB932526.1)亲缘关系较近,形成一簇,并且与美国株(CP029133.1)处于同一分支(图3),可进一步证明分离株AHcz-1为奇异变形杆菌。
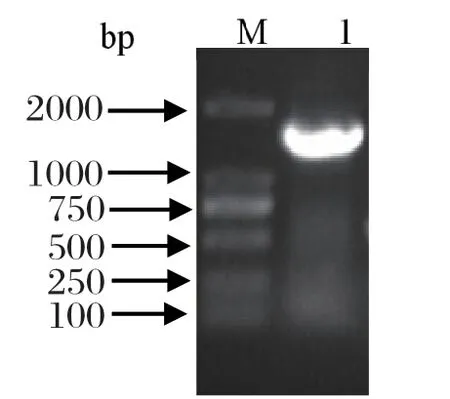
图2 16S rRNA 基因的 PCR扩增结果Fig.2 PCR amplification of the 16S rRNA gene
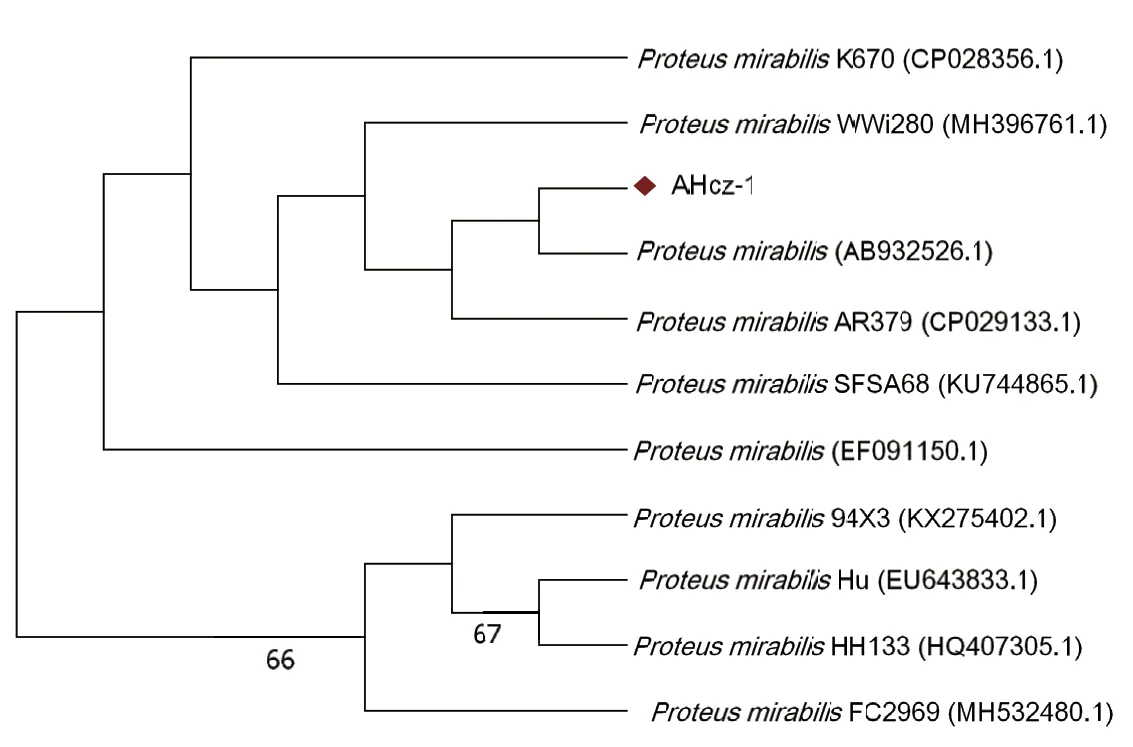
图3 分离菌株AHcz-1的16S rRNA基因系统进化树Fig.3 Phylogenetic tree based on 16S rRNA gene sequences of AHcz-1 strain
2.4 药敏结果 药敏试验结果显示,分离菌株AHcz-1仅对丁胺卡那敏感,对庆大霉素和恩诺沙星中度敏感,对阿莫西林、强力霉素、卡那霉素、新霉素等17种抗生素均不敏感(表2)。表明AHcz-1具有多重耐药性。
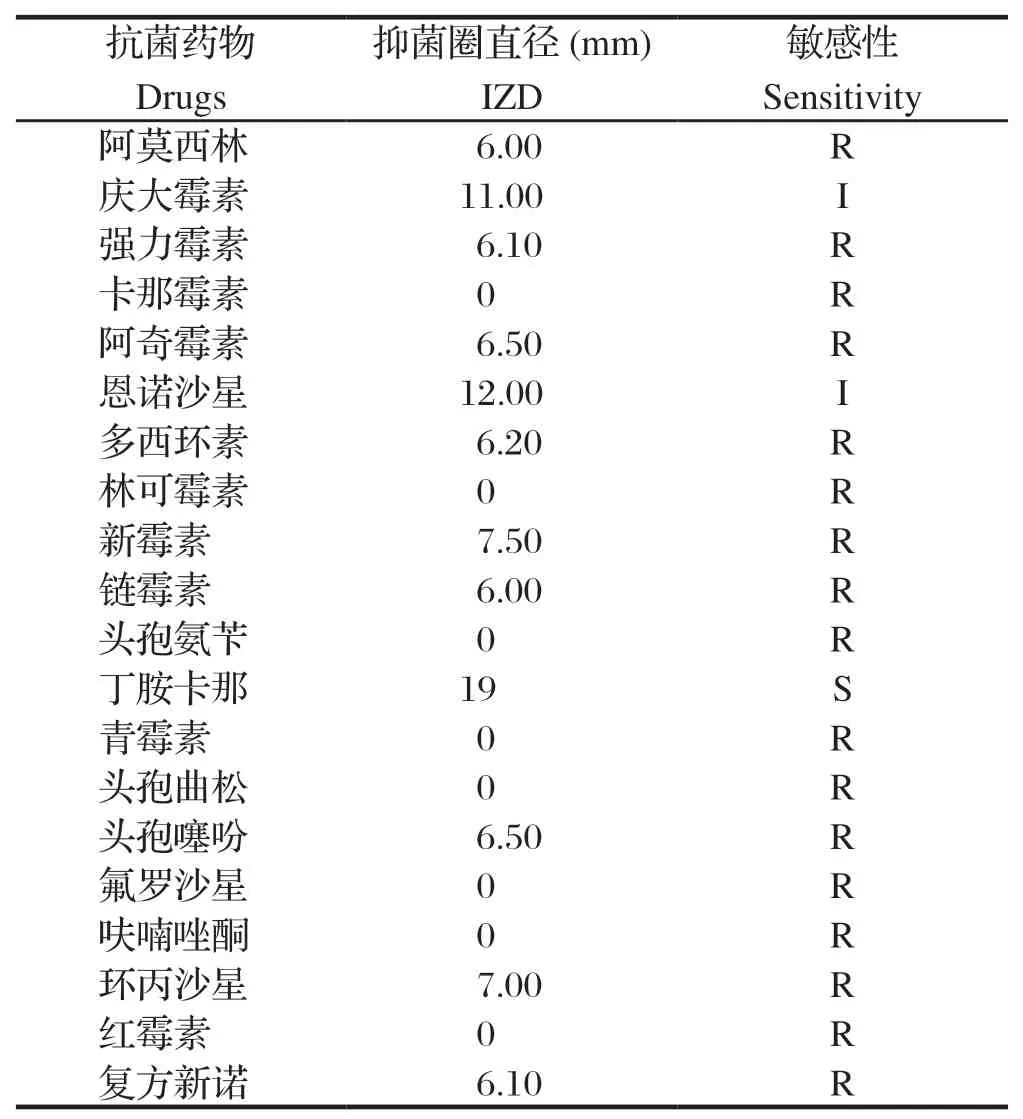
表2 分离菌株AHcz-1的药敏试验结果Table 2 Antimicrobial sensitivity test of the isolate AHcz-1
2.5 毒力相关基因的扩增及序列分析 利用特异性引物对分离菌株AHcz-1的mrpA、ucaA、pmfA、atfA、zapA、ureC、atfC、rsbA8种毒力基因进行PCR扩增,经凝胶电泳显示,扩增片段分别为510、552、544、342、516、290、438、2298 bp,与预期结果相符(图4)。菌株AHcz-1的mrpA、atfA、zapA、atfC基因序列与GenBank中挑选的6株参考株P.mirabilis(CP029133.1、CP028522.1、CP0 283 56.1、CP02 65 81.1、CP0 26051.1、CP023273.1)进行同源性分析,结果显示mrpA、atfA、zapA基因与6株参考株所对应的基因序列同源性为99.0%~99.8%,而atfC基因同源性较低,为97.5%~98.9%,遗传进化树显示atfC、atfA基因与北京株(CP026581.1)在同一分支,mrpA基因与与瑞典株(CP023273.1)在同一分支,同源性高达99.8%,而zapA基因与瑞典株(CP023273.1)同源性最低为99.0%,且其它参考株处在不同分支;菌株AHcz-1的另外4种毒力基因ucaA、pmfA、ureC、rsbA分别与GenBank中挑选的参考株P.mirabilis(CP021550.1、CP023273.1、CP028522.1、CP026059.1、CP029133.1、CP026581.1、CP028356.1、CP015347.1、CP021852.1、CP026051.1、CP026044.1、CP004022.1)中对应的6株参考株进行同源性分析,结果显示,ureC基因和rsbA基因与美国株(CP026051.1)同源性分别为100%和99.5%,系统发育树显示ureC基因和rsbA基因与美国株(CP026051.1)均在同一分支,且rsbA基因与美国株(CP029133.1)在同一分支,而pmfA基因与美国分离的两株参考株(CP029133.1、CP026051.1)同源性最低,距离最远。ucaA基因与挑选的6株参考菌株所对应的基因序列同源性93.2%~98.8%,系统发育树显示,其与瑞典株(CP023273.1)形成一簇,并与意大利株(CP015347.1)处于同一分支,同源性均高达99.8%,而与美国株(CP029133.1)处在两个不同的分支,距离较远,同源性最低。进化树分析显示,分离菌株与参考菌株对应毒力基因的同源性在93.2%~100%,且进化树都分为两大分支,表明AHcz-1株与参考菌株间存在一定的差异性,这可能与不同的血清型和亚型群有关。
氨基酸序列分析结果显示,pmfA、atfA、ureC基因均未检出突变氨基酸,atfC基因序列第8、13位存在G→C、T→A点突变,导致其所在位置的遗传密码子GGG、TTA突变为GCG、ATA;mrpA基因序列在502位和505位存在C→A、A→T点突变,导致其所在位置的遗传密码子由CTG、ACT突变为ATG(起始密码子)、TCT;rsbA基因序列在4、7、2159、2216位存在A→G、T→A、A→G、A→G点突变,导致其所在位置的遗传密码子AAA、TAT、AAC、AAA突变为GAA、AAT、AGC、AGA;ucaA基因序列在525位存在T→A点突变,其所在位置的遗传密码子AGT编码丝氨酸,突变为AGA编码精氨酸;zapA基因序列在506、507位存在A→G、G→A点突变,其所在位置的遗传密码子AAG突变为AGA。8种毒力基因的氨基酸序列分析显示pmfA、atfA、ureC基因均未发生突变变异,atfC、mrpA、rsbA、ucaA、zapA基因序列存在少部分的碱基突变,与参考菌株同源性较高,表明安徽分离菌株AHcz-1的部分毒力基因存在不同程度的变异。
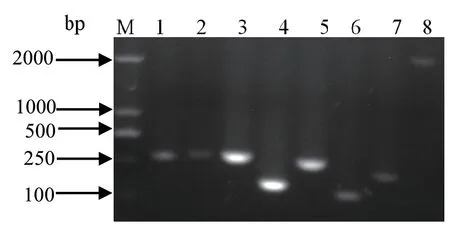
图4 毒力基因PCR扩增Fig.4 The PCR results of virulence genes
2.6 动物致病性试验 健康的雏番鸭肌肉注射分离菌株的菌液后,每天观察番鸭出现的症状和死亡数,感染组雏番鸭出现了精神沉郁、呼吸困难、站立不稳等症状,与送检症状一致。感染6 h后开始陆续发病,12 h时死亡4只,16 h时死亡2只,24 h时死亡1只,24 h内全部死亡,对照组均未出现异常。从死亡雏番鸭脏器中分离细菌,并对分离菌进行染色镜检、细菌培养和生化试验,结果显示与接种菌特性一致,表明分离菌株AHcz-1具有较强的致病性。
3 讨论
奇异变形杆菌是一种重要的人兽共患的条件性致病菌,可对畜禽养殖业造成了巨大经济损失。目前,国内不断有奇异变形杆菌感染动物致死的报道[8-9],本研究是安徽首例番鸭感染奇异变形杆菌致死的报道。由奇异变形杆菌引起的发病率和病死率逐年增加,防控形势十分严峻,因此加强对该菌的防治和管控显得尤为重要。
本研究在依据细菌的菌落形态、生长特性、生化特征对分离菌进行细菌分类鉴定的基础上,采用16S rRNA基因序列同源性分析进行细菌的分子鉴定。BLAST检索表明,分离菌与奇异变形杆菌的同源性达99%以上,进一步证实分离菌AHcz-1为奇异变形杆菌,同源性比对和进化树结果显示:AHcz-1和10个代表菌株的同源性为99%~100%。进化树中分离菌株AHcz-1与日本株(AB932526.1)形成一簇,并与美国株(CP029133.1)处于相对独立的遗传分支,亲缘关系较近,但与印度株(KX275402.1、HQ407305.1)、河南株(EU643833.1)、北京株(MH532480.1)距离很远,这4株参考株处于独立的遗传分支,其余菌株位于同一大分支。表明11株奇异变形杆菌或许由于在地理位置上分布广,没有展现明显的地域特异性或物种特异性。有研究显示,羊源和虎源奇异变形杆菌的系统发育树分析也得出相似结论[10-11]。笔者根据已报道的基因序列设计奇异变形杆菌的mrpA、ucaA、pmfA、atfA、zapA、ureC、atfC、rsbA8种毒力基因引物,通过PCR扩增和毒力基因序列分析研究分离菌AHcz-1毒力基因携带及变异情况。结果显示,8种毒力基因在分离菌株AHcz-1中均被检测到,氨基酸序列分析显示pmfA、atfA、ureC基因均未发生突变变异,atfC、mrpA、rsbA、ucaA、zapA基因序列存在少部分的碱基突变。同时,尹有勤等[12]也对鹅源奇异变形杆菌的8种毒力基因氨基酸分别进行分析,发现pmfA、atfA、ureC、atfC基因均未检出突变变异,rsbA、ucaA、zapA和mrpA基因存在少部分碱基点突变和碱基缺失;鹅源和番鸭源的奇异变形杆菌均被检测出8种毒力基因,且部分毒力基因rsbA、ucaA、zapA和mrpA都存在不同程度的变异,均具备较强的致病力。由于先前的报道并未系统性的比较毒力基因携带及变异情况与菌株毒力强弱的关系,因此我们只能推测毒力基因携带及变异情况与菌株的致病力是具有一定的相关性的,而对毒力特征的掌握可为奇异变形杆菌的致病性、传播性提供宝贵的参考以及为后续防控奠定一定的基础。
本研究中的药敏结果与王豪举等[13]从病羊脏器分离到的一株奇异变形杆菌耐药性结果相近,即奇异变形杆菌对丁胺卡那霉素敏感,对喹诺酮类的氟罗沙星和环丙沙星、青霉素类的青霉素和阿莫西林均产生不同程度的耐药;而黄锐敏等[14]从食物中毒分离到的47株奇异变形杆菌对环丙沙星敏感,对头孢拉啶产生耐药;说明不同来源的奇异变形杆菌对抗生素的敏感性存在差异,并且存在多重耐药性。有研究显示产生多重耐药性的原因可能与奇异变形杆菌携带编码β内酰胺酶基因有关,其耐药机制有待进一步研究[15-17]。刘晓丹等[18]对氨基糖苷类的菌株进行检测,结果显示53株氨基糖苷类耐药菌株中有10株对阿米卡星耐药,30株对庆大霉素耐药,49株对妥布霉素耐药,发现同一株菌对同类抗生素出现不同敏感性的问题,这可能与耐药基因的携带情况有关。本研究也发现同一株菌对同类抗生素出现了不同敏感性的问题,符合这一特征。由于人和动物携带该菌机率高,当机体抵抗力下降时,可以使人和动物感染,防控难度较大,因此加强对该病原菌的防控及毒力相关基因研究显得十分重要。本研究通过分离鉴定、药敏检测及毒力基因分析等为番鸭源奇异变形杆菌的临床诊断、临床用药及遗传变异研究提供参考。

