非洲猪瘟病毒TaqMan探针法荧光定量PCR检测方法建立
任 名,牛婷婷,于婉琪,孙海伟,邬 静,陈鸿军
(1.中国农业科学院上海兽医研究所,上海 200241;2.湖南农业大学动物医学院,长沙 410128)
非洲猪瘟(african swine fever,ASF)是由非洲猪瘟病毒(African swine fever virus,ASFV)感染猪的一种高度接触性传染性疾病,主要引起出血热,导致家猪几乎100%死亡[1]。世界动物卫生组织(office international des épizooties,OIE)将ASF列为必须报告动物疫病,我国将其列为一类动物疫病,一直是重点防控的外来烈性动物传染病[2]。1921年,英国兽医学家Montgomery等[3]首次报道肯尼亚ASF疫情。经过近100年的传播,该病毒从欧洲大陆蔓延到俄罗斯远东,至2018年8月3日,我国辽宁省沈阳市确诊首例非洲猪瘟疫情[3],随后在河南、江苏、浙江、安徽、黑龙江、内蒙、吉林、天津等17个省直辖市发现ASF疫情,现已扑杀几十万头猪只,造成难以估量的损失[4]。
非洲猪瘟病毒是已知唯一的虫媒DNA病毒,以非洲野猪和软蜱为天然宿主,具有独特的宿主和生态循环(野猪-蜱-家猪)特征。该病毒拥有庞大而复杂的基因组(170~194 kb),编码超过150~167个基因,病毒结构蛋白就有50多个,其中P72衣壳蛋白占整个病毒粒子总蛋白的32%,抗原性稳定。ASFV的毒力基因尚不明确,超过一半的基因至今功能未知[5]。ASFV根据P72序列分类,至少分为24个基因型,其中北非为基因Ⅰ型,俄罗斯、东欧、高加索地区主要为基因Ⅱ型,而中国目前暴发的ASFV也主要为基因Ⅱ型[6]。
目前世界上尚无有效的ASF疫苗。在该病流行国家,消灭ASF主要基于科学的诊断程序。一旦确诊感染,动物立刻采取全扑杀措施。由于ASFV不同分离株间的发病特性差异较大,与其他出血性猪病的临床症状极为相似,因此,ASF的临床诊断比较困难[7]。ASFV的诊断技术主要分为病毒抗原检测和特异性抗体检测。抗体只有在病毒感染至一定时期后才能产生,目前我国流行的急性感染猪只几乎检测不到阳性抗体产生[8]。为了快速明确该病原,分子诊断技术成为主要确诊手段。实时荧光定量聚合酶链式反应(real-time PCR,qPCR)已被用于监测ASFV感染[9],OIE ASFV诊断标准中也采用的是基于P72基因建立的qPCR方法,但由于该方法中P72基因的反向引物中涉及到兼并引物,而我国目前流行株序列主要为其中一种类型的基因序列[4],因此,通过对P72基因的序列比对,本研究重新在该区域设计一条特异性反向引物,摸索建立一套ASFV荧光定量PCR方法,这将为我国ASFV快速确诊提供较为可靠的分子工具。
1 材料与方法
1.1 主要试剂 荧光定量TaqMan Universal PCR Master Mix购自Applied Biosystems公司;RNA反转录试剂盒PrimeScript RT kit购自TaKaRa公司;TIANamp病毒RNA提取试剂盒购自QIAGEN公司;病毒基因组DNA提取试剂盒购自QIAGEN公司;质粒DNA提取试剂盒购自天根生物有限公司;引物合成与测序工作由金唯智生物技术(苏州)公司完成。
1.2 病毒 猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)HuN-112弱毒株、猪瘟病毒(Classical swine fever virus,CSFV)石门株、猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)、H3N2亚型猪流感病毒(Swine influenza virus,SIV)A/Swine/Henan/3/14均由本实验室保存。常规提取上述病毒RNA,经反转录合成cDNA备用。猪伪狂犬病毒(Pseudorabies virus,PRV)Bartha弱毒株、猪细小病毒(Porcine parvovirus,PPV)NADL-2弱毒株、猪圆环病毒2型(Porcine circovirus type 2,PCV2),猴免疫缺陷病毒(Simian immunodeficiency virus,SIV)均由本实验室保存,常规提取各病毒DNA。以上病毒核酸均在-80℃保存备用。
1.3 标准质粒构建与引物设计 含有ASFV SY18毒株P72基因序列的质粒标准品pcDNA3-P72由本实验室构建,其中P72基因片段由军事医学科学院军事兽医研究所扈荣良研究员馈赠。通过BLAST比对分析,选择保守特异区域设计引物和探针,在1627~1876 bp区域设计特异性引物和TaqMan探针。qP72F:5'-CTGCTCATGGTATCAATCTTATCGA-3';qP72-216R:5'-CGTAATCCGTGTCCCAACTA-3';FAM-P72:5'-FAM-CCACGGGAGGAATACCAAC CCAGTG-3'-TAMRA。同时设计O I E推荐的反向引物,命名为q P72 R(OIE),序列为:5'-GATACCACAAGATC(AG)GCCGT-3'。

图1 P72基因片段的引物位置Fig.1 Location of the primers in P72 gene fragment
1.4 荧光定量PCR反应体系和反应条件 TaqMan荧光定量PCR扩增反应总体系(20 μL)为:Premix ExTaq(Probe qPCR)(2×)10 μL,ROX Reference Dye Ⅱ(50×)0.2 μL,DNA模板2 μL,经优化后的qP72-F/qP72-216R(10 μmol/L)各0.4 μL,FAM-P72探针(10 μmol/L)0.8 μL;OIE方法组:qP72-F/qP72R(OIE)(10 μmol/L)各0.4 μL,FAM-P72探针(10 μmol/L)0.8 μL,分别用灭菌ddH2O补足20 μL。优化后的反应条件为:95℃预变性30 s;95℃变性5 s,60℃退火延伸34 s,采集荧光45个循环。
1.5 荧光定量PCR的敏感性试验、重复性试验 将1×107copies/μL pcDNA3-P72的重组质粒,进行10倍梯度稀释,使其浓度依次为1×107~1×100copies/μL作为标准品模板,以ddH2O为对照,分别使用自设引物和OIE引物进行TaqMan探针PCR法的灵敏度检测;同时进行PCR方法的灵敏度对比。以1×106和1×104copies/μL稀释度的pcDNA3-P72质粒标准品作为模板,进行批内重复性试验和批间重复性试验。方法的重复性以批内和批间的Ct值变异系数(标准偏差/重复值平均数)来评估。
1.6 特异性试验 利用PRRSV、PRV、PPV、CSFV、PEDV、SIV、PCV2的基因组作为模板,进行特异性实验。具体参照上述方法进行。
2 结果
2.1 OIE引物和自设引物的PCR扩增结果 将质粒标准品pcDNA3-P72以10倍倍比稀释,最终浓度分别在1×107~1×100copies/μL,利用qP72-F和qP72-216R或qP72R(OIE)引物PCR扩增。结果显示:使用OIE引物和自设引物均能检测到特异性条带,灵敏度差异不显著,即扩增条带分别为250 bp和216 bp。利用两套引物进行PCR,最低可检测到ASFV的DNA含量为1×103copies/μL(图2)。

图2 PCR检测结果Fig.2 The results of PCR test
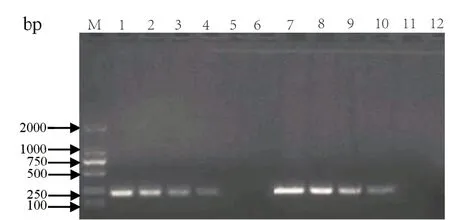
图3 PCR灵敏度测定Fig.3 Sensitive test of the conventional PCR
2.2 染料法荧光定量PCR标准曲线及熔解曲线 将构建的pcDNA3-P72质粒标准品按10倍倍比稀释,最终浓度分别在1×108~1×101copies/μL,按优化的方法进行SYBR Green Ⅰ染料法荧光定量PCR,绘制标准曲线和熔解曲线。结果显示,qP72-F/qP72-216R引物对无引物二聚体,标准曲线相关系数R2为0.9932(图4)。而OIE推荐的兼并引物对qP72-F/qP72-R(OIE)出现高、低两种峰(图5),标准曲线的相关系数R2为0.9842(图5)。这说明qP72-F/qP72-216R引物对较为特异,且退火温度更为合适。
2.3 TaqMan探针法qPCR的灵敏度与重复性检测 以pcDNA3-P72质粒标准品为模板,按1×105~1×100copies/μL倍比稀释,进行TaqMan探针法荧光定量PCR扩增。结果显示,利用qP72-F/qP72-216R引物对扩增的结果具有良好的重复性,最低可检测模板浓度为10 copies/μL,约为10 fg DNA量,比普通PCR方法高100倍以上(图6)。以pcDNA3-P72质粒标准品中的1×104和1×102copies/μL 2个稀释度的DNA作为模板,进行2次重复测定,对同一模板设置3次重复孔。按照优化的扩增体系和条件进行TaqMan探针法实时荧光定量PCR。结果表明,批内和批间变异系数均小于1%。这说明建立的基于P72基因TaqMan探针荧光定量PCR方法具有较好的重复性,结果稳定可靠(表1)。
2.4 特异性试验 用于特异性检测的所有病毒核酸模板浓度统一稀释为50 ng/μL,反应条件和反应体系均参照上述优化方法进行。结果可见,通过建立的TaqMan探针荧光定量PCR检测方法,分别对PRRSV、PRV、PPV、CSFV、PEDV、SIV进行特异性检测,除标准品有阳性扩增曲线外,其他病毒的扩增曲线Ct值高于40。这说明该方法特异性良好。
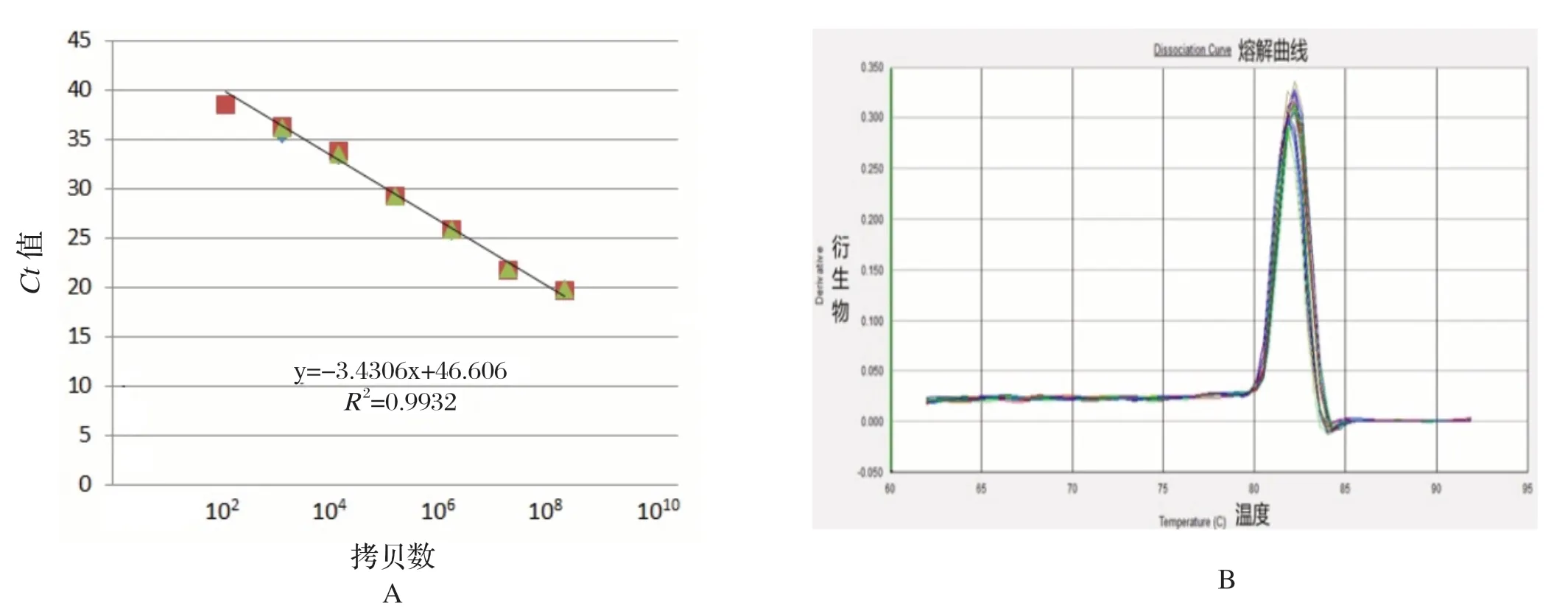
图4 利用qP72-F/qP72-216R引物对进行荧光定量PCR检测方法的标准曲线(A)及熔解曲线(B)Fig.4 Standard curve (A) and melting curve of SYBR-Green qPCR method (B) with the primers of qP72-F/qP72-216RZ

图5 利用qP72-F/ qP72-R(OIE)引物对进行荧光定量PCR检测方法的标准曲线及熔解曲线Fig.5 Standard curve and melting curve of SYBR-Green qPCR method with the primers of qP72-F/qP72-R(OIE)
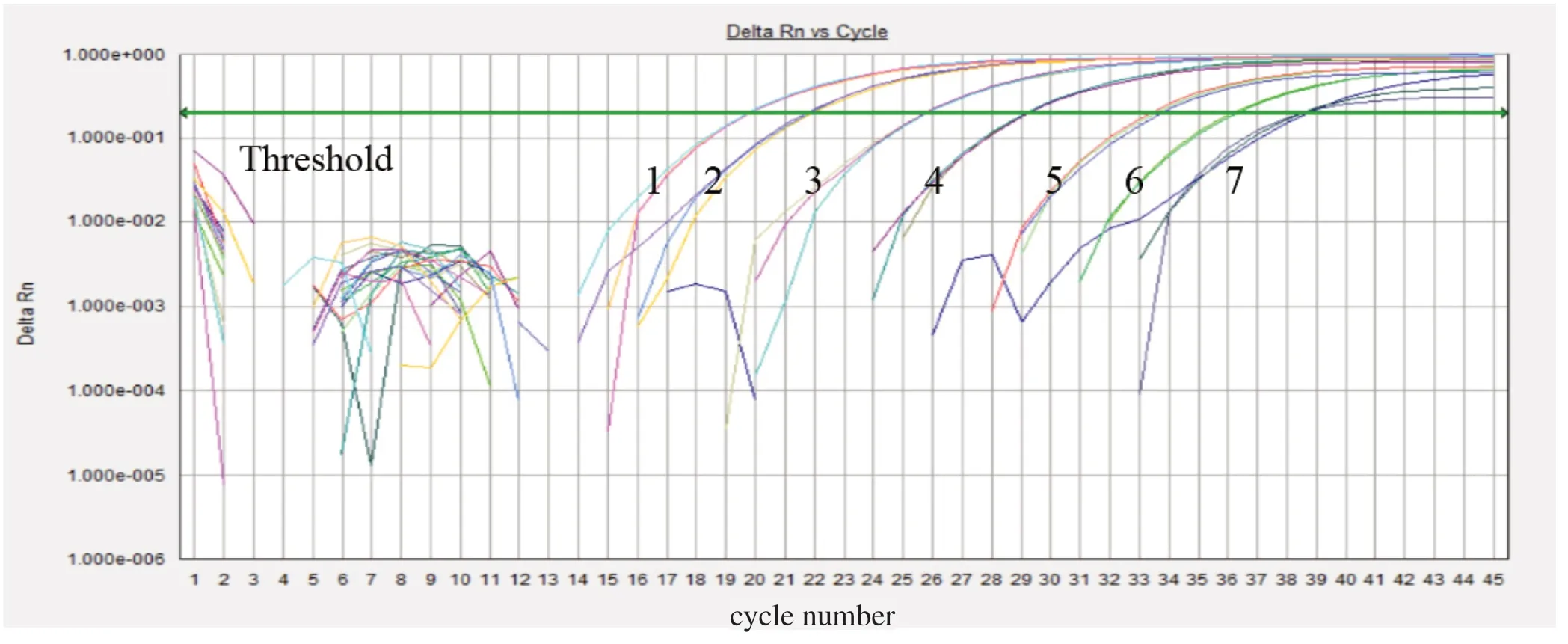
图6 TaqMan探针法qPCR动力学曲线Fig.6 Dynamic curve of TaqMan probe qPCR method

表1 TaqMan探针荧光定量PCR检测方法重复性Table 1 Repeatability of TaqMan probe real-time quantitative PCR method
3 讨论
截止2018年11月12日,非洲猪瘟疫情已经在国内暴发65起。目前农业农村部还在进行各地排查工作。在临床诊断上,ASFV的确诊显得尤为重要。ASFV可编码数量众多、功能多样的病毒蛋白,这些蛋白促进病毒增殖,更有效地破坏宿主细胞,引发导致猪只发病和死亡。P72蛋白是ASFV的主要结构蛋白,由B646L基因编码,在病毒感染后期表达,是非常保守的病毒抗原,对病毒颗粒衣壳的形成至关重要,是病毒二十面体衣壳的重要组成成分[10]。由于该蛋白mRNA含量和蛋白表达量最为丰富,同时基于B646L基因序列的高度保守性,选择P72基因作为靶基因建立ASFV实时荧光定量PCR检测方法可以更加敏感地检测病毒复制情况[11]。以ASFV的P72基因片段为模板,张泉等[12-13]建立了实时荧光定量PCR检测方法,该方法灵敏度高,可检测到20~100个拷贝数。除了P72基因,董志珍等[14-16]建立了基于P54、K205R、CP530R等多种靶基因的荧光定量PCR技术。
在ASFV感染后期,抗体才会出现,因此,目前商品化的抗体检测方法无法用于监测该病流行情况。据国家动物外来病研究中心报道,利用多种抗体检测试剂盒未见血清阳性,因此,抗体检测方法用于监测该病目前在国内的感染和流行情况存在明显局限性[17]。而PCR技术在本次疫病流行和确诊中占据了关键核心地位。PCR方法可以检测出血液、粪便、分泌物、冷冻肉等多种样品ASFV的遗传物质DNA,因此,一直是ASFV早期诊断主要方法[18]。而实时荧光定量PCR检测技术将PCR与荧光检测结合起来,克服了传统PCR方法的费时、易污染、后需电泳检测等缺点,可进行微量检测,具有操作简单、结果直观、敏感性高、特异性强、重复性好等诸多优点。在荧光定量PCR方法中,常使用的荧光标记有SYBR Green I和TaqMan探针两种染料,前者的阈值受到线性扩增产物和引物二聚体等影响,降低了准确性和灵敏度,而TaqMan探针法则在准确性、灵敏度上明显优于SYBR GreenⅠ法[19]。
本研究对比OIE推荐的荧光定量PCR引物序列,从熔解曲线结果可见,qP72-F/qP72-216R引物对无引物二聚体,标准曲线相关系数R2为0.9932(图4),而OIE推荐的兼并引物对qP72-F/qP72-R(OIE)出现高低两种峰,标准曲线的相关系数R2为0.9842(图5),这说明qP72-F/qP72-216R引物对较为特异。利用优化的引物和探针,利用合成的P72基因质粒进行模拟病毒DNA检测,对建立的荧光定量PCR方法进行重复性、灵敏度、特异性测定,结果可见,该方法最低可检测模板浓度为10 copies/μL,约为10 fg DNA量,比普通PCR方法高100倍以上。本研究建立的TaqMan探针法荧光定量PCR检测方法为非洲猪瘟病毒的临床筛查提供了良好的检测工具。

