绵羊肺源致病性大肠杆菌的分离鉴定及耐药性研究
郭强强,杨彩虹,柴迎锦,顾晓晓,钟发刚,黄 新,张星星,吴桐忠,李 劼,韩猛立,周 霞
(1.新疆农垦科学院 省部共建绵羊遗传改良与健康养殖国家重点实验室,石河子 832000;2.武威市工业企业人才交流开发服务中心,武威 733000;3.石河子大学动物科技学院,石河子 832003)
绵羊呼吸系统疾病是严重危害养羊业健康发展的一类疾病,患病羊多表现为流涕、咳嗽、鼻腔流出大量分泌物、呼吸困难等临床症状,造成了严重的经济负担。临床资料表明,该疾病的发生除了与环境、饲养管理、绵羊机体免疫状态有关外,细菌性病原如巴氏杆菌、支原体以及大肠杆菌等也是引起疾病发生的主要原因[1],尤其肠外大肠杆菌的分离率非常高。肠外致病性大肠杆菌(extraintestinal pathogenicEscherichia coli,ExPEC)可在人和动物中引起多种肠道外感染和疾病,其典型特征为多器官感染,包括尿道感染、脑膜炎、多发性浆膜炎、乳腺炎、肺炎和败血症。在ExPEC中已经发现了多种毒力因子,包括致病性相关毒力岛(PAI)、黏附素、侵袭素、毒素、表面抗原、铁摄取系统和分泌系统等[2]。除了在规模化猪场临床样品中发现之外,它还广泛存在于零售的鸡肉、牛肉、猪肉和即时食品中[3-4],对公共卫生造成了潜在威胁。
近段时间,新疆石河子地区部分规模场羔羊出现死亡病例,病畜大都呈现采食量减少、体温升高、咳嗽喘气、口鼻流涎、严重呼吸困难等症状,最后因呼吸衰竭而死亡;剖检可见病死羊肺脏和胸腔壁相粘连,出现大面积肉变,并伴有白色化脓灶。为查明绵羊死亡的细菌性病原,本研究以死亡病羊为研究对象,采集病变组织,通过常规方法分离细菌的鉴定、16S rRNA序列分析鉴定分离菌、动物试验确定该分离菌致病性,用PCR方法检测所分离菌携带的ExPEC特异性毒力因子和耐药基因,同时对分离菌进行了药物敏感性试验,本研究结果为该地区羊场绵羊呼吸道疾病的防控和药物治疗提供依据。
1 材料与方法
1.1 病料采集 2017年11月至2018年3月,采集新疆石河子地区规模场因呼吸道症状引起死亡的绵羊肺脏组织10份。
1.2 实验动物及主要试剂 昆明系小鼠购自石河子大学动物实验中心;药敏纸片(21种)购自杭州天和微生物试剂有限公司;PCRTaqMix、DNA marker购自宝生物(大连)有限公司;全自动细菌生化鉴定仪(VITEK 2 COMPACT)购自生物梅里埃公司。
1.3 细菌的分离鉴定 无菌采集病死绵羊肺脏组织,分别划线接种于绵羊血琼脂平板和新鲜营养肉汤,培养纯化后利用全自动细菌生化鉴定仪对分离菌进行生化鉴定(47种反应),同时将分离菌接种麦康凯培养基和伊红美蓝培养基。
1.4 细菌基因组的提取和16S rRNA序列分析 提取分离细菌基因组,根据GenBank公布的大肠杆菌16S rRNA(LC217387.1)序列设计引物,F:5'-GC GGACGGGTGAGTAATGT-3',R:5'-TCATCCTC TCAGACCAGCTA-3'。PCR扩增产物连接T载体后送至新疆昆泰锐生物技术有限公司测序,测序结果与GenBank中基因序列进行Blast比对分析。
1.5 小鼠致病性试验 小鼠按0.2 mL/只(6×108cfu/mL)剂量腹腔注射细菌,剖解死亡小鼠进行细菌的分离鉴定。
1.6 分离株毒力因子检测及测序 根据参考文献[5-7]设计并合成黏附素基因(papA、sfaS、afa、focG)、毒素基因(hlyD、vaT)、铁摄取系统基因(熬铁蛋白受体iutA、肌动蛋白受体ireA)和毒力岛fyuA等ExPEC毒力基因的9对引物,引物均由生工生物工程(上海)股份有限公司合成。PCR扩增9种毒力因子基因,送至新疆昆泰锐生物技术有限公司测序。
1.7 药物敏感性试验 按照CLSI标准采用纸片扩散法,以E.coliATCC 25922作为质控菌株,使用常用21种新药敏纸片(青霉素、阿莫西林、头孢唑啉、头孢他啶、头孢拉定、头孢哌酮、链霉素、庆大霉素、多西环素、麦迪霉素、氟苯尼考、丁胺卡那、多粘菌素B、诺氟沙星、恩诺沙星、环丙沙星、氧氟沙星、复方新诺明、阿奇霉素、米诺环素和克林霉素),根据抑菌圈大小判断分离细菌对药物的敏感程度。
1.8 耐药基因检测及测序 根据参考文献[6]设计并合成氨基糖苷类(aadA1/aadA2),喹诺酮类(strA、strB),β-内酰胺类(Bla(TEM1)、Bla(PSE1)和Bla(OXA1))和四环素类(Tet A、Tet B)等大肠杆菌耐药基因的8对引物,获得的PCR扩增产物送新疆昆泰锐生物技术有限公司测序。
1.9 绵羊肺脏病理组织学观察 无菌采集病死绵羊肺脏组织固定,按常规方法制作石蜡切片,HE染色,显微镜观察病变。
2 结果
2.1 细菌分离鉴定 从病羊肺脏组织分离到10株G-细菌,经细菌生化鉴定仪鉴定均为大肠杆菌(可信度99%)。PCR扩增大肠杆菌16S rRNA序列,目的条带大小为202 bp。扩增序列与E.coli参考株CP020933.1、KY906967.1、LC259015.1等相似性均为99%以上,编号为XJ-01~10。
2.2 分离株致病性试验结果 10株分离菌株均在6~40 h内致小鼠死亡,且从死亡小鼠能分析到和接种菌生物学特性一致的细菌,部分菌株死亡曲线见图1。
2.3 ExPEC毒力因子扩增结果 对9种ExPEC毒力因子进行PCR检测,毒力因子iutA、fyuA和ireA的检出率为100%,afa的检出率为10%,hlyD的检出率为40%,未检测到papA、sfaS、focG和vaT(表1)。毒力因子的PCR测序结果与GenBank参考序列的相似性大于99%。

图1 部分分离菌株死亡曲线Fig.1 The death curve of partial isolated strains
2.4 药物敏感性试验结果 10株ExPEC都呈多重耐药,对诺氟沙星、恩诺沙星、环丙沙星、氧氟沙星、复方新诺明、阿奇霉素、米诺环素、克林霉素、青霉素、阿莫西林、头孢唑啉、头孢拉定、链霉素、庆大霉素、多西环素、麦迪霉素、氟苯尼考等17种常用抗生素表现不同程度的耐药,对头孢他啶、头孢哌酮、多粘菌素B和丁胺卡那较为敏感(表2)。
2.5 耐药基因检测结果 所有耐β-内酰胺类菌株都扩增出Bla(TEM1)和Bla(OXA1)基因,未检测到基因Bla(PSE1);在耐氨基糖苷类抗生素菌株中,strA、strB和aadA1/aadA2的检出率分别为100%、75.0%和62.5%;氨基糖苷类抗生素敏感菌株中,strB的检出率为100%,strA的检出率为50%,未检测到aadA1/aadA2;在耐四环素类抗生素菌株中,Tet A和Tet B的检出率分别为66.7%和100%,对四环素类敏感的菌株中Tet A和Tet B的检出率为14.3%和57.1%(表3)。

表1 分离菌株XJ-01~10毒力因子检测结果Table 1 The detection results of virulence factor from isolates XJ-01-10

表2 10株大肠杆菌药敏试验结果Table 2 Drug susceptibility test results of 10 strains E.coli
2.6 病理学观察结果 病变绵羊肺脏支气管管腔充满渗出物,有大量红细胞和炎性细胞(图2A);肺脏肺泡壁界限不清,肺脏间质内可见大量红细胞和淋巴细胞(图2B);对照组绵羊肺脏未见明显的病理学变化(图2C和2D)。
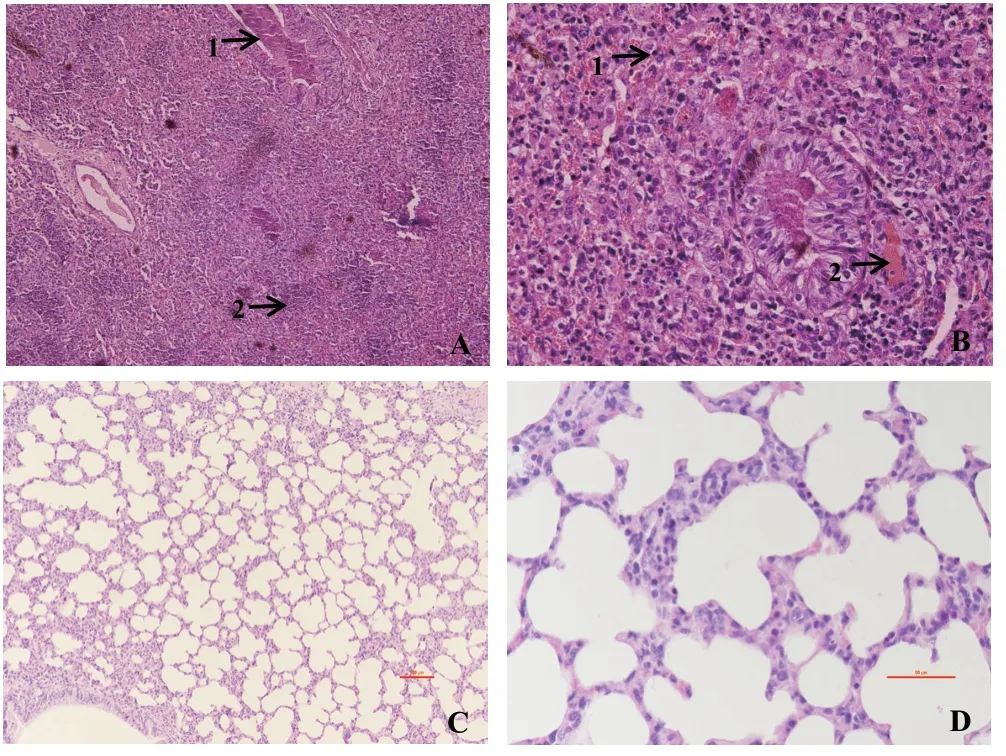
图2 绵羊肺脏病理组织切片Fig.2 Paraffin sections of lung tissue from sheep
3 讨论
引起绵羊呼吸系统疾病病原主要有绵羊肺炎支原体、多杀性巴氏杆菌、溶血性曼氏杆菌、绿脓杆菌、链球菌和奇异变形杆菌等,同时绵羊肺腺瘤反转录病毒(SPA)和副流感3型病毒也可以引起不同年龄段绵羊发病[1,8]。陶立等[1]从广西某一山羊场患呼吸道症状的病死羊肺脏组织分离出黏质沙雷氏菌和大肠杆菌,本研究先后从表现为呼吸道感染症状的10份病死绵羊肺脏样品分离的细菌均为大肠杆菌,具有较强的致病性,结合特异性毒力因子基因的检测结果,推测绵羊肺源ExPEC可能是该段时间内导致绵羊死亡的主要细菌性病原。

表3 ExPEC分离株对抗生素耐药表型与耐药基因符合率检测结果Table 3 Comparing results of antimicrobial resistant phenotype and gene to isolated strains
本研究涉及了9种ExPEC常见的毒力因子基因,分离菌株检测到其中的5种,即ireA、iutA、fyuA、afA和hlyD,其中10株菌均携带ireA、iutA和fyuA;iutA和ireA参与细菌铁的摄取,在细菌对机体的成功感染和形成菌血症起重要作用。马增军等[9]从猪源ExPEC中检测出了ler、iutA、irp2、fyuA和astA,其中iutA和fyuA检出率较高,未检测到afa,并且发现同时携带iutA、fyuA和ler基因的菌株致病性最强。本研究在XJ-07株菌中检测到afa,在XJ-02-XJ-05株检测到了hlyD,但afa和hlyD检出率也很低(分别为10%和40%)。在动物致病性试验中发现,携带毒力基因多的菌株对小鼠致病力强,XJ-02和XJ-07株可以在较短时间内致小鼠死亡,表明多种毒力因子综合作用可能是ExPEC高致病性的主要原因。国外学者研究表明,与铁摄取系统相关基因,细菌粘附素,毒素,侵袭素等在人和动物感染ExPEC中最为常见[4-5]。
刘正明等[10]对羊源性大肠杆菌药物敏感研究表明,分离株耐7种以上药物的比率达到94.4%;曾博等[11]研究发现,西南地区猪源ExPEC对头孢噻吩(KF)和头孢氨苄(CL)有很高的耐药水平。本研究中的10株菌普遍呈现多重耐药现象,对β-内酰胺类、喹诺酮类、四环素类药物都表现不同程度耐药;在β-内酰胺类基因中Bla(TEM1)和Bla(OXA1)的检出率最高,未检测到Bla(PSE1)。底丽娜等[12]分别发现在内蒙古地区羊源E.coli和新疆牛羊源E.coli中,检测率最高的β-内酰胺酶基因也是Bla(TEM1)。Sunde等[13]报道在耐氨基糖苷类抗生素大肠杆菌中主要的耐药基因是strA和strB,本研究除了strA和strB之外还检测到aadA1/aadA2。在耐四环素类抗生素菌株中检测到了tetA和tetB,表明分离株ExPEC对四环素的耐药性主要由tetA和tetB基因编码所致。ExPEC菌株和普通致病性E.coli相比,耐药性和毒力更强[14],具有多重耐药性的超级细菌的分离率也在逐渐增加[15],对兽医临床健康和公共卫生安全构成重大威胁。生产中应当通过药敏试验合理安排药物配伍,减少用药,降低ExPEC菌株耐药性的产生和传播。

