胰十二指肠切除术中胰管内引流与外引流的疗效分析
冯永恒 潘超 周琎 张磊 杨坤兴
南京医科大学附属南京医院(南京市第一医院)普外科,南京 210006
【提要】 根据87例胰十二指肠切除术患者术中胰液的引流方式分为内引流组(39例)和外引流组(48例)。两组患者的一般情况、术后临床相关胰瘘发生率、术后其他并发症(腹腔内出血、消化道出血、腹腔感染、胃排空障碍)总发生率、二次手术率、病死率和住院时间的差异均无统计学意义,但外引流组C级胰瘘发生率显著低于内引流组(2.1%比12.8%),差异具有统计学意义(P<0.05)。两组总体疗效差异无统计学意义,均为安全、可行,但外引流组可以更好地预防严重胰瘘。
PD是腹部外科最复杂的手术之一,切除脏器多,消化道重建复杂,手术时间长,术后并发症发生率高达20%~50%[1]。术后胰瘘最为常见,发生率可达10%~30%[2],且胰瘘引发的严重并发症可导致近50%的患者死亡[3]。因此如何有效地预防和控制PD术后胰瘘一直以来都是外科医师关注和讨论的焦点。近年来,主胰管内放置支撑管被认为是减少胰肠吻合口瘘的一项有效措施,但支撑管内引流还是外引流的效果目前尚无统一定论。为此,本研究选取87例PD患者的临床资料,回顾性分析胰管内引流与外引流的效果,现报道如下。
一、资料与方法
1.病例资料:收集2016年1月至2019年1月间南京医科大学附属南京医院普外科87例行PD患者的临床资料。依据术中胰管支撑管的放置方式分为内引流组(39例)和外引流组(48例)。
2.胰肠吻合及胰管引流方法:所有患者胰肠吻合均采用胰管-空肠黏膜对黏膜端侧吻合。于胰腺断面用3-0可吸收线间断缝合胰腺后缘与空肠浆膜层,然后在对应主胰管部位的空肠黏膜层处开一小口,用4-0可吸收线间断缝合胰管后壁与空肠黏膜后壁,主胰管内放置带有侧孔的胰管支撑管,间断缝合胰管前壁和空肠黏膜前壁,胰管前壁缝合时12点钟方向的一针应穿过少许支撑管壁以固定支撑管,防止滑脱,最后间断缝合空肠浆肌层与胰腺被膜。主胰管内插入一根与其直径相近的硅胶管 (头皮针软管或脑室引流管 ),头端设置多个侧孔,置入胰管内3~4 cm,远端置入空肠内约10 cm,为内引流术;距吻合口5~7 cm处的肠壁上戳一小切口,硅胶引流管远端自空肠腔内向盲端移行至小切口处引出,荷包缝合固定导管于空肠壁,最后硅胶引流管自右上腹引出固定,为外引流术。
3.围术期管理:(1)术后3 d内选择完全静脉营养,3 d后视患者通气情况开始鼻饲肠内营养,术后1周逐步过渡至经口进食;(2)调节水电解质平衡;(3)应用抗生素预防感染;(4)应用生长抑素抑制胰酶分泌;(5)应用PPI制剂抑制胃酸分泌;(6)动态复查血清及腹水淀粉酶,术后1周复查腹部CT;(7)外引流患者监测每日胰液引流量和胰液性状;(8)无胰瘘者术后1周逐步拔除腹腔引流管,外引流患者1个月后拔除胰管引流管;(9)术后出现腹腔局限性积液时,在B超或CT引导下行穿刺引流;(10)术后腹腔或消化道出血则选择数字减影血管造影术或内镜下止血,必要时行二次手术。
4.术后胰瘘的评价标准:依据国际胰腺外科研究小组2016 版术后胰瘘定义和分级系统[4],对术后胰瘘进行诊断分级,即临床相关胰瘘(2005版的B级、C级)和生化瘘(2005版的A级)。

二、结果
1.两组患者一般资料比较:两组患者的性别、年龄、术前黄疸、血清白蛋白水平以及组织病理类型等差异均无统计学意义(表1)。
2.两组患者术后胰瘘发生率比较:87例患者中术后出现临床相关胰瘘12例(13.8%),其中内引流组7例(7/39,17.9%),外引流组5例(5/48,10.4%),差异无统计学意义(χ2=1.726,P=0.189)。其中生化瘘发生率(20.5%比22.9%)和B级瘘发生率(7.7%比8.3%)差异均无统计学意义,而内引流组C级胰瘘发生率显著高于外引流组(12.8%比2.1%),差异有统计学意义(χ2=3.0863,P=0.048)。
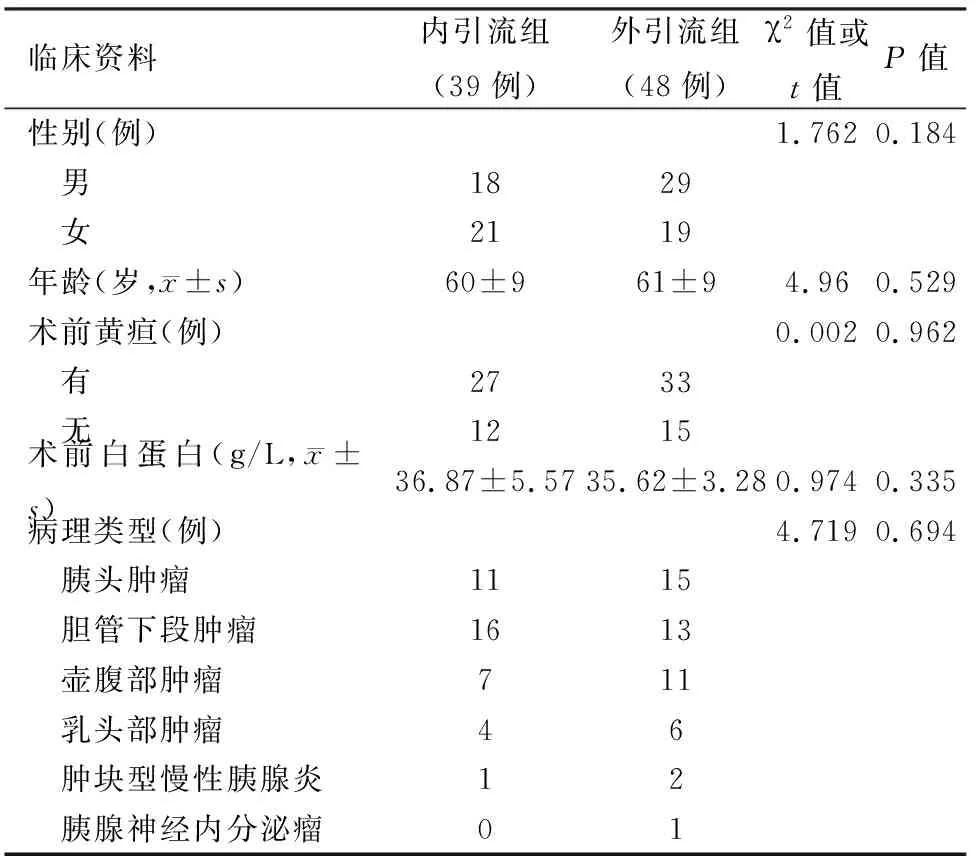
表1 两组患者一般资料比较
3.两组患者其他术后并发症比较:87例患者术后并发症总发生率为29.9%(26/87),其中内引流组的并发症总发生率为30.8%(12/39),外引流组29.2%(14/48),差异无统计学意义。两组的胆瘘(5.1%比4.2%)、腹腔内出血(2.6%比4.1%)、消化道出血(7.7%比2.1%)、腹腔感染(20.5%比18.8%)、排空障碍(2.6%比10.4%)发生率的差异均无统计学意义。
4.两组患者二次手术率、病死率、住院时间比较:内引流组和外引流组间二次手术率(10.3%比2.08%)、病死率(5.1%比2.1%)、住院时间[(18.9±9.5)d比(21.3±10.1)d]的差异均无统计学意义。
讨论自1935年Whipple等首次实施PD以来,该手术已成为治疗胰头部、胆管下段、十二指肠乳头部以及壶腹部周围良恶性病变的标准术式,同时也是最有效的治疗手段。历经80余年的不断总结,目前PD的手术方式及手术技巧都日益规范和成熟,但PD术后并发症发生率,尤其是胰瘘的发生率仍然居高不下。
如何降低胰瘘的外科学争论主要可归为两个方面:一是有效的胰肠吻合技术。目前胰肠吻合大多应用套入式端端胰空肠吻合和胰管对空肠黏膜(即黏膜对黏膜)端侧胰管空肠吻合[5],这两种方法目前也被认为是预防胰瘘最实用的吻合技术。二是合理的置管引流。沈柏用等[6]提及,PD引流管的合理留置和有效引流是防止并发症和降低病死率最后也是至关重要的一个环节。近年来胰管支架管的使用受到了越来越多胰腺外科医师的推崇,Sachs等[7]认为,胰管支撑管可避免胰肠吻合时无意中缝闭胰管,减少医源性胰管堵塞,同时支撑管能将胰腺分泌的胰液直接引流跨过胰腺吻合口,理论上可降低胰肠吻合口瘘的发生,降低胰瘘的风险和严重程度。董家鸿院士研究团队曾通过流体动力学模拟研究论证了PD术中放置胰管引流管是安全、可行的[8]。然而关于PD术中胰管置管引流究竟选择内引流还是外引流,目前尚无统一定论。
多数研究认为胰管内引流和外引流对于预防PD术后近(手术相关并发症)、远期并发症(胰腺萎缩、外分泌功能不全等)的效果相当[9-11],但部分学者提出完全胰液外引流会造成导管滑脱相关并发症的风险增加[12-13],由此认为胰管内引流优于外引流。但这一论点缺乏确切的统计学数据支持。本课题组开展的胰管外引流病例,未出现胰管支架意外滑脱或导管相关性腹腔感染等情况,这可能与笔者在胰管-空肠黏膜吻合时常规于12点钟方向将胰管黏膜和支架管缝合固定有关。还有部分学者考虑胰液完全外引流可造成消化液丢失[14],进而影响胃肠道功能的恢复。本研究分析结果也发现外引流组胃排空障碍发生率高于内引流组,但差异无统计学意义,可能与本研究样本量小有关,因此还有待于扩大样本量进一步验证。
另有一些研究认为胰管外引流优于内引流[15]。Schulick[16]通过荟萃分析发现,胰管支架管外引流相较于内引流可降低胰瘘发生率,减少并发症。Meng等[17]通过对128例内引流和188例外引流病例的回顾性研究,发现PD术中胰管外引流可减轻术后胰瘘的严重程度。本研究结果也提示外引流组C级胰瘘发生率低于内引流组,且差异具有统计学意义。此外,国际胰腺外科研究小组也肯定了这一结论,其在关于PD术后胰腺吻合术的立场声明中提出,在胰瘘风险评分为高风险患者中可考虑胰管支架外引流术[18]。
通过长期PD的实践,笔者对于术中胰管外引流方式的选择有如下体会:(1)胰液完全引出体外可以减轻空肠腔内液体潴留,降低肠管内压力和吻合口张力,从而减少吻合口瘘的机会;(2)胰液不进入肠腔可避免胰蛋白酶被肠液和胆汁激活,降低其腐蚀性,减少腐蚀性吻合口瘘和血管腐蚀性出血的可能性,进而降低严重胰瘘及其并发症的风险;(3)胰液经导管引出至引流袋便于每日监测胰液量和胰液性状,便于及早发现胰瘘,避免严重并发症;(4)限于胰管支架管选材有限,对于一些主胰管过细的患者,支架管可能会造成胰管黏膜损伤,因此此类病例不建议置入支架管,最好选择不置胰管引流的胰腺空肠套入式吻合。
利益冲突所有作者均声明不存在利益冲突

