促胰液素对去卵巢骨质疏松大鼠血清骨转换指标和骨密度的影响
张佳锋 陈文亮 毛一凡 刘钟 梁博程 史晓林*
1.浙江中医药大学,浙江 杭州 310053 2.浙江中医药大学附属第二医院,浙江 杭州 310005
骨质疏松症是一种全身性骨科疾病,其特征是骨量减少,骨微观结构退化,骨质脆性增加,容易发生脆性骨折[1]。人口老龄化的加剧使得骨质疏松发病率居高不下,其中绝经后妇女因雌激素分泌减少等多发因素,致使骨形成与骨吸收之间的动态平衡被打破,呈现高转换特点,其发病率更是高达30%~60%[2]。而目前治疗绝经后骨质疏松症的药物主要以雌激素类为主,虽有较好的临床疗效,但也容易引起较多不良反应,如胃肠道不良反应、乳腺癌和子宫内膜癌风险增高等[3]。因此,寻求一种更为安全且具有成本效益的药物制剂颇有临床意义。
笔者在医学实验与实践中研究总结发现,促胰液素作为骨质疏松症差异表达蛋白,其表达水平与骨量水平正相关,进一步研究发现,对去卵巢骨质疏松大鼠给予促胰液素治疗,取得显著疗效。
1 材料与方法
1.1 实验动物
由浙江中医药大学实验动物中心提供60只6月龄健康未孕雌性SD大鼠,体重200~225 g。
1.2 实验仪器、药物、试剂
促胰液素:由浙江湃肽生物有限公司提供;乙烯雌酚:产自北京四环制药二厂;PINP和CTX Elisa试剂盒:由杭州迪安医学检验中心有限公司提供;双能X线骨密度测量仪:法国Medlink公司生产。
1.3 实验方法
1.3.1动物造模与分组:将60只SD大鼠随机分为假手术组、模型对照组、雌激素治疗组和促胰液素治疗组,每组各15只。采用双侧卵巢去除法制备绝经后骨质疏松大鼠模型[4],给予3%戊巴比妥钠注射液30 mg/kg腹腔注射麻醉,假手术组只切除卵巢周围脂肪而不切除卵巢,其余三组均将输卵管与脂肪结扎后切除双侧卵巢。术后第1天开始注射青霉素G5万IU以达到抗感染目的,共3 d。
1.3.2药物干预:卵巢切除术后7 d开始药物干预,根据黄继汉等[5]的动物剂量转换公式计算剂量。假手术组给予生理盐水1 mL/d灌胃;模型对照组给予生理盐水1 mL/d灌胃;雌激素治疗组给予乙烯雌酚水溶液0.01 mg/(kg·d)灌胃;促胰液素治疗组给予促胰液素水溶液0.01 mg/(kg·d)灌胃。每日1次,持续给药3个月。
1.3.3检测指标:(1)骨转换指标检测。药物干预3个月后,通过右心室血液取样处死每只大鼠,并收集每只大鼠的血液标本送至杭州迪安医学检验中心有限公司使用ELISA 试剂盒进行检测,测定大鼠血清PINP和CTX。(2)骨密度检测。药物干预3个月后,使用双能X线骨密度仪检测大鼠腰椎骨密度。(3)蛋白相关分析:使用STRING10.0蛋白相互作用网络分析工具分析骨质疏松相关差异蛋白。
1.4 统计学方法
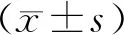
2 结果
2.1 各组大鼠血清PINP、CTX含量
模型对照组、雌激素治疗组、促胰液素治疗组的PINP含量较假手术组升高,差异有统计学意义(P<0.05);雌激素治疗组、促胰液素治疗组较模型对照组PINP含量有所降低,差异具有统计学意义(P<0.05);雌激素组与促胰液素组之间PINP含量差异无统计学意义(P>0.05)。
模型对照组的CTX含量高于假手术组,且差异具有统计学意义(P<0.05);假手术组与雌激素治疗组、促胰液素治疗组之间的CTX含量差异无统计学意义(P>0.05)。雌激素治疗组、促胰液素治疗组较模型对照组CTX含量有所降低,差异具有统计学意义(P<0.05);雌激素组与促胰液素组之间CTX含量差异无统计学意义(P>0.05)。见表1。
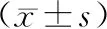
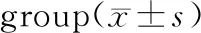
组别例数PINP/(μg/L)CTX/(ng/mL)假手术组1511.66±1.160.409±0.011模型对照组1516.25±1.59*0.640±0.204*雌激素治疗组1514.38±1.06*#0.411±0.128#促胰液素治疗组1514.91±1.73*#0.415±0.125#
注:与假手术组比较,*P<0.05;与模型对照组比较,#P<0.05。
2.2 各组大鼠腰椎骨密度
各组大鼠腰椎BMD比较,差异具有统计学意义。其中模型对照组BMD明显低于假手术组,且差异具有统计学意义(P<0.05);假手术组与雌激素治疗组、促胰液素治疗组之间无显著差异(P>0.05);雌激素治疗组、促胰液素治疗组较模型对照组BMD含量升高,差异具有统计学意义(P<0.05);雌激素组与促胰液素组之间无显著差异(P>0.05)。见表2。
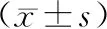
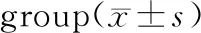

组别例数BMD(g/cm2)假手术组150.170±0.003模型对照组150.103±0.007*雌激素治疗组150.168±0.004#促胰液素治疗组150.167±0.003#
注:与假手术组比较,*P<0.05;与模型对照组比较,#P<0.05。
2.3 蛋白相互作用网络分析
通过STRING10.0蛋白相互作用网络分析工具对23个相关蛋白相互作用网络建立,发现甲状旁腺激素(parathyroid hormone,PTH)与促胰液素(secretin,SCT)直接相关。见图1。

图1 SCT和PTH以及其他相关蛋白之间的相互作用Fig.1 Interaction between SCT and PTH and other related proteins
3 讨论
促胰液素是由Bayliss与Starling等[6]发现的第一种动物激素,属于secretin/PACAP/VIP超家族,其受体都属于G蛋白偶联受体超家族中的B1亚族,是“激素调节”概念的先驱[7],是一种由27个氨基酸残基组成,含11种不同氨基酸,分子量为305.6的碱性多肤。“S”细胞产生促胰液素,十二指肠粘膜是分布的主要部位,只有少量分布在胃窦、空肠和回肠中[8]。柳力公等[9]发现脂肪消化产物油酸钠是刺激十二指肠S细胞介成和释促胰液素的重要物质。促胰液素具有促进胰液分泌,增加胰液总量、能刺激胰腺分泌碳酸氢盐、促进消化等生理作用。肖小芹等[10]报道乌药水提液可通过降低大鼠血清促胰液素水平来改善腹泻型肠易激综合征大鼠腹痛、腹泻症状。金华等[11]研究发现胃肠激素与高血压之间存在密切关系,研究结果表明镇肝熄风汤可通过下调促胰液素表达而降低自发性高血压大鼠血压。
促胰液素是人类小肠上部粘膜分泌的极其少量的调节胰液分泌的蛋白质类的激素。因其治疗胃溃疡、十二指肠溃疡有特效而被人们所注意。促胰液素释放的因素主要是酸,当十二指肠的pH降到3.0以下时,就会使血中的促胰液素增加,当pH升高到4.5以上时,就抑制促胰液素的继续释放[12]。促胰液素能促进胃肠、胰腺、肝胆管的水及电解质分泌,增强缩胆囊素的作用和胰酶的分泌,使胰腺外分泌细胞增生肥大,使细胞内的DNA和蛋白质含量增加,增强营养胰外分泌部的效应,如促进胰液分泌、抑制胃酸分泌等。促胰液素是十二指肠分泌的一种多肽,促进胆管系统和胰腺导管分泌水和碳酸氢盐,并可阻断水、NA+、HCO3-的重吸收,其可与CCK协同增加胰酶分泌,可促进胃酸分泌和胃肠运动[13]。黄祝等[8]研究表明,在小鼠胚胎着床过程中促胰液素在子宫内膜基质细胞中表达量增加,促进p-cPLA2、cPLA2和mPGEs-1的表达,并通过PKA信号通路调节cPLA2/p-cPLA2的水平。Secretin及其受体在中枢神经系统内广泛分布,其中包括海马、下丘脑垂体轴、基底神经节和小脑,越来越多的研究人员认同Secretin在中枢可能发挥着多种调节作用[14]。
近期,大量研究显示消化系统疾病与骨质疏松症关系密切,大部分胃切除、慢性胰腺炎、溃疡性结肠炎等患者均容易出现骨密度低下[15-21]。这可能是消化系统疾病造成患者体内促胰液素分泌减少,继而导致维生素D和钙吸收不良,肠钙吸收较差,蛋白质摄入减少,从而影响骨量。唐天悦等[22]研究发现半胱胺能够解除生长抑素对促胰液素和胆囊收缩素的抑制作用,进而促进胰酶的合成与分泌,改善消化道对钙和总磷等营养物质的表观消化吸收率。
绝经后妇女由于雌激素缺乏引起骨转换的增加,破骨细胞再吸收的速度大于成骨细胞的骨形成速度,最终造成比骨累积更多的重吸收并导致骨的净损失,使得骨重建的正常周期受到损害,骨吸收与骨形成之间的失衡。前期研究发现,促胰液素在低骨量绝经后女性中低表达[23],表明其可能与骨质疏松存在密切联系,但其参与并影响骨代谢的机制不清楚。而在本实验中,模型对照组的PINP、CTX含量明显高于假手术组(P<0.05),而BMD值则明显低于假手术组(P<0.05),说明卵巢切除术后骨吸收、骨形成指标均有增幅,但骨吸收大于骨形成,动态平衡遭到破坏,这与绝经后骨质疏松症高转换特征相一致[24-25],证明本实验骨质疏松大鼠模型造模成功。而促胰液素治疗组与雌激素治疗组的 PINP、CTX含量较模型对照组下降,而BMD值升高(P<0.05),且促胰液素治疗组与雌激素治疗组之间无显著差异(P>0.05),说明促胰液素与雌激素类似,具有减缓绝经后骨代谢高转化趋势,降低骨丢失速度,增加骨密度,具有抗骨质疏松的作用。
另外,本研究使用STRING10.0蛋白质相互作用网络分析工具来构建23种相关蛋白质的相互作用网络[26],发现虽然SCT处于网络边缘,但与PTH直接相关。所以笔者怀疑SCT可能受PTH调节,调节钙代谢,干扰Wnt、BMP/Smads、OPG/RANKL/RANK。它影响骨钙和磷含量,抑制骨质流失,但其具体机制尚需进一步研究。
综上所述,虽然促胰液素与骨质疏松之间的研究尚处于初始阶段,其具体作用机制有待进一步研究揭示,但本研究显示促胰液素具备一定的抗骨质疏松作用,具备成为新型抗骨质疏松药物的潜力,为骨质疏松的防治提供了一种新的思路与方法。

