同种异体骨髓间充质干细胞对急性坏死性胰腺炎大鼠腹腔巨噬细胞极化的影响
王琳 徐萍 王静 田军 谢晓岚
1南京医科大学上海松江临床医学院,上海市松江区中心医院消化内科,上海 200090;2复旦大学附属金山医院消化内科,上海 200540
AP是临床常见急腹症,其发病急,进展快,若不及时治疗则可能发展为SAP,甚至并发全身炎症反应综合征和多器官功能障碍综合征[1-2],最终导致患者死亡。以巨噬细胞为主的多种免疫细胞参与胰腺炎炎症的起始、发展等各个阶段。巨噬细胞在疾病发展的不同阶段因所处微环境的不同而发生表型的变化并表现出不同的功能,这一过程称为巨噬细胞极化。胰腺炎时,单核巨噬系统被激活,大量巨噬细胞发生M1型极化,释放大量促炎细胞因子促进胰腺炎症反应的发生和发展[3]。骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)是一种具有自我更新和多向分化能力的多能干细胞,其免疫调节和组织修复功能在多种疾病中发挥治疗作用[4-5]。体外实验表明,BMSCs的免疫调节作用与巨噬细胞极化有关。本研究通过尾静脉注射BMSCs,观察BMSCs对ANP大鼠炎症反应的影响,探讨其可能的作用机制。
材料与方法
一、实验动物及分组
Sprague Dawley雄性大鼠30只,SPF级,鼠龄2.0~2.5个月,体重220~250 g,购于上海捷思杰实验动物有限公司,动物合格证号为SCKK(沪)2013-0006。按照随机数字表法将大鼠分为对照组,ANP组,低、中、高剂量BMSCs治疗组,每组6只。
制模前15 min经腹腔注射0.8%戊巴比妥钠进行麻醉,采用胰胆管逆行注入5%牛黄胆酸钠1 ml/kg的方法制备ANP模型。低、中、高剂量BMSCs治疗组在制模后1 h内经大鼠尾静脉分别注射0.5×106、1×106、3×106个BMSCs,BMSCs购于中国科学院细胞库。对照组仅经尾静脉注射等容积PBS。ANP组在制膜后1 h内经尾静脉注射等容积PBS。制模后12 h,先抽取腹水,计量,然后以20 ml预冷PBS行腹腔灌洗,收集灌洗液,并重复灌洗收集1次;抽取大鼠外周静脉血;分离胰腺组织。
二、方法
1.血清生物化学指标检测:外周静脉血离心,收集上层血清,-80℃保存。采用胰淀粉酶检测试纸(干化学法)检测血清淀粉酶水平。采用ELISA法分别检测血清TNF-α、IL-1β、髓过氧化物酶(myeloperoxidase,MPO)水平。TNF-α、IL-1β试剂盒购自美国BioScience公司,MPO试剂盒购自武汉华美生物工程有限公司,按试剂盒说明书操作。
2.胰腺组织病理学检查及诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)、精氨酸酶1(anginase1,Arg1)蛋白检测:胰腺组织经4%多聚甲醛液固定,石蜡包埋,切片,苏木精-伊红染色。采用免疫组织化学染色检测胰腺iNOS、Arg1蛋白的表达。iNOS抗体、Arg1抗体购自武汉博士德生物工程有限公司。由病理科医师盲法阅片,每张切片随机选择8~10个高倍视野,采用Schmidt法从水肿、腺泡和脂肪坏死、出血、炎症细胞浸润4个方面进行病理评分[6]。以细胞质内出现棕黄色微细颗粒为阳性巨噬细胞。
3.腹腔巨噬细胞收集及TNF-α、iNOS mRNA表达检测:收集并记录2次灌洗的腹腔灌洗液,以密度离心法4℃、2 000 g离心15 min,弃上清。离心后若有大量红细胞,则加入于红细胞2~3倍容积的红细胞裂解液(上海碧云天生物有限公司)吹打,静置2 min后再次离心弃上清,以DMEM完全培养液(10%胎牛血清、青霉素、链霉素)重悬细胞,均匀接种于12孔板或10 cm培养皿中,常规培养4 h。待巨噬细胞贴壁后换液,继续培养24 h后胰酶消化,收集巨噬细胞。应用Trizol抽提巨噬细胞总RNA,紫外分光光度仪测定RNA纯度及浓度。按照反转录试剂盒步骤将RNA逆转录为cDNA,采用荧光定量PCR法检测腹腔巨噬细胞TNF-α、iNOS mRNA表达量。Trizol、反转录试剂盒、实时定量PCR试剂盒均购自日本TaKaRa公司。TNF-α正向引物序列5′-GCATGATCCGAGATGTGGAACTGG-3′,反向引物序列5′-CGCCACGAGCAGGAATGAGAAG-3′;iNOS正向引物序列5′-GAGACGCACAGGCAGAGGTTG-3′,反向引物序列5′-CAGGAAGGCAGCAGGCACAC-3′;以磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase, GAPDH)作为内参。所用引物由上海生工生物工程技术服务有限公司设计并合成。PCR反应条件:95℃ 10 min,95℃ 15 s,60℃ 45 s,40个循环。由PCR仪自带软件获取Ct值,△Ct值=Ct目的基因-CtGAPDH,△△Ct值=△Ct实验组-△Ct对照组,以公式2-△△Ct计算mRNA相对表达量。
4.腹腔M1(F4/80+CCR2+)型、M2(F4/80+CD163+)型巨噬细胞亚群表型检测:收集上述10 cm培养皿中巨噬细胞,离心,PBS重悬后再次离心,按照F4/80-FITC、CCR2-PE、CD163-APC抗体说明书加入适量抗体(均购自北京博奥森生物工程有限公司),室温避光孵育30 min,洗涤后重悬细胞,上流式细胞仪检测巨噬细胞表面标志物。
三、统计学处理
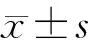
结 果
一、各组大鼠腹水量、血淀粉酶水平和胰腺组织病理变化
制模后12 h,ANP组大鼠腹水量、血淀粉酶水平均显著高于对照组,各治疗组大鼠腹水量均显著低于ANP组,差异均有统计学意义(P值均<0.05)。各治疗组大鼠血淀粉酶水平与ANP组差异无统计学意义,各治疗组之间腹水量和血淀粉酶水平差异也无统计学意义(表1)。
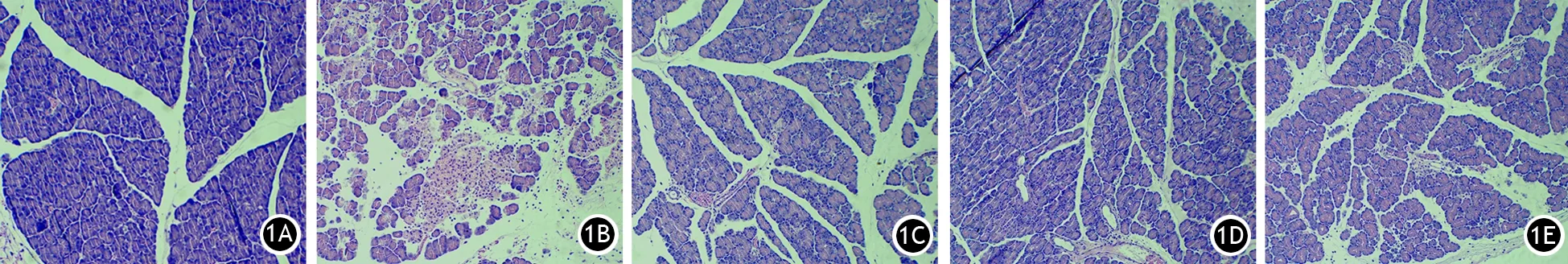
对照组大鼠胰腺组织结构清晰,腺泡细胞排列整齐,腺泡小叶结构完整。ANP组大鼠胰腺组织可见明显腺泡细胞变性、坏死,小叶结构大部分破坏,小叶间隔增大,间隙水肿,红细胞和炎细胞大量浸润,病理评分显著高于对照组。各治疗组大鼠胰腺组织损伤明显减轻,表现为小叶结构破坏减轻,变性、坏死减轻,炎细胞及红细胞浸润减少(图1),病理评分均显著低于ANP组,差异均有统计学意义。各治疗组间胰腺病理评分的差异有统计学意义,其中中剂量治疗组胰腺病理评分显著低于低、高剂量治疗组(表1)。
免疫组织化学染色见ANP组大鼠胰腺组织内有较多iNOS、Arg1阳性巨噬细胞,对照组及各治疗组无阳性细胞或有少量阳性巨噬细胞(图2)。
二、各组大鼠外周血TNF-α、IL-1β、MPO水平
制模后12 h,ANP组大鼠外周血TNF-α、IL-1β、MPO水平均显著高于对照组,各治疗组血TNF-α、IL-1β、MPO水平均显著低于ANP组,差异均有统计学意义(P值均<0.05)。各治疗组间血TNF-α、IL-1β、MPO水平差异有统计学意义,其中中剂量治疗组血TNF-α、IL-1β、MPO水平显著低于低、高剂量治疗组,差异均有统计学意义(P值均<0.05,表2)。
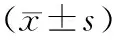

组别 只数腹水量(ml)血淀粉酶(U/L)胰腺病理评分对照组 60.83±0.52865.00±167.190ANP组 66.67±2.34a12820.00±4973.10a14.00±1.55a低剂量治疗组64.17±0.98ab9886.67±2466.53a 6.50±1.04abc中剂量治疗组64.17±1.17ab12643.33±5981.88a4.67±0.82ab高剂量治疗组64.33±1.21ab11133.33±2815.18a 8.83±0.75abc
注:ANP为急性坏死性胰腺炎。与对照组比较,aP<0.01;与ANP组比较,bP<0.01;与中剂量治疗组比较,cP<0.05
注:ANP为急性坏死性胰腺炎
图1对照组(1A)、ANP组(1B)、高剂量治疗组(1C)、中剂量治疗组(1D)、低剂量治疗组(1E)胰腺病理改变(苏木精-伊红染色 ×400)
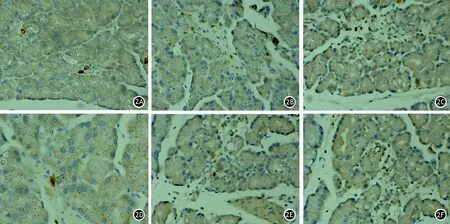
图2 对照组、ANP组、中剂量治疗组大鼠胰腺组织iNOS阳性(2A、2B、2C)及Arg1阳性巨噬细胞(2D、2E、2F)(免疫组织化学染色 ×400)

表2 5组大鼠血TNF-α、IL-1β和MPO水平
注:TNF-α为肿瘤坏死因子α;IL-1β为白介素1β;MPO为髓过氧化物酶;ANP为急性坏死性胰腺炎。与对照组比较,aP<0.01;与ANP组比较,bP<0.01;与中剂量治疗组比较,cP<0.05
三、各组大鼠腹腔巨噬细胞TNF-α、iNOS mRNA表达
制模后12 h,对照组、ANP组、中剂量治疗组大鼠腹腔巨噬细胞TNF-α mRNA表达量分别为1、6.53±3.45、2.16±0.98;iNOS mRNA表达量分别为1、7.37±2.98、2.32±1.88,ANP组显著高于对照组,中剂量治疗组显著低于ANP组,差异均有统计学意义(P值均<0.01)。
四、各组大鼠腹腔M1型、M2型巨噬细胞亚群比值比较
对照组、ANP组、中剂量治疗组大鼠F4/80+CCR2+M1型巨噬细胞与F4/80+CD163+M2型巨噬细胞比值分别为1.12±0.03、2.02±0.31、1.53±0.10,ANP组显著高于对照组,中剂量治疗组显著低于ANP组,差异均有统计学意义(P值均<0.05,图3)。
讨 论
巨噬细胞作为重要的先天和后天免疫细胞,其不同表型之间相互协调与稳定是机体维持稳态的必要条件,任何亚型的失衡都可能导致疾病的发生与发展[7]。巨噬细胞根据所处微环境的不同可极化为促炎M1型和免疫调节的抑炎M2型。腹腔巨噬细胞的激活是SAP发生的早期事件,本课题组前期研究结果表明,腹腔巨噬细胞活化参与胰腺炎症反应的发生和发展[8],因此,通过早期调节巨噬细胞的极化表型,可有效避免M1型巨噬细胞的过度激活,从而减轻胰腺炎症状。
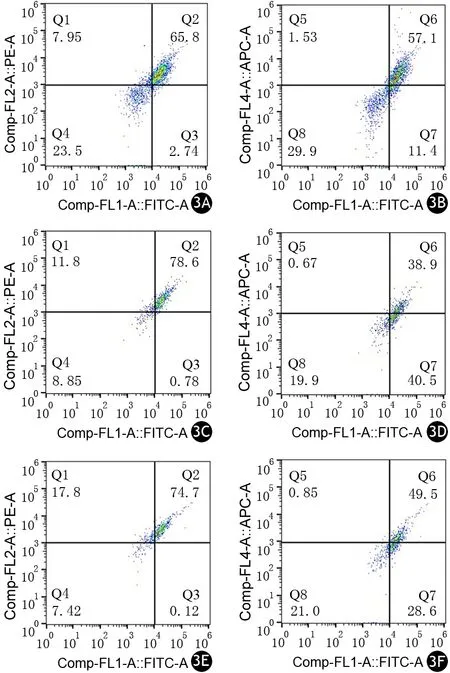
注:ANP为急性坏死性胰腺炎图3 对照组(3A、3B)、ANP组(3C、3D)、中剂量治疗组(3E、3F)大鼠腹腔M1型和M2型巨噬细胞流式细胞分析图
BMSCs是一种具有组织修复能力的多能干细胞,除在神经学、骨学等学科发挥组织修复功能外[9-10],还可迁移至炎症部位,并通过改变免疫系统来调节炎症反应,在寄生虫感染、败血症等疾病中发挥免疫调节作用[11-13]。研究表明干细胞可通过调节巨噬细胞的极化表型影响疾病的炎症反应过程[14-15]。体外BMSCs与巨噬细胞共培养结果显示,BMSCs可诱导巨噬细胞M1型向M2型分化,发挥免疫抑制作用[16]。Zhang等[17]证明人牙龈间充质干细胞可诱导巨噬细胞M2型极化,促进伤口愈合。
本研究结果显示,制模后12 h,ANP组大鼠胰腺组织明显坏死,小叶结构明显破坏,细胞间隙水肿,红细胞和炎症细胞大量浸润。经BMSCs治疗后,大鼠胰腺组织损伤明显减轻,炎症细胞浸润减少;TNF-α、IL-1β、MPO血清水平及腹腔巨噬细胞TNF-α、iNOS mRNA表达显著下调,表明BMSCs通过抑制炎症因子表达,减轻ANP大鼠胰腺组织损伤,发挥一定的治疗作用。本研究结果还显示,ANP组大鼠M1型与M2型巨噬细胞比值显著高于对照组,BMSCs治疗组显著低于ANP组,表明ANP发生后,巨噬细胞以M1型为主,BMSCs治疗后M1型细胞显著减少,提示BMSCs可能通过抑制ANP大鼠腹腔巨噬细胞向M1型极化来减轻胰腺组织损伤及全身炎症反应。BMSCs是促使ANP大鼠腹腔巨噬细胞M2型极化还是促进M1型转化为M2型,尚需要加大样本量和延长治疗时间进一步验证。
然而不同剂量BMSCs发挥的作用并不相同。本研究应用3种剂量(0.5×106、1×106、2×106个细胞)治疗ANP大鼠,结果显示,中剂量治疗组的治疗效果最佳,推测可能与高剂量细胞引起微循环细胞团块栓塞有关[18]。因此,寻找最佳干细胞注射剂量可能是发挥干细胞最大治疗作用的关键。
利益冲突所有作者均声明不存在利益冲突

