基于荧光光谱探讨“附子性毒,得甘草后解”的机制*
河北医科大学药学院
史梦召 马小宁△ 杨宏超 窦玉红△△ 黄 芸 崔力剑△△ (石家庄 050017)
提要 目的:采用荧光光谱研究甘草有效成分对乌头碱与人血清白蛋白(HSA)相互作用的影响,对“附子性毒,得甘草后解”做出合理解释。方法:在模拟人体血液离子强度和酸碱度条件下,通过荧光光谱等技术,获得乌头碱与HSA相互作用的物理常数,并进一步确定甘草中5种成分对这些物理参数的影响。结果:乌头碱与HSA按照1∶1的比例关系自发形成结合态药物“超分子”。在生理条件下,甘草中5种成分可降低乌头碱与HSA的结合程度。结论:甘草通过减少血液中“结合态”乌头碱浓度,加速乌头碱代谢排出体外,缩短中毒症状持续时间发挥解毒作用。
附子来源于毛茛科植物乌头(AconitumcarmichaeliiDebx.)的子根,始载《神农本草经》[1],性毒列为下品,现为临床常用温里药之一。因具“斩关夺门之气”,取其回阳救逆、补火助阳之功效,尤用于亡阳欲脱等危急病证,为“续命起死之要药”。[2]在临床应用过程中,也表现出较强的毒性,李时珍曰:“乌附毒药,非危重病不用,用之不当,致祸甚速。”现代药理学研究也发现,乌头碱口服 0.2 mg 即可中毒,摄入3~5 mg 可致死。[3]众所周知,在我国传统用药过程中总结出炮制、配伍等多种方法对附子减毒增效,其中《景岳全书·本草正》有“附子之性毒,得甘草而后解”记载。中医典籍《伤寒论》和《金匮要略》中也有19首方剂采用了附子甘草配伍,附子甘草配伍现已成为温阳补中常用药对。周子渝[4]、李文[5]、张序晴[6]等从多角度、多手段对甘草解附子之毒的机理进行了实验研究,但截至目前,未见采用荧光光谱法研究的报道。为此,笔者拟以荧光光谱法为手段,以中药有效成分化学相互影响为切入点,对“附子之性毒,得甘草而后解”进行了相关研究。
1 材料与仪器
甘草酸二钾(批号:100551-201802)、甘草次酸(批号:110723-201715)、甘草苷(批号:111610-201607)购自中国食品药品检定研究院;乌头碱(批号:0150-0025,≥98.0%)、甘草素(批号:1073-0025,≥99%)、异甘草苷(批号:0234-0025,≥98.0%)购自成都普思生物科技股份有限公司;人血清白蛋白(HSA)、Tris购自Sigma公司;其它试剂均为分析纯;实验用水为超纯水。
LS50B荧光光谱仪(美国PE公司);TU-1901双光束紫外可见分光光度计(北京普析通用);PHS-3C数字酸度计(杭州东星仪器设备厂);CU600电热恒温水浴箱(上海一恒公司);ME204E分析天平(德国 Sartorims公司);Milli超纯水机(美国Thermo公司)。
2 方法与结果
2.1 乌头碱与HSA作用的荧光光谱
移取3.0 mL 1.0×10-6mol/L HSA溶液(用pH=7.4,0.1 mol/L的Tris-HCl缓冲溶液配制,且内含0.1 mol/L的NaCl维持溶液离子强度)于石英比色皿中,测定其发射光谱,然后用微量进样器逐次加入乌头碱溶液,混匀后用恒温水箱控温298 K、310 K充分反应后,分别测定其发射光谱,激发波长为280 nm,绘制HSA的荧光光谱(见图1)。
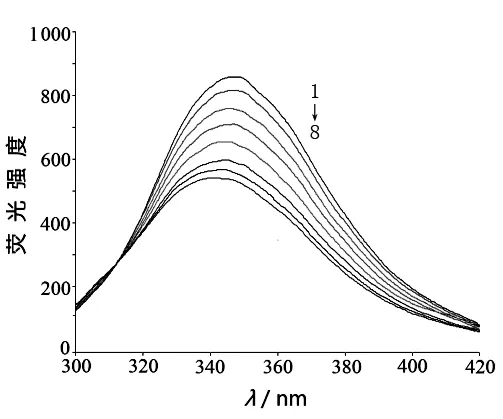
注:C乌头碱1→8:0、0.33、0.67、1.00、1.33、1.67、2.00、2.33×10-5mol/L。
图1 乌头碱与HSA作用的荧光光谱(310 K)
如图1所示,固定HSA的浓度,随着体系中乌头碱浓度增加,HSA的内源荧光有规律地产生猝灭,且乌头碱使HSA的荧光发射峰产生一定程度的蓝移,且蓝移程度随温度的升高而增大,证明加入乌头碱后HSA分子构象发生一定程度的变构,导致发射荧光的色氨酸残基微环境的疏水性增强,[7]这说明乌头碱可以和HSA发生了相互作用,形成“超分子”物质。

2.2 乌头碱与HSA作用的同步荧光光谱
溶液配制方法同2.1,控制温度在310 K,固定激发和发射波长间隔Δλ为60 nm,绘制250~320 nm范围内的光谱曲线。实验结果表明,随着乌头碱浓度增加,HSA的荧光强度逐渐降低。乌头碱引起了色氨酸残基发射峰较为明显的蓝移,这也表明乌头碱与HSA发生了相互作用,HSA分子构象变得更加紧密,分子中的“沟”收缩,“沟”中的色氨酸残基所处环境的极性减弱。[8]见图2。
2.3 作用力类型及结合距离
使用热力学方程,[8]对荧光光谱所得数据进行处理,则乌头碱与HSA结合过程的热力学参数为:ΔH=46.58kJ/mol,ΔS298K=235.70J/mol·K-1,ΔS310K=235.71J/mol·K-1,ΔG310K=-23.66kJ/mol,ΔG310K=-26.49kJ/mol,证明二者间的作用力主要为疏水作用力,且结合作用属于自发进行过程。采用Föster's方程,[7]结合紫外光谱对所获荧光数据进行处理,计算得出乌头碱与HSA之间的结合距离分别为r乌头碱=5.089 nm,说明二者作用形成了“超分子”物质。
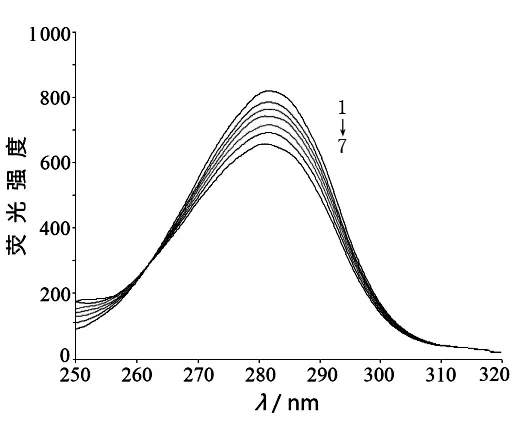
注:C乌头碱1→7:0、0.33、0.67、1.00、1.33、1.67、2.00×10-5mol/L。
图2 乌头碱与HSA作用的同步荧光光谱(310 K)
2.4结合常数和结合位点数
采用修正的Scatchard方程:lg[(F0-F)/F]=lgKa+ nlg[Q]对所得荧光光谱数据进行处理,即得出289 K和310 K温度下的结合位点数n和结合常数Ka。结果为289 K时Ka=5.110 ×103L/mol,n= 0.903 2,310 K时Ka=6.871×105L/mol,n=1.300 8。由结果可以看出,乌头碱与HSA的结合位点数均接近于1,说明在实验浓度范围内都是近似以1∶1结合。当温度升高时,Ka随之升高,说明温度升高增加了分子间有效碰撞的数目,加剧了电子转移,增强了乌头碱分子与HSA之间的相互作用,这与动态猝灭机制相符合。[8]
2.5 甘草中5种成分对乌头碱与HSA结合的影响
研究甘草中5种有效成分加入后,乌头碱与HSA结合常数及结合位点数的变化。在HSA加入乌头碱之前,在HSA溶液中加入一定浓度(1.00×10-5mol/L)的甘草有效成分, 摇匀静置,待反应平衡后,加入一定量的乌头碱溶液,测定HSA体系的荧光强度。采用修正的Scatchard方程[8]计算乌头碱与HSA的结合常数Ka和结合位点数n(详见表1)。由结果可以看出,甘草中有效成分可使乌头碱与HSA结合常数降低约99%~86%,结合位点数降低约37%~11%,血液中游离乌头碱浓度增加,结合型乌头碱的量大大降低。

表1 甘草中活性成分对乌头碱与HSA结合的影响(310 K)
3 讨论
自西汉以来,附子之毒性记载于多部医典中,《名医别录》、《开宝本草》、《汤液本草》、《本草崇原》等医书中均记载附子“有大毒”,使用不当可导致“痈毒顿生,烂五脏”之弊病。同时《本草新编》等典籍进一步指出“附子之妙,正取其毒也”“以毒制毒,而毒不留”,可见中药附子中的毒性成分也是其有效成分。历代通过多种方法对附子减毒增效,其中采用甘草解附子之毒是较广泛的观点之一,也有多首方剂具体应用。
本研究中,笔者以活性成分的相互作用为基础,采用荧光分析法,通过体外药理实验对“附子之性毒,得甘草而后解”做出合理解释。乌头碱在血液中通过疏水力与血浆白蛋白结合,形成“超分子”(即结合态药物)将部分乌头碱暂时储存在血液中。当附子、甘草同服后,甘草有效成分亦被吸收进入血液,在正常体温(37℃)条件下,甘草中5种(甘草素、甘草酸、甘草次酸、甘草苷、异甘草苷)有效成分通过影响HSA构象,大大降低乌头碱与HSA结合程度,使血浆游离型乌头碱浓度增加,游离型乌头碱在血液中半衰期较短,[9]这样可以加快乌头碱代谢排出体外,从而缩短中毒症状持续时间。同时,甘草苷通过降低心肌细胞内钙浓度保护乌头碱所导致的心肌损伤[10],甘草酸、甘草次酸等皂苷类成分发挥抗休克等肾上腺皮质激素样作用[11],均可提升肌体对乌头碱毒性的耐受性。这充分说明祖国传统医学中采用甘草解附子之毒的科学性、合理性,为今后附子与甘草临床配伍应用提供了一定的理论依据。

