HPLC法同时测定白喉乌头中双酯型二萜生物碱含量
阿不力米提·玉麦尔,阿卜杜拉·玉苏普,库尔班江·巴拉提
1. 喀什大学化学与环境科学学院(喀什 844007);2. 伊犁师范大学化学与环境科学学院(伊宁 835000)
乌头类生物碱是一类化学结构复杂和生物活性较强的中药成分,绝大部分存在于乌头属(Aconitum)和翠雀属(Delphinium)植物中,是乌头类有毒中药类的主要化学成分[1]。乌头类生物碱被认为是乌头属中药材的特征生物活性成分,但大多数乌头属药材都含有大量的有毒双酯型乌头碱,治疗量与中毒量非常接近,极易发生中毒事件[2]。
乌头属植物在中国有170余种,资源十分丰富[3]。乌头类有毒中药能祛风除湿,温经止痛,常用于风湿麻痹[4]。关节疼痛,心腹冷痛,寒疝作痛,麻醉止痛等。从古至今被广泛应用于临床,如《伤寒论》载方113个。其中,附子者20个,占总载方量的18%[5]。《中国药典(2005版)》收载的乌头属中药有川乌、草乌、制川乌、制草乌、草乌叶、附子,其中附子炮制品包括盐附子、黑顺片、白附片、淡附片、炮附片等[6]。
在新疆天山北坡广泛分布一种多年生草本植物交乌头草,其主要有效化学成分是乌头碱。因乌头草外形,色泽与当年生草本植物野芹菜极为相似,随着回归大自然盒绿色天然植物的食用,乌头草中毒日益增多[7]。
通过紫外光谱、红外光谱、核磁共振、串联质谱等方法对从乌头类有毒中药中分离的乌头生物碱进行结构鉴定,已发现的生物碱有400多种[8]。如:乌头中的剧毒成分乌头碱、中乌头碱、次乌头碱等;白花瓜叶乌头中的大渡乌头碱、13,15-双去氧乌头碱、吲哚乌头碱、景阳碱、塔拉萨敏、查斯曼宁等几种去甲二萜生物碱;甘青乌头中异叶碱、阿替素、苯甲酰赫拉替辛坦乌辛、塔拉萨敏等;吉林乌头中C19二萜生物巨针碱、β-谷甾醇、槲皮素、芦丁等其他类成分[9];瓜叶乌头根中分得氨茴酰牛扁碱、牛扁碱、8-酰滇乌碱、伪乌头宁、尼奥宁、6-表弗斯生、滇乌碱、印乌碱、查斯曼宁等12个C19二萜生物碱;工布乌头的块根中黄草乌碱丁、黄草乌碱丙等9个C19二萜生物碱直缘乌头根中分得黄草乌碱甲、草乌甲素、膝乌碱、14-乙酰塔拉萨敏、茶花碱等11个二萜生物碱,其中黄草乌碱甲和茶花碱是首次从该植物中分离得到[10];多根乌头中分得12-表-欧乌碱、乌头碱、脱氧乌头碱、新乌碱和准葛尔乌头碱;丽江乌头中分得丽乌碱等,东川乌头中分旬滇羟碱。
有研究初步证实二萜双脂型乌头类生物碱的水解途径。二萜双酯型乌头类生物碱可先水解,失去乙酰基生成单脂型二萜生物碱(如苯甲酰乌头碱),继续水解失去苯甲酰基生成乌头原碱[11]。
乌头类生物碱的检测方法有酸碱滴定法、分光光度法、高效液相色谱法、毛细管电泳法、高效液相色谱法-质谱法等。试验用高效液相色谱法测定附子和白喉乌头中的乌头碱、新乌头碱、次乌头碱的含量。高效液相色谱法因其柱效高、分离好、稳定方便,能同时测定乌头碱、新乌头碱、次乌头碱,故应用最多。UV检测器因其灵敏度高、稳定性好,线性范围宽等优点而广泛应用,适用于生药、饮片、药酒中乌头碱的检测。水-甲醇-二乙胺(75∶25∶0.1,V/V)被用于乌头类生物碱的组织分布[12]。
1 材料与方法
1.1 材料、试剂与仪器
1.1.1 试验材料
白喉乌头(2020年8月16日采自特克斯县科克特勒克乡)。
1.1.2 试验试剂
新乌头碱对照品(批号B10050,规格20 mg,上海士锋生物科技有限公司);乌头碱对照品(批号B10051,规格20 mg,上海士锋生物科技有限公司);次乌头碱对照品(批号B10049,规格20 mg,上海士锋生物科技有限公司);无水已醇(分析纯,成都市料龙化工试剂厂)。
1.1.3 仪器与设备
FA2104型电子天平(上海舜宇恒平科学仪器有限公司);星火牌C型玻璃仪器气流烘干器(长城料工贸有限公祠);SHZ-Ⅲ型循环水真空泵(上海亚荣生化仪器厂);SY-2000型旋转蒸发器(上海亚荣生化仪器厂);KQ-250DB型数控超声波清洗器(昆山市超声仪器有限公司);高效液相色谱仪(LC-2010,日本)。
1.2 方法
1.2.1 色谱条件
采用Agilent C18柱(4.6 mm×150 mm,5μm);流动相∶甲醇-水(20∶80);流速0.8 mL/min;检测波长235 nm;柱温30 ℃;进样量10 μL。结果表明新乌头碱、乌头碱、次乌头碱分离度良好,且样品中的其他成分不干扰测定。
1.2.2 对照品及供试品溶液的制备
1.2.2.1 供试品溶液的制备
取白喉乌头,置于研钵中粉碎后,称取5 g,置于50 mL锥形瓶中,加入0.5 mL氨试液,精密加入无水乙醇25 mL,超声波提取45 min,放冷,称定质量。用无水乙醇补足减失的质量,摇均,过滤,滤液分别加入50 mL容量瓶中,加无水乙醇溶液溶解,并稀释至度,摇均,即得。
1.2.2.2 对标准溶液的制备
准确称取5 mg新乌头碱、1.75 mg乌头碱和2.5 mg次乌头碱,分别置于10 mL容量瓶中,加无水乙醇溶液溶解并稀释刻度,摇均,即得。
1.2.2.3 流动相的选择
由于3种待测的乌头类生物碱是碱性,且3种乌头类生物碱的pH为7~10,所以流动相的pH会影响3种乌头类生物碱的出峰时间。当流动相使用甲醇-水(20∶80,V/V)流动时,各种待测物质的出峰顺序发生改变,但是各种物质间都达到很好的分离。所以试验选择甲醇-水作为流动相。
1.2.2.4 相应波长的选择
将一定浓度的3种乌头类生物碱的标准溶液分别在200~250 nm范围内进行扫描,根据高效液相色谱235 nm作为3种乌头类生物碱的检测波长。
1.2.2.5 提取方法
分别取约5 g 2种样品细粉,精密称定,分别置于50 mL锥形瓶中,加入氨水0.5 mL,加入25 mL无水乙醇,称其质量,混匀,超声(功率100 kW)45 min,过滤,滤液分别加入50 mL容量瓶中,加无水乙醇溶液溶解并并稀至刻度,摇均,即得。
1.2.2.6 线性关系考察
精密吸取2,4,6,8和10 μL标准溶液,分别注入液相色谱仪,以峰面积为纵坐标进样量(μL)为横坐标,绘制标准曲线。
1.2.3 方法学考察
1.2.3.1 精密度试验
取新乌头碱、乌头碱、次乌头碱质量浓度分别为5,1.75和2.5 μg/mL的对照品贮备液(将1.2.2.1的溶液稀释100倍)10 μL进样,连续5次,测定3种生物碱的峰面积积分比值,计算精密度(SRSD)。结果显示,新乌头碱、乌头碱、次乌头碱SRSD分别为0.33%,0.36%和0.42%,表明精密度良好。

图1 准溶液色HTPLC图

图2 样品HTPLC图

表1 精密度试验
1.2.3.2 稳定性试验
取1.2.2.2的供试品溶液,分别于0,4,8,16和24 h进样测定。结果显示,新乌头碱、乌头碱、次乌头碱SRSD分别为1.1%,1.6%和1.8%,表明溶液在24 h内基本稳定。

表2 稳定性试验
1.2.3.3 重复性试验

表3 重复性试验
取同一批附子和白喉乌头药材3份,按1.2.2.1的方法制备成供试品溶液,并按1.2.1的色谱条件进样测定,结果显示,样品中新乌头碱、乌头碱、次乌头碱平均含量的SRSD分别为0.97%,1.3%和1.5%。
1.2.3.4 加标回收率试验
称取已测知含量的样品5分,每份0.19 g,分别精密加入1.00 mL新乌头碱对照品溶液(质量浓度29.0 μg/mL)、1.00 mL乌头碱对照品溶液(质量浓度20.75 μg/mL)和1.00 mL次乌头碱对照品溶液(质量浓度0.200 μg/mL),按1.2.2.2的方法制备供试品液,测定含量并按式(1)计算回收率。
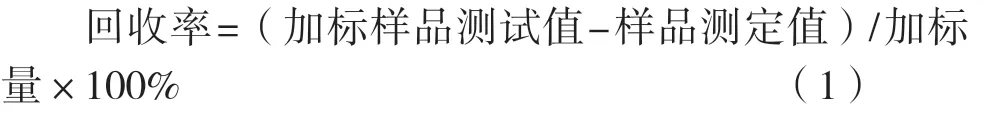
2 结果与分析
2.1 标注曲线的绘制

图4 乌头碱标准曲线
以峰面积值为纵坐标,新乌头碱、乌头碱、次乌头碱对照品的质量浓度C(μm/mL)为横坐标,绘制标准工作曲线,如图3~图5所示。新乌头碱、乌头碱、次乌头碱的曲线方程分别为y=6 075x-131.8(r=0.99921),y=70 664x-1455.3,r=0.99918,y=857821x-7 967.6,r=0.99916。新乌头碱、乌头碱和次乌头碱分别在1~5,0.35~1.75和0.5~2.5 μg范围内呈良好线性关系。

图3 新乌头碱标准曲线

图5 次乌头碱标准曲线
2.2 加标回收率试验
回收率试验结果见表4。

表4 加标回收率试验(n=5)
2.3 样品测定
按1.2.2.1的方法制备供试品溶液,按1.2.1的色谱条件进样测定,根据3个成分的线性回归方程,对附子和白喉乌头提取液中的成分含量进行计算,如式(2)所示。


表5 样品含量测定结果
3 结论
在试验条件下,对照品及试样中各组分均能达到基线分离,且峰形良好。用无水乙醇作提取剂,超声提取45 min,提取效率最高。建立的高翔液相色谱法同时测定附子和白喉乌头中新乌头碱、乌头碱、次乌头碱含量的方法,经方法学考察,全部达到检测要求。通过测定不同批号的该草乌,发现其质量具有一定差异性。

