酶法提取木槿花多糖工艺
刘涵,李咪,孙盼盼,王静,曹际云
德州学院生命科学学院(德州 253023)
木槿(Hibiscus SyriacusL.)属锦葵科木槿属落叶灌木,又名木锦、篱障花。木槿花的食用历史悠久,在我国广东、福建等地多作为蔬菜原料烹饪成菜肴。在福建省汀州市,人们用木槿花和葱切碎,与面粉混合后制成稀面,在煎锅中油炸后面饼香脆可口,被称为“面花”和“花炸”。木槿花的营养价值极高,不仅有蛋白质、脂肪、氨基酸、多糖等成分,还有人体所需的微量元素,如钙、镁、铁、锌、钾等[1]。木槿花的功效在一些药物学著作中有所记载,如具有清热、利湿、凉血等[2]功能,能够帮助预防治疗高血压和心血管疾病,还可以调节人体免疫功能,有抗炎、抗癌症、抗糖尿病、抗氧化、抗高血压等[2]作用。
多糖(polysaccharide)在自然界中分布广泛,是维持生命活动的基本物质之一[3]。试验已证明多糖具有抗肿瘤、抗氧化剂、抗病毒、降血糖和免疫调节等[4]作用,对人体副作用小。有研究开发一些多糖类的功能性食品以促进身体健康,是食品行业最具前景的领域之一。
国内外对木槿花提取物的研究主要集中在原花青素、总黄酮和多酚类物质上。吕惠卿等[5]通过响应面法建立回归方程模型,改进木槿花中总黄酮的最佳提取工艺。张雪娇等[6]利用响应面法改进木槿花多酚提取工艺条件。黄采姣等[7]研究5种类型的木槿花,通过试验证明木槿花的总酚和总黄酮含量会影响木槿花的抗氧化性。张婕等[8]通过正交试验研究木槿花的原花青素提取工艺,优化木槿花花青素的最佳提取工艺。对木槿花多糖的提取工艺研究很少,只有利用超声波来提取木槿花多糖,而利用酶法提取木槿花多糖还鲜见诸报道。
提取植物多糖的工艺有微波提取[9]、超声波提取[10]、热水浸提[11]、碱浸提[12]和酶提取[13]等。通过查阅参考文献后发现超声波和微波对多糖的组成和活性有较大影响、碱浸提有严格的工艺要求,如果超出工艺要求的pH范围,则可能会导致糖苷键在多糖中断裂。因此,试验采用酶法提取木槿花多糖。
1 材料与方法
1.1 试验材料与仪器
石油醚(沸程30~60 ℃);无水乙醇、氯仿-正丁醇(V∶V=4∶1)、苯酚(均为分析纯);纤维素酶(酶活3 U/mg);浓硫酸;葡萄糖;白色重瓣木槿花(江苏省宿迁市沐阳县长景园林)。
普通的索氏提取器(冷凝管、抽提管、平底烧瓶);滤纸筒;HHS21-8-8水浴锅;PL203电子天平;TDZ5-WS低速架自动平衡离心机;UV-5500紫外可见分光光度计;旋转蒸发仪;恒温振荡箱;等。
1.2 多糖得率的计算
试验采用苯酚-硫酸法测定多糖含量,这种方法具有快速方便、显示灵敏的优点。多糖得率按式(1)计算。

式中:C为多糖质量浓度,mg/mL;V为多糖溶液稀释后总体积,mL;M为样品质量,g。
1.3 单因素试验
称取一定质量的木槿花粉末,加入石油醚,在66 ℃回流提取2 h脱脂,抽滤,在55 ℃烘箱中烘干,在80%乙醇中浸泡12 h除去一些物质,晒干后备用,得到预处理后的木槿花粉末。称取1 g预处理后的木槿花粉末于锥形瓶中,在一定酶量、反应时间、料液比、温度下反应,在100 ℃下灭酶15 min。冷却后进行真空抽滤,收集滤液,用旋转蒸发仪旋转蒸发65 ℃减压。液体冷却后,加入4倍体积的无水乙醇,在此期间用玻璃棒不断搅拌,在4 ℃冰箱中放置12 h。在5000 r/min下离心20 min,弃去上清液留下沉淀,再用蒸馏水溶解,加入溶液体积1/4的氯仿-正丁醇溶液(4∶1,V∶V),摇晃15 min,在4000 r/min下离心15 min,弃去中间及下层的物质,得到多糖提取液,定容到100 mL容量瓶后进行稀释10倍。加入苯酚和浓硫酸,反应后测定吸光度,重复3次。
1.3.1 酶用量对多糖得率的影响
分别称取4份1 g木槿花粉末置于瓶中,加入40 mL蒸馏水,加入0.05%,0.10%,0.20%和0.30%纤维素酶,在50 ℃下反应2 h,按1.3项下测定多糖得率,确定木槿花多糖提取最佳酶用量。
1.3.2 酶解时间对多糖得率的影响
分别称取4份1 g木槿花粉末置于瓶中,加入40 mL蒸馏水和0.05%纤维素酶,在50 ℃下分别反应60,90,120和150 min,按1.3项下测定多糖得率,确定木槿花多糖提取最佳酶解时间。
1.3.3 料液比对多得率的影响
分别称取4份1 g木槿花粉末置于瓶中,加入0.05%纤维素酶,分别加入20,30,40和50 mL蒸馏水,在50 ℃下反应2 h,按1.3项下测定多糖得率,确定木槿花多糖提取最佳料液比。
1.3.4 酶解温度对多糖得率的影响
分别称取4份1 g木槿花粉末置于瓶中,加入40 mL蒸馏水和0.05%纤维素酶,在40,50,60和70 ℃下分别反应2 h,按1.3项下测定多糖得率,确定木槿花多糖提取最佳酶解温度。
1.4 响应面优化试验
通过分析单因素试验的结果,得出影响因素的最佳取值范围,利用Design-Expert 8.0.6软件设计处理,固定酶解温度60 ℃,探讨影响因素与多糖得率之间的关系,分别设置酶用量、酶解时间、料液比3个水平因素,以1,0和-1进行编码,优化酶法提取木槿花多糖工艺。

表1 试验因素与水平取值
2 结果与分析
2.1 葡萄糖曲线
曲线以葡萄糖质量浓度(mg/mL)为横坐标,以吸光度(A)为纵坐标,得到回归线方程Y=9.299 5X+ 0.006 4(R2=0.999 8)。
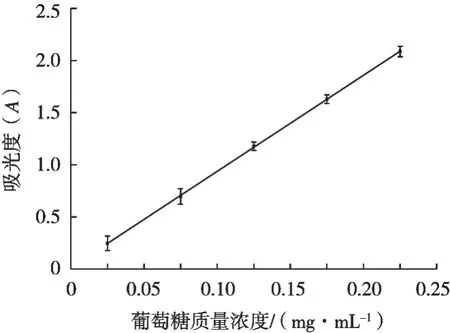
图1 葡萄糖标准曲线
2.2 酶用量对多糖得率的影响
如图2所示,曲线整体呈先上升后下降趋势,酶用量0.05%~0.2%,可以发现木槿花多糖得率一直增长,直至0.2%达到最大值,此时木槿花多糖得率为3.12%± 0.09%。继续加大纤维素酶用量,曲线开始下降,表明木槿花多糖得率开始减少。原因可能是酶用量超过0.2%时,酶分子与全部底物结合,无剩余底物,此时会有剩余的酶,而这些酶会酶解多糖,导致多糖得率下降[23]。因此纤维素酶的最佳酶用量为0.2%。

图2 酶用量对木槿花多糖得率的影响
2.3 酶解时间对多糖得率的影响
如图3所示,随着酶解时间增加,木槿花多糖得率在酶解时间60~120 min之间变化幅度不明显,在酶解时间120~150 min出现激增,并在酶解时间150 min时,木槿花多糖得率达到3.85%±0.2%,通过参考其他相关文献猜测多糖得率在酶解时间180 min会出现下降,所以在响应面水平值上设置酶解时间180 min。

图3 酶解时间对木槿花多糖得率的影响
2.4 酶解温度对多糖得率的影响
如图4所示,观察曲线变化走向,会发现提取率是先增大后减小的。酶解温度60 ℃时,提取率达到最大,即2.695%±0.11%;酶解温度增加10 ℃,发现提取率开始减小。这是因为温度会影响酶反应速度,在最适温度下酶反应速度会达到最大值,但在低温或高温下会导致酶反应速度减慢,甚至会导致酶失活。因此纤维素酶提取木槿花多糖的最佳酶解温度为60 ℃。
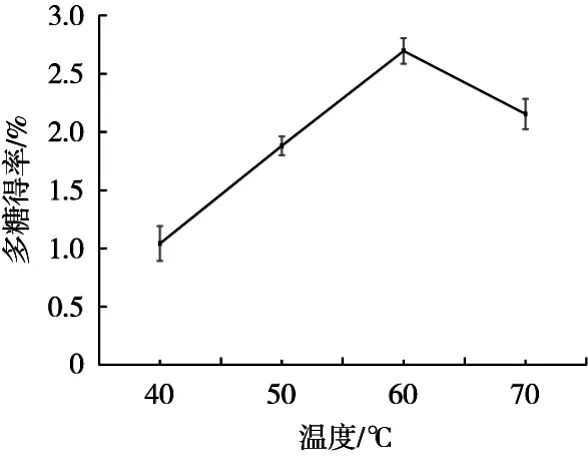
图4 酶解温度对木槿花多糖得率的影响
2.5 料液比对多糖得率的影响
如图5所示,曲线呈现先上升后下降趋势,料液比1∶40(g/mL)时,提取率最大,即2.688%±0.19%。料液比1∶50(g/mL),提取率开始下降。这是因为:在提取多糖过程中所加溶剂太少,会导致多糖不容易从植物细胞中析出,使得多糖得率下降;随着溶剂增加,更多的多糖从植物细胞中析出溶解到溶剂中,多糖得率开始上升,但随着溶剂体积不断增大,溶剂内酶浓度下降,使得多糖得率又缓慢下降。因此纤维素酶提取多糖的最佳料液比为1∶40(g/mL)。

图5 料液比对木槿花多糖得率的影响
2.6 响应面优化试验结果
通过完成单因素试验,得出影响因素的最佳取值范围,利用Design-Expert 8.0.6软件对表2的试验数据进行分析,得到三元二次回归方程:Y=5.19+1.13A-0.11B+0.70C+0.27AB-0.055AC+0.16A2+0.46B2-0.77C2。

表2 响应面试验设计与试验结果
表3显示,回归模型对木槿花多糖得率的影响显著(p=0.0192<0.0500),失拟项不显著(p=0.3929>0.050),说明模型的拟合程度良好。多糖得率的校正系数R2为70.86%,结果表明得出的模型可以解释70.86%多糖得率的变化[14]。
通过表3发现,酶用量、酶解时间和料液比的平方项对木槿花多糖得率的影响较大。分析表3中的F值发现,F值越高,对多糖得率的影响越大。由一次项的F值可以看出FA>FC>FB,因此可以看出影响得率的大小因素顺序为酶用量>料液比>酶解时间。使用Design-Expert得到响应面曲线,曲线的分析原理:响应图的曲面越陡峭,轮廓越密集呈椭圆,表示因素之间交互影响越大[15],所以由图6~图8可以看出,只有酶用量和酶解时间交互作用显著,对多糖得率影响较大。
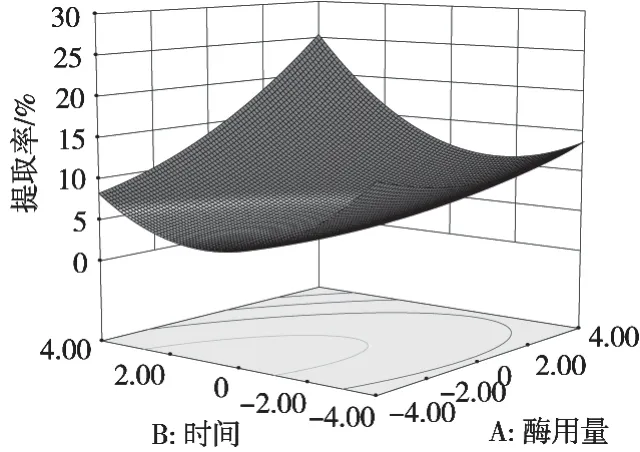
图6 酶解时间和酶用量对多糖得率的影响

图8 料液比和酶解时间对多糖得率的影响

表3 回归模型的方差分析
利用软件分析得到提取木槿花多糖的最佳工艺:酶解时间180 min,酶用量0.3%,料液比1∶48.4(g/mL),预测提取率为7.641%。为验证进行重复试验,试验结果为7.247%,与预期值相差不大,所以利用Design Expert 8.0.6软件得到的回归模型可靠,可用于木槿花多糖的提取。

图7 料液比和酶用量对多糖得率的影响
3 结论与展望
通过单因素试验,得到影响因素的最佳取值范围,利用响应面法建立酶提取木槿花多糖的回归方程模型,改进木槿花多糖的提取工艺。分析后发现影响多糖得率的因素大小顺序是酶用量、料液比、酶解时间。
最佳工艺条件为酶用量0.3%、酶解时间180 min、料液比1∶48.4(g/mL)、酶解温度60 ℃,预测得率为7.641%。通过参考其他文献发现超声波提取木槿花多糖得率为6.36%,比较后发现酶法提取木槿花多糖的提取率要比超声波提取木槿花多糖多1.2个百分点。所以后续研究木槿花多糖的其他特性时,可采用酶法提取木槿花多糖,不仅多糖得率更高,而且节约实验资源。

