金顶侧耳菌菇多糖提取工艺的比较
张婷婷++马磊

摘要:为了寻求最佳的多糖提取工艺,分别采用水提法、碱提取法、复合酶提取法3种方法对影响金顶侧耳(Pleurotus citrinopileatus Sing.)菌菇多糖提取的4个因素(温度、时间、液固比和乙醇用量)进行比较分析。结果表明,复合酶提取法的多糖提取率最高,并且耗时耗能最少,碱提取法的多糖提取率其次,水提法的提取率最低,并且耗时耗能最多。从工业成本上考虑,碱提取法投入生产的可行性更高。
关键词:金顶侧耳(Pleurotus citrinopileatus Sing.);多糖;提取工艺
中图分类号:S646;R284.2 文献标识码:A 文章编号:0439-8114(2017)01-0119-04
DOI:10.14088/j.cnki.issn0439-8114.2017.01.030
Comparison of the Methods of Polysaccharide Extraction
from Pleurotus citrinopileatus Sing.
ZHANG Ting-ting,MA Lei
(College of Life Sciences,Shihezi University,Shihezi 832000,Xingjiang,China)
Abstract:To optimize polysaccharide extraction technology, the influence of temperature, time, the ratio liquid to solid and the volume of ethanol on the Pleurotus citrinopileatus Sing. polysaccharide extraction were researched through comparing the methods of the water extraction, the alkali extraction and the enzymatic extraction. The compound enzyme extraction attained the highest rate of the extraction, which cost the least time and energy. The alkali extraction attained the second higher rate and the water extraction attain the lowest one. According to the industrial cost, the alkali extraction was preferable to the polysaccharide extraction.
Key words:Pleurotus citrinopileatus Sing.;polysaccharide;extraction technology
食用菌多糖是从真菌子实体、菌丝体或发酵液中分离出的由10个以上的单糖以糖苷键连接而成的高分子多聚物,具有抗肿瘤、抗病毒、免疫调节、抗氧化、抗凝血等作用[1-3]。随着生物高分子技术在多糖研究领域的应用,多糖类化合物已成为分子生物学、医学、食品科学等领域的研究热点之一。但是食用菌细胞或组织外大多有脂质包围,所以不容易直接获得,常需要通过一些物理或化学的方法破坏脂质或细胞壁,进行提取和纯化[4-7]。显然,如何有效地从原材料中提取粗多糖,是进行真菌多糖研究的关键。本试验以金顶侧耳(Pleurotus citrinopileatus Sing.)菌菇为试验材料,采用水提法、堿提取法和复合酶提取法提取菌菇多糖,并进行比较分析,为食用菌多糖提取工艺的发展奠定基础。
1 材料与方法
1.1 试验材料
金顶侧耳菌菇、葡萄糖(105 ℃干燥至恒重)、重蒸酚、植物精提复合酶(主要成分为纤维素酶、果胶酶、中性蛋白酶等)上海生物工程有限公司;氢氧化钠、95%乙醇、浓硫酸均为国产分析纯,试验用水均为去离子水。
1.2 试验仪器
多功能粉碎机、XW-80A型漩涡混合器(江苏海门市其林贝尔仪器公司)、DKZ-2型电热恒温振荡水槽(上海精宏试验设备公司)、减压抽滤器、Spectrumlab54型紫外分光光度计(上海棱光技术有限公司)、GL-20G-Ⅱ型高速冷冻离心机(上海安亭仪器公司)。
1.3 试验方法
1.3.1 苯酚-硫酸法 苯酚-硫酸法是利用多糖在硫酸的作用下先水解成单糖,并迅速脱水生成糖醛衍生物,然后与苯酚生成橙黄色化合物,再以比色法测定。
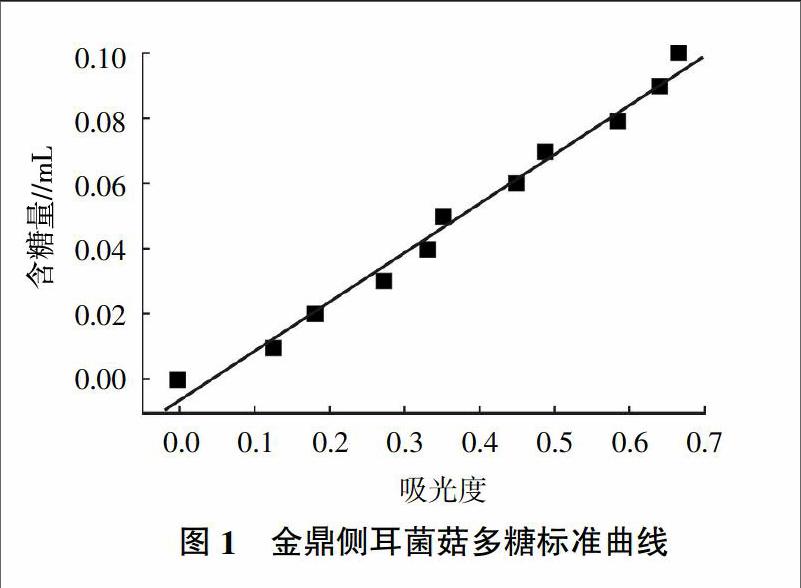
准确称取标准葡萄糖20 mg于500 mL容量瓶中,加水至刻度,分别吸取0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0 mL,各以去离子水补至2.0 mL,然后加入6%苯酚1.0 mL及浓硫酸5.0 mL,摇匀冷却,室温放置20 min以后于490 nm测定吸光度,以2.0 mL去离子水按同样显色操作为空白,以葡萄糖含量(mg/mL)为横坐标(x),490 nm波长下吸光度为纵坐标(y),绘制标准曲线。
1.3.2 水提法 称取金顶侧耳菌菇干粉2 g,分别加入不同体积的去离子水浸提。样品置于一定温度、时间下水浴,进行减压抽滤,保留滤液,滤渣备用。将滤液定容至100 mL,吸取该滤液2 mL,加入相应体积倍数95%乙醇,混匀,放置4 ℃冰箱醇沉24 h。20 ℃下6 000 r/min离心10 min,弃上清液,用95%乙醇洗涤沉淀3次,加入去离子水定容至10 mL,用漩涡混合器使沉淀充分溶解于去离子水后,吸取该溶液0.5 mL,进行含糖量测定。
1.3.3 碱提取法 称取金顶侧耳菌菇干粉2 g,分别加入不同体积的碱液中(pH=9)浸提。样品后期处理同“1.3.2”。
1.3.4 复合酶提取法 配制1%的复合酶液500 mL,将其置于35 ℃条件下活化10 min,称取金顶侧耳干粉2 g,分别加入不同体积的复合酶液浸提。样品后期处理同“1.3.2”。
样品多糖得率=■×100%
2 结果与分析
2.1 标准曲线绘制
通过苯酚-硫酸法绘制得到标准曲线,如图1所示。计算得出测定金顶侧耳菌菇多糖标准曲线的方程为y=0.152x-0.007,R2=0.994。
2.2 水提法对金顶侧耳菌菇多糖得率的影响
水提法试验中,金顶侧耳菌菇多糖得率随着温度的升高而升高(图2-a)。当温度为60 ℃时,多糖得率仅为2.71%;温度为90 ℃时,多糖得率达到最高值4.86%;温度上升至100 ℃时,多糖得率降低至4.67%,这可能是由于过高的温度导致了大分子的多糖键断裂,造成多糖的损失。因此,90 ℃是较为理想的水提温度。水提时间为1.5~2.0 h时,金顶侧耳菌菇多糖得率由4.12%上升至4.45%;水提时间为2.5~3.0 h时,多糖得率由4.71%上升至4.82%(图2-b)。因此,较优的水提时间为3.0 h。
从图2-c中可以看出,当液固比(mL∶g,下同)为10∶1和20∶1时,金顶侧耳菌菇多糖得率仅为1.53%和2.23%;当液固比为30∶1时,多糖得率大幅升高至4.78%;当液固比为40∶1时,多糖得率达到最大值4.87%,液固比为50∶1时,多糖得率为4.85%。同时,液固比为30∶1、40∶1、50∶1与10∶1、20∶1相比多糖得率差異极显著,且前三者之间无显著差异。因此,40∶1为较佳的液固比。
随着乙醇用量的增大,金顶侧耳菌菇多糖得率逐渐升高(图2-d),当乙醇用量为3倍时,多糖得率达到最高4.81%。但当乙醇体积为5倍时,多糖得率却降低至4.22%。乙醇用量为3、4、5倍与1、2倍相比多糖得率差异极显著。考虑到生产成本,3倍乙醇用量较为理想。
2.3 碱提取法对金顶侧耳菌菇多糖得率的影响
采用碱提取法测定金顶侧耳菌菇多糖,多糖得率随着温度的升高而升高(图3-a)。当温度为60 ℃时,多糖得率仅为3.66%;随着温度上升至90 ℃时,多糖得率达到最高值5.84%;当温度上升至100 ℃时,多糖得率降低至5.58%,这可能是由于过高的温度导致了大分子的多糖键断裂,造成多糖的损失。因此,90 ℃是较为理想的碱提取温度。
在碱提取时间为1.5~2.0 h时,金顶侧耳菌菇多糖提取率由5.13%上升至5.68%;在2.0~3.5 h时,多糖得率由5.68%上升至5.76%,变化较小(图3-b)。综合多糖得率、耗能和耗时等方面,较优的碱提取时间为2.0 h。
液固比20∶1、30∶1、40∶1、50∶1与10∶1相比金顶侧耳菌菇多糖得率差异极显著,前四者之间无显著差异(图3-c)。从节约生产成本的角度考虑,20∶1为较佳的液固比。
随着乙醇用量的增大,金顶侧耳菌菇多糖得率逐渐升高,虽然乙醇用量为4倍时,多糖得率最高达到5.78%,但与2倍时的多糖得率5.62%无显著差异;当乙醇用量为5倍时,多糖得率降低至4.83%(图3-d),这可能是由于过大体积倍数的乙醇导致了多糖再次溶解。考虑生产成本,选择2倍乙醇用量较为理想。
2.4 复合酶提取法对金顶侧耳菌菇多糖得率的影响
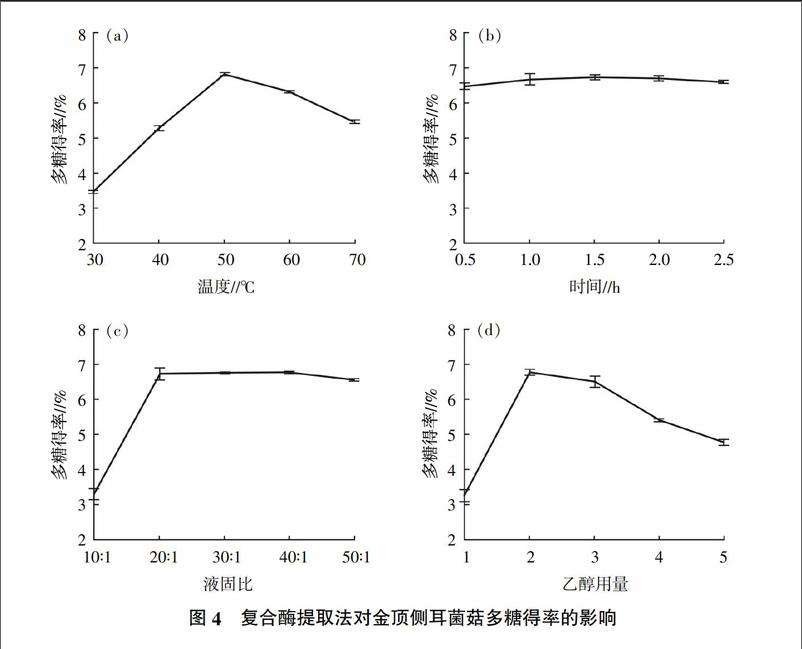
由于酶的特性,酶解法可以在较低的温度下提取多糖。从图4-a可以看出,在50 ℃时,金顶侧耳菌菇多糖得率就达到最高6.82%。随着温度的升高,多糖提取率反而降低,这可能是由于高温使酶活性丧失,所以50 ℃是较为理想的复合酶提取温度。
由于酶作用的专一性和高效性,使得提取时间大大缩短。由图4-b可知,提取1.0 h后,多糖得率由0.5 h时的6.46%提高到6.68%;1.5 h后,多糖得率达到最高6.73%,仅比提取1.0 h增加0.27个百分点。各组浸提时间多糖得率均无显著差异。因而,综合多糖得率、耗能和耗时等方面,较优的复合酶提取时间为1.0 h。
液固比20∶1、30∶1、40∶1、50∶1与10∶1相比,金顶侧耳菌菇多糖得率差异极显著,但前四者之间无显著差异,从节约生产成本的角度考虑,20∶1为较佳的液固比。
随着乙醇用量的增加,金顶侧耳菌菇多糖得率逐渐升高,当乙醇用量为2倍时,多糖得率达到最高值5.61%;当乙醇用量为5倍时,多糖得率降低至4.76%(图4-d),这可能是由于过多的乙醇导致多糖再次溶解。考虑生产成本,2倍乙醇用量较为理想。
3 讨论
水提法是多糖提取中最早采用的传统方法,金顶侧耳菌菇多糖能够溶解于水,热水浸提时,金顶侧耳菌菇组织细胞膨胀破裂,多糖成分浸出[8]。虽然水提法具有成本低、方法温和、对多糖活性破坏小、操作简便和试验成本低等优点,但是水提法提取率较低、耗时较长、耗能较高。
碱提取法是在传统多糖提取方法上的改良[9]。同水提法相比碱提取法能够有效提高多糖得率,缩短提取时间,但是碱性过强,容易影响多糖的结构。碱提取法浸提条件剧烈,随着提取温度的升高,多糖得率会增高,只有严格控制碱的用量,保持在稀碱的条件下,浸提液中的糖不发生分解和碳骨架断裂,才能有效地提取多糖并且保证多糖的质量。
复合酶提取法不仅能够克服传统方法低提取率的问题,还可以改变原有天然成分的结构,增加提取物的生理活性。酶具有高效性、专一性、多样性、温和性等特性,可以在温和的条件下对有效成分进行高选择性转化。本试验中所采用的植物复合酶主要由纤维素酶、果胶酶、中性蛋白酶等组成。纤维素酶能降解细胞壁,从而加速多糖的浸出[10];果胶酶能水解果胶促进多糖溶出到浸提液中;蛋白酶可降解蛋白质,降低与原料的结合力,有利于多糖的浸出。但是该方法也存在着一定的局限性,酶法提取对试验条件要求较高,酶易失活,不易保存,并且价格昂贵。
通过水提法、碱提取法和复合酶提取法3种多糖提取方案的比较可以看出,在多糖提取效率上,复合酶提取法的多糖提取率最高,并且耗时耗能最少,碱提取法的多糖提取率其次,水提法的提取率最低,并且耗时耗能最多。虽然,复合酶提取法效率最高,但是试验成本最高,所要求的试验条件也最为严格。因此,在工业生产中,酶提取法技术需进一步深入研究,能否将其用于工业化的多糖提取中,还需综合考虑成本、提取率和生产条件等因素。水提法虽然成本低廉,方法简单,但是耗能较大,提取率低,因此也不适用于工业生产中。碱提取法成本不高,投入生产的可行性高,只需要严格控制试验中用碱量,便能达到高提取率、低耗能耗时的效果,所以可以通過更进一步的试验和分析,确定采用碱提取法提取金顶侧耳菌菇多糖工艺的优化设计,从而确定最优试验方案用于指导生产实践。
参考文献:
[1] 龚淑俐,邓放明.真菌多糖的生物活性研究进展[J].中国食物与营养,2007,22(1):76-78.
[2] 郝瑞芳,景 浩.真菌多糖的研究进展[J].中国食物与营养,2008(4):20-24.
[3] 黄益丽,廖鑫凯,李清彪,等.香菇多糖的生物活性[J].生命的化学,2001,21(5):12-15.
[4] 江 蕾,张朝晖.侧耳属真菌多糖的研究进展[J].食品科技,2007,11(3):34-36.
[5] 姜 宁,刘晓鹏,吴红江,等.金针菇菌丝体多糖超声提取工艺的研究[J].食品科学,2008(8):56-58.
[6] 江 艳,王 浩,吕 龙,等.灵芝孢子粉多糖Lzps-1的化学研究及其总多糖的抗肿瘤活性[J].药学学报,2005(4):61-63.
[7] 李 洁,邱德江.酶法提取羊肚菌多糖的研究简报[J].河北林业科技,2005(2):1-2.
[8] 刘 栋,钱建亚,卜 敏.香菇多糖抗肿瘤作用研究现状[J].食用菌,2003(2):6-7.
[9] 刘晓鹏,姜 宁,向东山,等.金针菇深层发酵条件及水浴提取菌丝体多糖的研究[J].食品科学,2008(9):199-201.
[10] 刘晓鹏,姜 宁,张思乾,等.纤维素酶辅助提取茶树菇多糖的研究[J].中国酿造,2008(22):71-73.

