车前子对腹泻大鼠小肠黏膜AQP1表达的影响*
河北中医学院药学院
王 杨 彪雅宁 张纳博 韩 雪 胡巍巍△ 张一昕 相聪坤△△ 李博妍(石家庄 050200)
提要 目的:研究车前子对腹泻大鼠小肠组织中水通道蛋白1(AQP1)基因和蛋白表达的影响,探讨其治疗腹泻的作用机制。方法:采用番泻叶灌胃复制大鼠腹泻模型。将60只SD雄性大鼠随机分为正常对照组、模型对照组、阳性药(氢氯噻嗪)对照组和车前子低、中、高剂量组。除正常组外,其余各组均于每日上午灌胃番泻叶水煎液,正常组灌胃等量的蒸馏水;每日下午各治疗组灌服相应的治疗药物,正常组和模型组灌服等量的蒸馏水,给药期间观察大鼠的排便情况,给药2周。麻醉状态下,剖取2份小肠组织,1份置于4%多聚甲醛液中固定,苏木精-伊红(HE)染色法观察小肠黏膜病理形态学变化,1份置于冻存管,液氮冻存,用于qRT-PCR法和Western blot法检测小肠组织AQP1基因和蛋白的表达水平。结果:模型组大鼠排水样稀便;小肠绒毛表皮细胞明显凋亡与坏死,固有层毛细血管扩张充血明显,间质有少量中性粒细胞浸润;小肠组织AQP1基因和蛋白的表达水平均明显低于正常组(P<0.01)。与模型组比较,车前子各剂量组大鼠粪便基本成形;小肠绒毛表皮细胞凋亡、坏死和毛细血管扩张充血现象均减轻,间质有少量中性粒细胞浸润,中、高剂量组可见上皮细胞增生;车前子各剂量组小肠组织AQP1的基因和蛋白的表达水平显著高于模型组(P<0.05或P<0.01),高剂量组高于阳性药组(P<0.05)。结论:车前子具有止泻作用,其机制与上调AQP1的表达水平,增加小肠对水的吸收量、促进水液代谢有关。
腹泻是多种因素引起胃肠功能出现障碍,以肠道水液代谢紊乱为主要表现的疾病。[1-2]在肠道上皮和内皮组织细胞膜上广泛分布着水通道蛋白(AQPs),它们在调节水液代谢中起重要作用,与腹泻的发生发展具有密切的关系。[3]车前子(PlantagoasiaticaL.)是车前科植物车前PlantagoasiaticaL.或平车前PlantagodepressaWilld.的干燥成熟种子,归肾、小肠等经,能利小便以实大便而奏止泻之效,单用或随证配伍用于治疗急慢性腹泻具有较好的疗效。[4-5]但尚未发现对其止泻作用机制的研究报道。故本实验采用番泻叶建立大鼠腹泻模型,通过观察车前子对腹泻大鼠小肠组织水通道蛋白1(AQP1)的基因和蛋白的表达的影响,探讨车前子治疗腹泻的作用靶点和机制,为车前子止泻的临床应用提供现代依据。
1 材料与方法
1.1 实验动物
SD大鼠60只,雄性,6~8周龄,体质量160~180 g,购自河北省实验动物中心,动物许可证号:SCXK(冀)2013-1-003。
1.2 实验药物
车前子配方颗粒(批号:8122593,当量比为15∶1)购于四川新绿色药业有限公司,将车前子配方颗粒加入到100℃适量的蒸馏水中,加热充分搅拌使其全部溶解。氢氯噻嗪片(批号:180922)购于山东仁和堂药业有限公司,实验时加入0.5%的羧甲基纤维素钠助溶,配制成所需浓度的混悬液。番泻叶购于石家庄同仁堂药房,称取200 g番泻叶浸入1 000 mL 100 ℃纯净水中,充分搅拌,浸渍30 min后用4层纱布过滤,滤液蒸发浓缩至600 mL,制成番泻叶药液(含生药0.3 g/mL),置4 ℃冰箱中冷藏备用。
1.3 实验试剂与仪器
Trizol(批号:139603)购于美国invitrogen生命技术有限公司;TIANScript RT KIT(批号:KR104-02)、SuperReal PreMix Plus(批号:FP205)均购于中国北京天根生化科技有限公司;AQP1兔多抗(货号:bs-1506R-1)购于美国Origene公司;其它试剂均为国产分析纯试剂。三恒多用电泳仪(15D型,北京六一生物科技公司);紫外透射仪(uv-254型,北京鼎国昌盛生物有限责任公司);凝胶成像系统(UVP型,中国Thermo公司);半干转膜仪系统(AE-6687型,日本ATTO公司);TS-500转移脱色摇床、QL-902涡旋混合器(中国海门市其林贝尔仪器制造有限公司);ABI7500荧光定量PCR仪(美国Applied Biosystems公司);Centrifuge 5415D离心机、BioPhotometer生物分光光度计(德国Eppendorf公司)。
1.4 动物分组及模型建立
将60只SD大鼠饲养于18 ℃~22 ℃明暗各12 h的清洁级动物实验室内,正常喂养1周后,随机分为6组:正常对照组、模型对照组、阳性药(氢氯噻嗪)对照组(9 mg/kg)和车前子低、中、高剂量组(0.69、1.38、2.76 g/kg),每组10只。除正常组外,其余各组均于每日上午灌胃番泻叶水煎液(20 mL/kg),复制大鼠腹泻模型,正常组灌胃等量的蒸馏水做对照;每日下午各治疗组灌服相应的治疗药物,正常组和模型组灌服等量的蒸馏水,给药体积为1 mL/100 g,给药2周。给药期间观察大鼠排便情况。
1.5 标本采集
给药结束禁食16 h后,3.5%水合氯醛(1 mL/100 g)腹腔注射麻醉大鼠。麻醉状态下,迅速取2份小肠组织,剖开,生理盐水冲洗干净后,1份置于4%多聚甲醛液中固定,用于观察小肠黏膜病理形态学变化,另1份置于冻存管,液氮冻存,用于检测AQP1的基因和蛋白的表达水平。
1.6 病理学观察
将4%多聚甲醛固定的小肠组织取出,采取常规的脱水、浸蜡包埋、切片、苏木精-伊红(HE)染色,显微镜下观察其病理学改变情况。
1.7 qRT-PCR方法观察小肠组织中AQP1 mRNA表达水平
取冻存的小肠组织,Trizol提取其总RNA,取用5 μL RNA,1%琼脂糖凝胶进行电泳,目的是检测RNA的完整性。primer5.0软件设计实验所需各引物序列。内参基因β-actin:F/R 5 '-CCTAGACTTCGAGCAAGAGA -3',5'-GGAAGGAAGGCTGGAAGA -3 ',扩增片段为140 bp。AQP1:F/R 5'-GGCTTGTCTGTGGCTCTTGGAC-3',5'-AGTGGTTTGAGAAGTTGCGGGT-3',扩增片段为112 bp。依据产品的说明书采用TIANScript RT KIT进行反转录操作,运用荧光定量PCR仪,按照相对定量方法分析,以2-△△Ct表示基因的相对表达量。
1.8 Western blot法观察小肠组织中AQP1蛋白的表达水平
称取小肠组织约100 mg,液氮充分研磨后,转移到含有1 mmol/L PMSF的900 μLRIPA的中性裂解液中,混合均匀之后超声裂解,配平以后在4 ℃温度下,离心机转速12 000 r/min,离心15 min静置后,收集其上清液测定蛋白含量,将蛋白煮沸变性以后,经SDS-PAGE凝胶电泳分离后,再转移到PVDF膜上,其后用5%的脱脂奶粉封闭,一抗4 ℃孵育过夜,PBST洗膜3次,洗净未结合的一抗。将洗涤后的一抗反应膜放入二抗工作液中,室温孵育1.5 h,PBST洗膜3次,洗去游离二抗。暗室曝光,X胶片上显影,用Tanon Gis软件扫描各条带的吸光度值并分析结果。
1.9 统计学方法
2 结果
2.1 实验大鼠粪便变化情况
除正常组以外,其余大鼠灌饲番泻叶药液2 d后,排出夹杂黏液的水样稀便,腹泻发生率为100%,同时大鼠出现不同程度的食欲减少,精神差,活动减少,毛发干枯失去光泽,肛周体毛被稀便沾染。给药4 d后,各用药组大鼠粪便逐渐成形,含水量降低,但车前子各剂量组与阳性药组相比,大便仍偏于湿软。
2.2 实验大鼠小肠黏膜病理形态学变化
正常组大鼠小肠绒毛表皮较完整,细胞排列整齐,但有少量表皮细胞凋亡与坏死脱落;模型组大鼠小肠绒毛表皮细胞出现明显凋亡与坏死,固有层毛细血管扩张充血明显,间质有少量中性粒细胞浸润;阳性药组大鼠小肠绒毛表皮细胞少数凋亡与坏死,固有层毛细血管扩张充血明显,偶见中性粒细胞浸润;车前子低、中剂量组大鼠小肠绒毛上皮细胞凋亡、坏死以及固有层充血减轻,中性粒细胞浸润多见,中剂量组可见上皮细胞增生活跃,核分裂明显;车前子高剂量组大鼠小肠绒毛上皮细胞凋亡少见,上皮细胞轻微增生,排列较密集,固有层轻微充血和少量的中性粒细胞浸润。见图1。
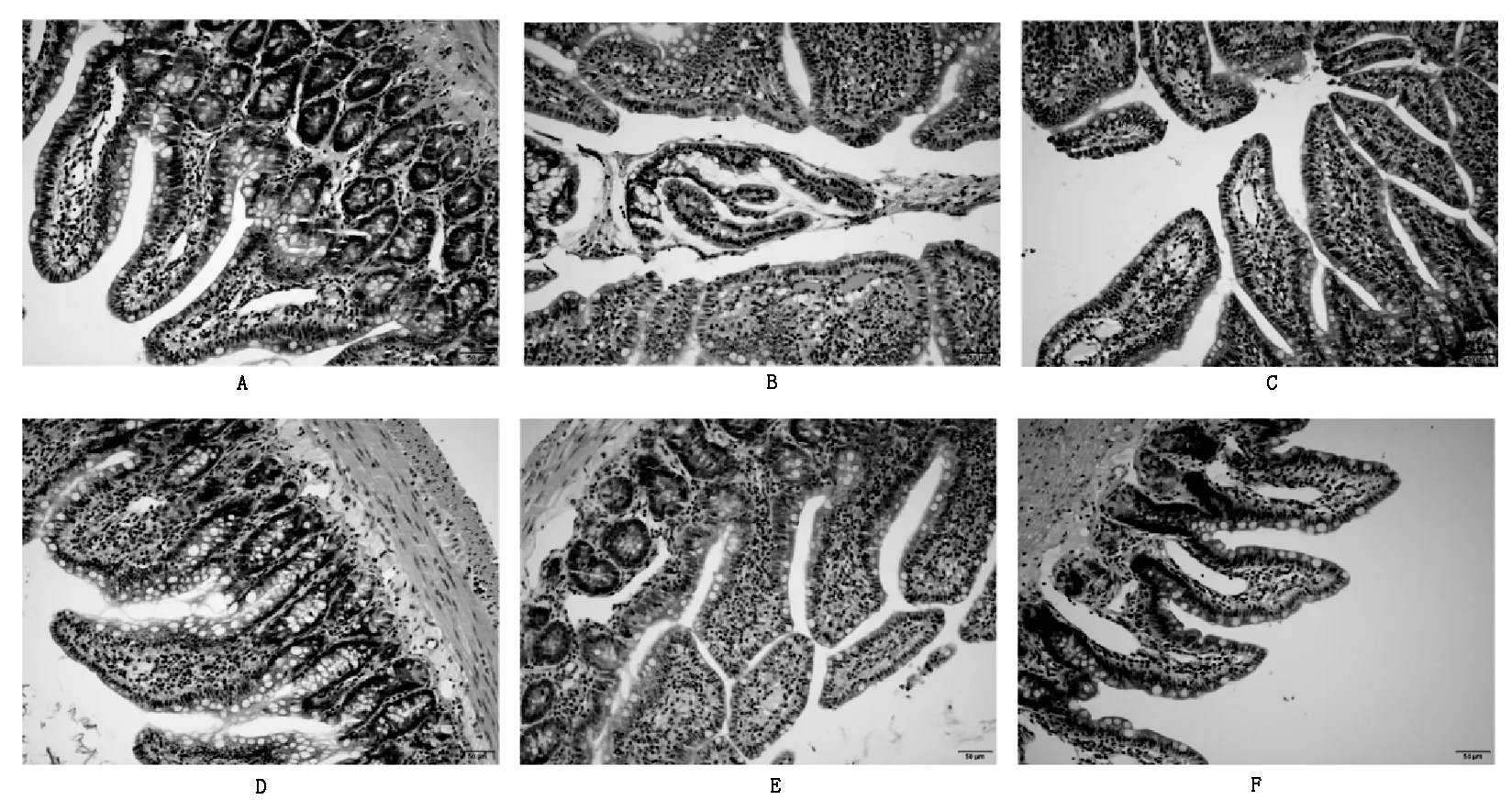
注:A 正常组;B 模型组;C 阳性药组;D 低剂量组;E 中剂量组;F 高剂量组。
2.3 实验大鼠小肠组织AQP1 mRNA和蛋白的表达变化
与正常组比,模型组AQP1 mRNA和蛋白的表达水平均表现为明显的下降(P<0.01);与模型组比,各用药组AQP1 mRNA和AQP1蛋白的表达均显著升高(P<0.05或P<0.01);与阳性药组比,高剂量组明显升高(P<0.05)。详见表1、图2。
3 讨论
中医将腹泻归属于“泄泻”范畴,认为肌体由于外邪侵袭,或被饮食所伤,导致脾失健运,水液运输发生障碍,水湿停聚于肠中而引起以排便次数增多、粪便稀溏,甚至如水样的症状。正如 《景岳全书·泄泻》所说:“凡泄泻之病,多由水谷不分,故以利水为上策。”因此,治疗腹泻常选用利小便的药物。车前子为利水渗湿的常用药,历代医家每每用其良好的通利小便作用,达到“利小便以实大便”的目的,临床单用或随证配伍治疗湿热泄泻(急性肠炎)、脾虚湿盛的慢性泄泻等多种原因导致的腹泻。
表1 各组大鼠小肠组织AQP1 mRNA和AQP1蛋白表达水平的比较
注:与正常组比较,**P<0.01;与模型组比较,△P<0.05, △△P<0.01;与高剂量组比较,▲P<0.05,▲▲P<0.01;与阳性药组比较,﹟P<0.05。

注:1 正常组;2 模型组;3 阳性药组;4 低剂量组;5 中剂量组;6 高剂量组。
小肠是调节肌体液体分泌、吸收和转运的主要器官,若因某些因素刺激肠道释放炎性因子、发生炎症反应,进而激活水通道及其转运体的活性改变,致使水分和电解质在肠道吸收、代谢功能紊乱,则会聚集于肠腔出现腹泻。[6]肠道水液的吸收和分泌是通过跨细胞的途径而实现的,而AQPs则是肠道跨途径转运、实现该功能的重要载体,在水液代谢中发挥着重要的作用。[7]AQPs 的表达异常会导致肠道水分吸收减少而大量蓄积诱发腹泻。[3]目前,已有6种AQPs在小肠中被发现,AQP1、AQP3、AQP4、AQP5、AQP8以及AQP9,[8]AQP1在小肠中段表达最为明显。[9-10]据报道,番泻叶能促进肠蠕动,抑制肠道的消化功能,并刺激肠道,促进炎性介质的合成与释放,进而损伤肠黏膜和增加大肠排空速度,造成大鼠腹泻。[11]腹泻时,小肠处于高分泌的状态,会明显升高肠腔内的渗透压。[12]当肠道渗透压升高时,肠道会明显降低对水的吸收量,肌体会代偿性的增加AQPs的表达量,使小肠对水的吸收能力有所提高。[13]逯越[2]等证实番泻叶引起的大鼠腹泻模型中小肠组织AQP1的蛋白表达水平低于正常组,影响小肠对水的代谢吸收功能而引起腹泻,因此AQP1对腹泻的发生发展具有重要的影响。
本实验结果显示模型组大鼠排水样稀便;小肠黏膜中出现柱状上皮细胞凋亡坏死、毛细血管扩张充血以及间质中性粒细胞浸润现象;小肠组织中的AQP1 mRNA和蛋白表达水平均明显下降(P<0.01),表明番泻叶导致小肠黏膜出现较为明显的炎症性改变,部分小肠黏膜细胞出现凋亡和坏死,小肠组织AQP1 mRNA和蛋白的表达显著下降,水分吸收减少而在肠道大量聚集出现腹泻。经给予车前子治疗后,大鼠粪便基本成形;小肠黏膜柱状上皮细胞凋亡坏死、毛细血管扩张充血以及间质中性粒细胞浸润现象均减轻;伴随着小肠黏膜炎症反应的减轻和好转,小肠组织AQP1 mRNA和蛋白表达水平均显著上调(P<0.01),肠道对水分吸收增加,肠腔中水分减少,粪便逐渐成形,腹泻明显减轻。由此可见,车前子通过减轻番泻叶所致小肠黏膜的炎症反应,上调AQP1 mRNA和蛋白的表达水平,促进水分吸收和转运速度,调节水液代谢,以达到治疗腹泻的目的,此可作为车前子治疗腹泻的机制之一。

