FOXO1 和FOXO3a 基因靶向转导对缺氧/复氧小鼠心肌细胞的作用研究
李继红 阿尔祖古丽·米尔阿卜杜拉 金晓倩 黄莺(通讯作者) 马依彤 马翔 刘芬 陈邦党 刘成
(1 新疆医科大学第一附属医院冠心病二科 新疆 乌鲁木齐 830054)
(2 新疆心血管病研究所 新疆 乌鲁木齐 830054)
心肌梗死是心力衰竭是主要原因之一。研究其发病机制,有助于寻找新的干预措施,来提高预防及治疗效率,达到提高患者的生存率及生活质量、改善冠心病心肌梗塞预后的目的。与衰老有关的氧化应激是缺血性心力衰竭的发病机制之一,氧化应激所产生的机体活性氧簇(ROS)促使动脉硬化斑块破裂,导致冠状动脉血栓形成;急性心肌梗塞发生时,ROS 会参与到组织损伤反应[1-2]。研究显示,ROS 的不良作用可能被抗氧化应激反应所抑制,起到改善缺血性心力衰竭预后的作用。叉形头转录因子O 亚族(forkhead box transcription factor O,FoxO)是重要的抗氧化应激调节因子,过表达FOXO1 可以抑制ROS 并减少心肌细胞死亡[3],但转基因的方法会导致胚胎致死,因此需要寻找合适的载体进行靶向基因转导。据报道,Fox O1、Fox O3a 及 Fox O4 对维持心功能和调节心脏应力有至关重要的作用[4]。其中,FoxO3a 能够抑制肿瘤进展,调节血管内皮细胞、心肌细胞及血管平滑肌的生物学功能,同时有明确的抗氧化应激作用,因此,可能可用于心血管疾病的诊治。因此本研究拟通过观察重组腺病毒靶向转导Fox O1、Fox O3a基因对缺氧/复氧(H/R)心肌细胞的作用,探讨其抗氧化作用及由此带来的细胞功能变化,报告如下。
1.资料与方法
1.1 一般资料
将H9C2 小鼠的心肌细胞先缺氧(H)3h 后,复氧(R)6h,然后建立缺氧/复氧损伤模型;然后随机分为5 个组:A 组为Control 组,B 组为缺氧/复氧(H/R)组),C 组为缺氧/复氧+FOXO1 组,D 组为缺氧/复氧+FOXO3a 组、E 组为缺氧/复氧+FOXO1+FOXO3a 组。
1.2 方法
1.2.1 检测细胞中的蛋白表达情况 细胞裂解后进行蛋白定量,20μg/孔,加上样缓冲液沸水浴后离心取上清上样,PAGE胶放入电泳槽并加缓冲液,加样,80V 20min;电泳后胶移入转膜缓冲液,剪下PVDF 膜,甲醇浸泡3min,水洗2min,剪6 块滤纸与PVDF 膜,然后在转膜缓冲液中平衡15min。转膜装置设定为恒流200mA,40min。膜洗1 次(放入TBST 中),然后置于丽春红染色液中,5min 后水洗膜至水变清无色蛋白条带清晰。5% BSA 室温封闭1 h,一抗和膜4 ℃中孵育过夜。孵育一抗的膜洗涤(实验室TBST)3 次后按1 ∶5000 稀释二抗,与膜37℃孵育1 h。洗涤3 次,于化学发光仪中进行拍照。
1.2.2 氧化应激相关指标活性氧的水平 稀释好的蛋白0.1ml 加入,4℃放置一夜。次晨,清洗。在已包被好的反应孔加 0.1ml稀释好的标本,37℃培育1h。将稀释好的酶标抗体 0.1ml加入到实验孔,37℃培育0.5 ~1h。把TMB 溶液滴人各反应孔中,培养(在37℃,10 ~30 min)后使用 H2SO4( 0.05ml)终止实验。对其吸光度OD 值进行测量:调整ELISA 检测仪波长为450nm,或用波长为410nm 的ABTS 显色。见图1。
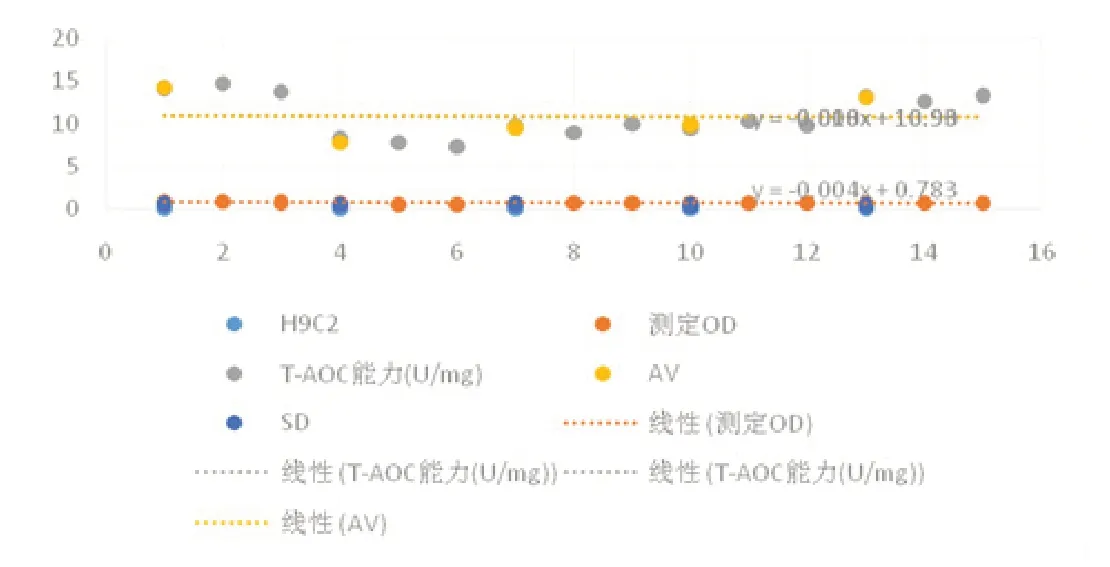
图1 组织细胞中T-AOC 能力
1.2.3 检测细胞凋亡情况 爬片细胞固定(4%多聚甲醛)20 ~30min,进行室温(用百分之一TritonX-100)通透3 ~5min;滴加100μl DNase I 反应液,37℃30min,并且配制TdT 酶反应液: 37 度避光反应60 min,每个样本中滴加50μl Streotavidin-Fluorescein 标记液后放入湿盒,37 度避光反应30min,Hoechst 复染细胞核:用pH7.4 的PBS 洗涤3 次,去除PBS 后,加入Hoechst 染液。孵育10min(避光室温)。镜下观察并拍照。
1.2.4 Brdu 法检测细胞增殖活力 H9C2 细胞以5×104cells/ml细胞数接种于24孔板中,1ml/孔,温度为37 ℃,培养(在5% CO2培养箱中)24h。对各组细胞进行不同处理,在48h 后终止细胞培养之前,加入BRDU(50μM),37℃孵育40min。吸弃培养液,静置5min 后吸出液体,重复5 次。甲醇/醋酸固定10min。经固定的玻片空气干燥,用0.3% H2O2-甲醇30min 灭活内源性氧化酶。用封闭(5%的BSA)。变性核酸5min(100℃的甲酰胺)。冷却。使用PBS 洗涤,加入抗大鼠BrdU 单抗,4℃过夜孵育。加PBS 洗涤,并重复5 次。加荧光二抗,在37℃中孵育1h。加PBS洗涤,再重复5 次。使用Hoechst 33258 染液孵育30min(室温避光)后,镜下观察拍照保存。
2.结果
2.1 转染后H9C2 细胞蛋白表达
WB 结果显示:FOXO1 在B 组表达最低,FOXO1 病毒作用后表达会明显的上升,且高于A 组;FOXO3a 病毒基本不会影响FOXO1表达;FOXO3a 蛋白在B 组中表达也是会最低,FOXO3a 病毒作用后其表达则会明显的上升,且高于A 组,FOXO1 病毒对FOXO1 蛋白的表达有一定影响。见图2。
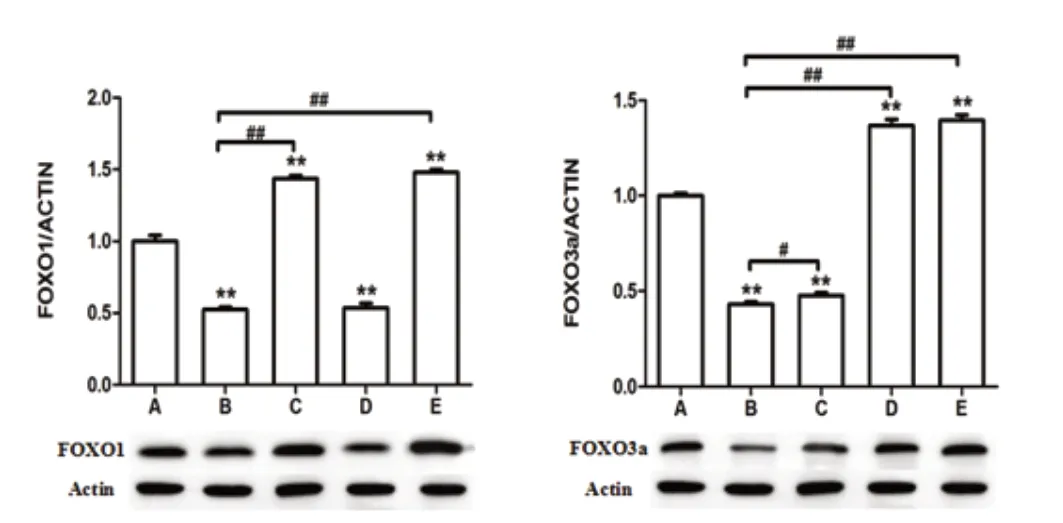
图2 Western blot 检测细胞中FOXO1 与FOXO3a 的表达
2.2 FOXO1 与FOXO3a 对H9C2 细胞缺氧/复氧时氧化应激相关指标的影响
ELISA实验结果提示:SOD与T-AOC活性的表达趋势基本相同,均为B 组中表达最低。FOXO1 与FOXO3a 基因转导后表达升高明显;MDA 含量、ROS 活性及NO 含量检测趋势基本相同,均为B 组中表达最高,FOXO1 或/与FOXO3a 基因转导后表达降低明显。见图3。
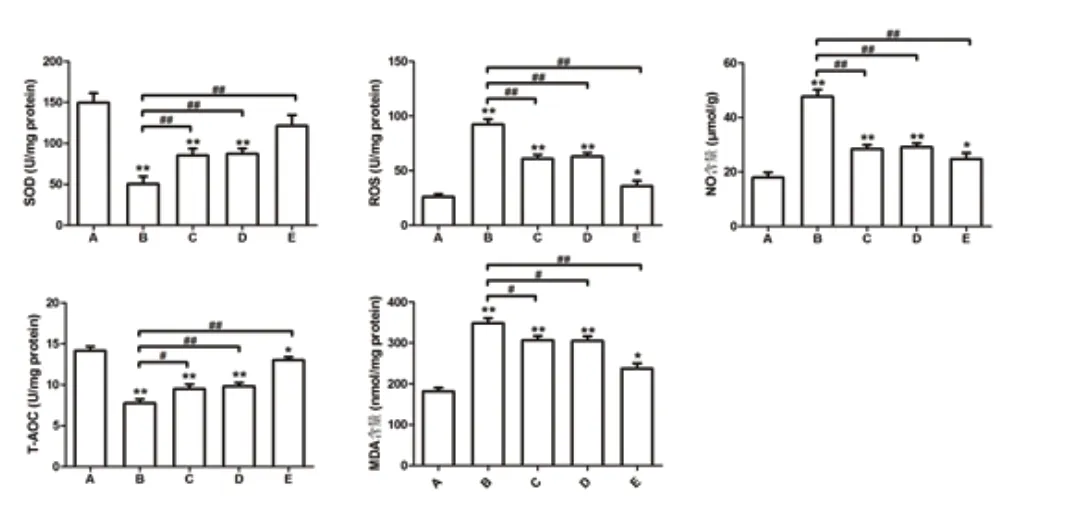
图3 用ELISA 法检测细胞氧化应激相关指标的水平
2.3 FOXO1 与FOXO3a 的基因转导对缺氧/复氧H9C2 细胞凋亡的影响
TUNEL 结果提示:蓝光代表正常细胞核,绿光代表凋亡的细胞核;A 组的凋亡是最少的,B 组的凋亡情况最多,C 和D 组的凋亡率显著低于B组,而E组的凋亡进一步下降,但仍高于A组。见图4。
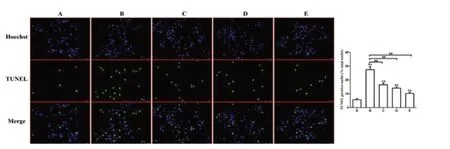
图4 TUNEL 检测H9C2 细胞的凋亡情况
2.4 FOXO1 与FOXO3a 基因转导对于缺氧/复氧H9C2 细胞增殖活力的影响
Brdu 检测结果提示:蓝光代表正常的细胞核,红光代表增殖的细胞核,A 组的增殖能力显著高于其他四组;B 组的增殖能力最低;C、D 组的增殖能力要显著高于B 组,但比A 组低;E 组的增殖能力高于C 组及D 组,比A 组略低。见图5。
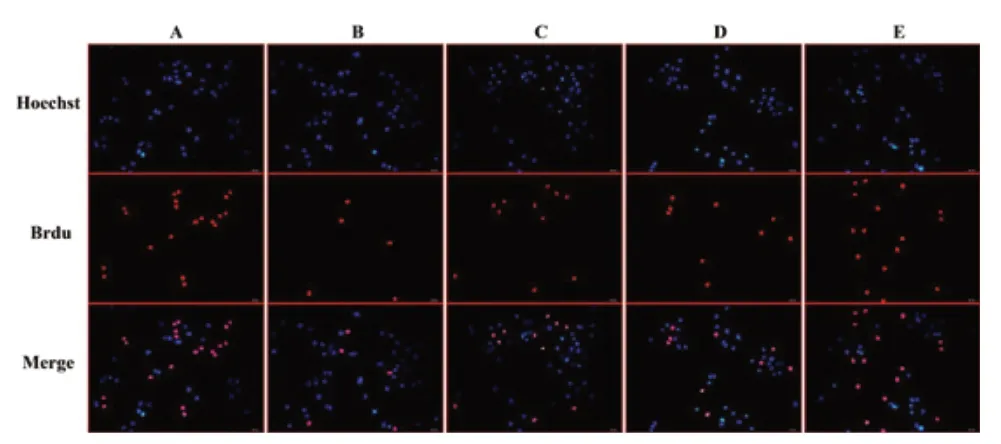
图5 Brdu 法检测缺氧/复氧H9C2 细胞的增殖活力
3.讨论
目前,缺血性心肌损害已成为心力衰竭的首要病因,而氧化应激反应在心力衰竭的发生及进展中起到了至关重要的作用。FoxO 是重要的抗氧化应激调节因子。既往研究显示:在肝细胞中,通过上调FOXO1 的蛋白的表达,可抑制裸鼠皮下移植性肝肿瘤的生长[3];成骨细胞中增强FOXO1 的活性可降低Bcl-2 表达,使成骨细胞生长受到抑制。有研究表明,FOXO1 还可激活FasL、CD95、Bim 促凋亡蛋白的表达[5-6],提示了FOXO1 重新激活可能是细胞存活与凋亡的关键调节因子之一。而通过调节FOXO3 的表达,能够阻碍缺血性损伤和心肌梗死患者病情的进展。FoxO3a转录因子已被证实可抑制 VSMCs 增殖并有抗氧化应激作用,继而可能会降低高血压对机体的影响[7]。心血管疾病中Fox O3a 有保护和损伤的双重作用,如何更好地利用其调控机制治疗心血管疾病值得进一步研究。
本研究显示,FoxO1、FoxO3a 被重组腺病介导后转染缺氧/复氧心肌细胞,有效的减少了细胞的凋亡。据此得出结论,FOXO1 与FOXO3a 的基因转导,减轻了氧化应激反应对H9C2 心肌细胞的损伤。H9C2 心肌细胞的增殖、存活能力明显的改善。此研究结果,为缺血性心脏病心力衰竭的基因治疗提供了新的研究数据,并开拓了新的研究领域,为药物研究提供了新的靶点。

