miR-383-5p与KIF3B的靶向关系及对皮肤鳞状细胞癌增殖、凋亡的调控
林永丽,李 艳,雷东春,杨 灿
1)驻马店市中心医院皮肤科 河南驻马店 463000 2)郑州市第三人民医院肿瘤科 郑州 450000 3)河南省人民医院皮肤科 郑州 450000
皮肤鳞状细胞癌是常见的一种恶性肿瘤且具有较高的发病率及死亡率,目前临床主要以手术治疗为主,具有一定治疗效果,但患者预后较差[1]。皮肤鳞状细胞癌发病机制尚未阐明,因而探究其发生发展的分子机制有助于改善患者预后。miRNA可通过调控靶基因表达,参与细胞增殖、分化、凋亡等生物学过程,既往研究[2-4]显示部分miRNA在皮肤鳞状细胞癌中异常表达并可调控肿瘤细胞增殖及凋亡等过程,在皮肤鳞状细胞癌发生过程中发挥重要作用[5-6]。miR-383-5p在乳腺癌、宫颈癌中表达下调,抑制miR-383-5p表达可促进肿瘤细胞增殖及侵袭[7-8]。生物信息学分析结果显示驱动蛋白家族成员3B(kinesin family member 3B,KIF3B)可能是miR-383-5p的靶基因。研究[9]表明KIF3B在大肠癌中高表达并可促进肿瘤进程。本研究首先分析了miR-383-5p与KIF3B在皮肤鳞状细胞癌细胞系中的表达情况,探究二者之间的靶向关系,探讨miR-383-5p与KIF3B对癌细胞增殖及凋亡的影响,以期为揭示皮肤鳞状细胞癌发病机制奠定理论基础。
1 材料与方法
1.1主要试剂及仪器DMEM、Opti-MEM减血清培养基购自美国Gibco公司,胎牛血清、lipofectamine2000、胰蛋白酶购自美国Thermo Fisher公司;RIPA裂解液购自北京全式金生物技术有限公司,Trizol购自美国Invitrogen公司,反转录试剂盒、荧光定量PCR试剂盒购自北京天根生化科技有限公司。miR-383-5p模拟物(miR-383-5p mimics)及其阴性对照(miR-NC)、KIF3B小干扰RNA(si-KIF3B)购自广州锐博生物科技有限公司。pcDNA3.1购自上海远慕生物科技有限公司。MTT购自美国RD公司,Annexin V-FITC/PI细胞凋亡检测试剂盒购自美国Sigma公司。兔抗人KIF3B抗体购自美国CST公司,抗人细胞周期蛋白1(Cyclin D1)、活化的Caspase-3(Cleaved-Caspase-3)抗体购自美国Santa Cruz公司, HRP标记的山羊抗兔二抗购自武汉博士德生物工程有限公司。
1.2细胞来源及培养人正常皮肤细胞株HaCaT,皮肤鳞状细胞癌细胞SCC13、A431、HSC-5购自美国ATCC细胞库,用含体积分数10%胎牛血清的DMEM完全培养基培养,于37 ℃、体积分数5%CO2条件下培养,待细胞生长融合度达到70%时进行传代培养。
1.3HaCaT、SCC13、A431和HSC-5细胞中miR-383-5p和KIF3B表达的检测
1.3.1 miR-383-5p和KIF3B mRNA的检测 采用qRT-PCR法检测细胞中miR-383-5p、KIF3B mRNA表达水平。miR-383-5p正向引物5’-AAGGTGATT GTGGCTTTGGG-3’,反向引物5’-ACGACTCA CAGCTAGCTACC-3’。KIF3B正向引物5’-TGAAATCGCCTCCACCTTCT-3’,反向引物5’-CAGGGCAGAAAAGGGAGGTA-3’。U6正向引物5’-GCTTCGGCAGCACATATACT-3’,反向引物5’-GTGCAGGGTCCGAGGTATTC-3’。β-actin正向引物5’-TGCTGTCCCTGTATGCCTCT-3’,反向引物5’-TGATGTCACGCACGATTTC-3’。引物由上海生工生物工程股份有限公司设计合成。PCR反应体系:10×Buffer 2.5 μL,MgSO42.5 μL,dNTPs 2.5 μL,正、反向引物各0.5 μL,cDNA 2 μL,用无RNase的ddH2O补足体系至25 μL。反应条件:95 ℃ 60 s;95 ℃ 60 s,56 ℃ 30 s,72 ℃ 30 s,共36次循环。miR-383-5p以U6为内参,KIF3B以β-actin为内参,采用2-ΔΔCt法计算目的mRNA相对表达量。
1.3.2 KIF3B蛋白的检测 采用Western blot法检测。收集细胞,加入适量RIPA裂解液,冰上裂解30 min,离心后提取细胞总蛋白,采用BCA法测定蛋白浓度。取蛋白样品进行SDS-PAGE,转膜,50 g/L脱脂奶粉封闭2 h,加一抗稀释液(1∶1 000)4 ℃孵育过夜,TBST洗涤,加二抗稀释液(1∶2 000)室温条件下孵育1 h,暗室内曝光显影。应用凝胶成像分析系统及Image J分析条带灰度值。以目的条带与内参β-actin条带灰度值的比值表示目的蛋白的表达水平。
1.4SCC13细胞的转染取对数生长期的SCC13细胞,2.5 g/L胰蛋白酶消化,制备细胞悬液,调整细胞密度为1×104个/mL,接种于6孔板(200 μL/孔),待细胞生长融合度达到70%时更换培养基为Opti-MEM减血清培养基。按照lipofectamine2000说明书分别将miR-NC、miR-383-5p mimics、anti-miR-NC、anti-miR-383-5p、si-KIF3B、miR-383-5p mimics+pcDNA-NC、miR-383-5p mimics+pcDNA-KIF3B转染至SCC13细胞中。转染6 h后更换为含体积分数10%胎牛血清的DMEM完全培养基继续培养48 h。收集对数期细胞进行后续研究。
1.5miR-383-5p与KIF3B靶向关系的预测和验证采用Starbase预测miR-383-5p与KIF3B的靶向关系,并应用双荧光素酶报告实验验证。分别将含有结合位点与突变位点的KIF3B-3’UTR插入荧光素酶报告基因载体,构建载体WT-KIF3B与MUT-KIF3B。利用lipofectamine2000转染试剂分别将WT-KIF3B或MUT-KIF3B与miR-NC或miR-383-5p mimics共转染至SCC13细胞,转染48 h后检测细胞中荧光素酶活性。
1.6过表达miR-383-5p的SCC13细胞增殖、克隆形成和凋亡能力的变化
1.6.1 实验分组 收集miR-383-5p组、miR-NC组细胞,qRT-PCR法检测细胞中miR-383-5p的表达,方法同1.3.1。以未转染细胞作为空白对照。
1.6.2 细胞增殖率的检测 取3组细胞接种至96孔板,每组3个复孔,用含体积分数10%胎牛血清的DMEM完全培养基培养48 h后,每孔加入MTT溶液20 μL,继续培养4 h,弃上清,每孔加入150 μL DMSO,室温避光振荡孵育10 min,应用酶标仪检测490 nm处的吸光度值。细胞增殖率=实验组吸光度/空白孔吸光度×100%。实验重复3次。
1.6.3 平板克隆形成实验 将3组细胞接种于48孔板(100 μL/孔),每组3个复孔,培养36 h后收集细胞,PBS洗涤,加入含体积分数10%胎牛血清且不含抗生素的培养液。调整细胞密度为3×104个/mL,接种于12孔板(100个/孔),置于37 ℃培养箱培养,每3 d更换一次培养液,共培养2周。计数肉眼可见的克隆数。
1.6.4 细胞凋亡率的检测 收集3组细胞,1 000 r/min离心6 min,预冷PBS洗涤,加入500 μL结合缓冲液重悬细胞,加入5 μL Annexin V-FITC与5 μL PI,室温振荡孵育10 min,上流式细胞仪检测,应用Cellauest软件计算细胞凋亡率。
1.6.5 Cyclin D1、Cleaved-Caspase-3蛋白的检测 采用Western blot法检测,方法同前。
1.7抑制KIF3B表达后SCC13细胞增殖、克隆形成和凋亡能力的变化收集未转染组、si-KIF3B组细胞,Western blot法检测KIF3B、Cyclin D1、Cleaved-Caspase-3蛋白的表达;按1.6方法检测细胞增殖率、克隆形成能力和凋亡率。
1.8过表达KIF3B和miR-383-5p后SCC13细胞增殖、克隆形成和凋亡能力的变化收集miR-383-5p+pcDNA-NC组、miR-383-5p+pcDNA-KIF3B组细胞,Western blot法检测KIF3B、Cyclin D1、Cleaved-Caspase-3蛋白的表达;按1.6方法检测细胞增殖率、克隆形成能力和凋亡率。
1.9统计学处理采用SPSS21.0分析数据。多组细胞中miR-383-5p和KIF3B表达水平,细胞增殖、克隆形成和凋亡能力,Cyclin D1和Cleaved-Caspase-3蛋白表达水平的比较采用单因素方差分析和SNK-q检验,或两独立样本的t检验;荧光素酶活性的比较采用两独立样本的t检验;检验水准α=0.05。
2 结果
2.1 4种皮肤细胞中miR-383-5p和KIF3B 表达的比较见图1、表1。与HaCaT细胞相比,SCC13、A431、HSC-5中miR-383-5p表达水平降低,KIF3B mRNA及蛋白表达水平升高(P<0.05)。SCC13细胞中miR-383-5p的表达水平最低,因而选用SCC13进行后续研究。
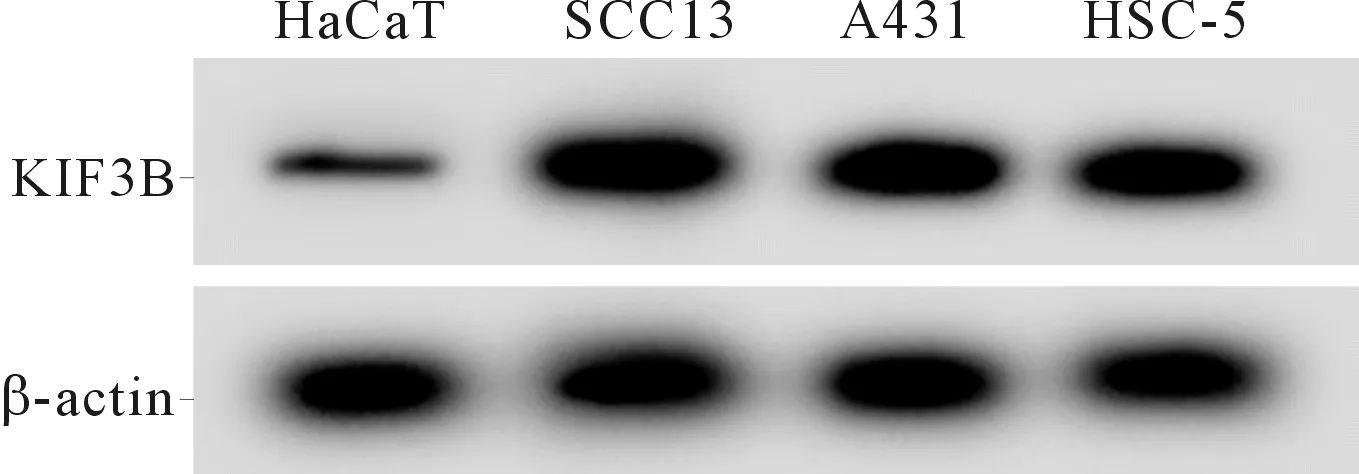
图1 4种细胞中KIF3B蛋白的表达
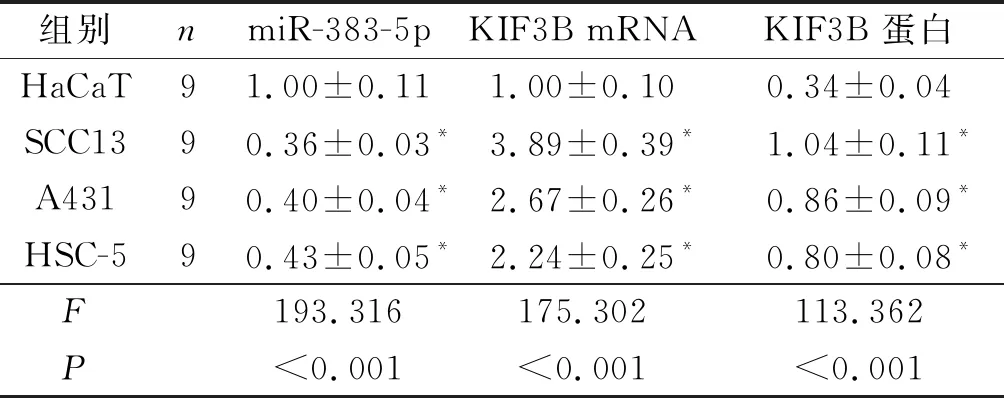
表1 4种细胞中miR-383-5p和KIF3B 表达的比较
*:与HaCaT比较,P<0.05
2.2miR-383-5p与KIF3B靶向关系的验证Starbase预测结果显示miR-383-5p与KIF3B存在结合位点,见图2。双荧光素酶报告实验结果(表2)显示, WT-KIF3B和miR-383-5p共转染组细胞荧光素酶活性低于WT-KIF3B和miR-NC共转染组(P<0.05); MUT-KIF3B和miR-383-5p共转染组与MUT-KIF3B和miR-NC共转染组相比差异无统计学意义(P>0.05)。
2.3过表达miR-383-5p对SCC13细胞增殖、克隆形成能力和凋亡的影响指标检测结果见表3。与未转染组和miR-NC组相比,miR-383-5p组细胞增殖率和克隆形成数降低,细胞凋亡率升高,Cyclin D1表达水平降低,Cleaved-Caspase-3表达水平升高(P<0.05)。

图2 miR-383-5p与KIF3B 结合位点示意图

表2 双荧光素酶报告实验结果(n=9)
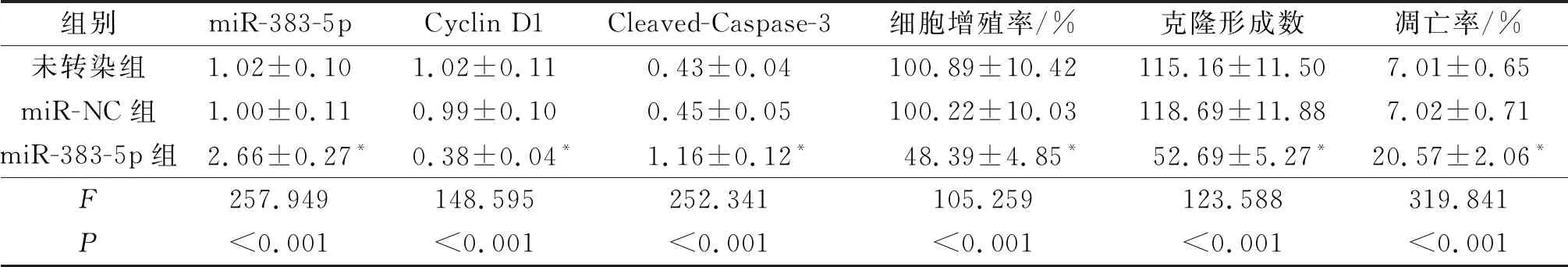
表3 未转染组、miR-NC和miR-383-5p组细胞增殖、克隆形成和凋亡检测结果(n=9)
*:与空白组和miR-NC组比较,P<0.05
2.4抑制KIF3B对SCC13细胞增殖、克隆形成能力和凋亡的影响指标检测结果见表4。与未转染组相比,si-KIF3B组细胞增殖率、克隆形成数降低,细胞凋亡率升高,Cyclin D1蛋白表达水平降低,Cleaved-Caspase-3蛋白表达水平升高(P<0.05)。
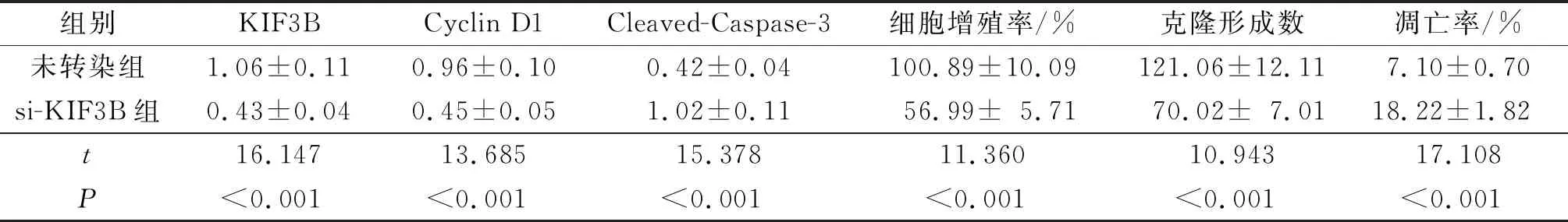
表4 未转染组、si-KIF3B组细胞增殖、克隆形成和凋亡检测结果(n=9)
2.5过表达KIF3B和miR-383-5p对SCC13细胞增殖、克隆形成能力和凋亡的影响指标检测结果见表5。与miR-383-5p+pcDNA-NC组比较,miR-383-5p+pcDNA-KIF3B 细胞增殖率、克隆形成数、Cyclin D1蛋白表达水平增加,细胞凋亡率、Cleaved-Caspase-3蛋白表达水平降低(P<0.05)。

表5 miR-383-5p+pcDNA-NC组和miR-383-5p+pcDNA-KIF3B组细胞增殖、克隆形成和凋亡检测结果(n=9)
3 讨论
研究[10]表明miR-383-5p在胃癌细胞中表达下调,其低表达可促进胃癌细胞的增殖及迁移。miR-383-5p表达降低还可通过靶向MAL2促进口腔鳞状细胞癌的发展[11]。miR-383-5p过表达可通过靶向TRIM27抑制卵巢癌细胞的增殖[12]。本研究通过荧光素酶报告实验证实KIF3B与miR-383-5p存在靶向关系。KIF3B在胰腺癌、肝细胞癌、前列腺癌中表达上调,抑制KIF3B表达可抑制肿瘤细胞的增殖及转移[13-15]。
Cyclin D1可正向调控细胞周期,促进细胞周期由G1期进入S期,促进细胞增殖[16]。Caspase-3在细胞凋亡过程中发挥重要调控作用,其级联反应被激活后,Cleaved-Caspase-3表达升高,反映细胞凋亡增加[17]。本研究发现,皮肤鳞状细胞癌细胞中miR-383-5p表达下调,KIF3B表达上调;miR-383-5p过表达后皮肤鳞状细胞癌SCC13细胞增殖率和克隆形成能力降低,凋亡率增加,同时Cyclin D1表达降低,Cleaved-Caspase-3表达增强;抑制KIF3B表达后SCC13细胞增殖能力减弱,细胞凋亡率升高,Cyclin D1表达降低,Cleaved-Caspase-3表达升高;进一步分析显示KIF3B过表达可逆转miR-383-5p过表达对SCC13细胞增殖、克隆形成及凋亡的影响。本研究结果提示,miR-383-5p在皮肤鳞状细胞癌中可能发挥抑癌基因的作用,而KIF3B可能发挥癌基因作用,miR-383-5p可能通过靶向KIF3B,下调Cyclin D1表达,从而诱导SCC13细胞凋亡,抑制其增殖。
综上所述,皮肤鳞状细胞癌细胞中miR-383-5p表达下调,KIF3B表达上调,miR-383-5p可靶向干扰KIF3B表达,发挥抗皮肤鳞状细胞癌增殖的作用,miR-383-5p可能成为皮肤鳞状细胞癌靶向治疗的潜在靶点。

