LncRNA CASC2与miR-155-5p的靶向关系及对子宫内膜癌细胞迁移、侵袭能力的影响
冯双苗,杨贺佳,袁银花,张化莲
1)驻马店市中心医院产科 河南驻马店 463000 2)郑州大学第三附属医院产科 郑州 450052
近来,子宫内膜癌(endometrial cancer)的发病率呈上升趋势,发病年龄有所下降[1-3]。长链非编码RNA(long-chain non-coding RNA,LncRNA)覆盖了人类DNA的大部分非编码信息,占整个基因组的90%以上,是由200多个核苷酸组成的广泛而复杂的分子群,其无完整的开放阅读框。LncRNA以多种方式参与癌症的病理过程,在调控基因表达、转录和翻译后处理方面的作用已经在多种癌症中得到证实[4-6]。癌易感性候选基因2(cancer susceptibility candidate 2,CASC2)是一种LncRNA,在部分癌症中表现为表达水平异常降低,具有抑癌作用,包括子宫内膜癌[7-9]。生物信息学分析结果提示CASC2与miR-155-5p可能存在靶向关系。本研究旨在探讨CASC2对子宫内膜癌细胞迁移、侵袭的调控机制。
1 材料与方法
1.1细胞、主要试剂和仪器人正常子宫内膜上皮细胞hEEC,人子宫内膜癌细胞HEC-1A、KLE、HHUA均购自ATCC,用含体积分数10%胎牛血清的DMEM培养基在37 ℃、体积分数5%CO2培养箱中常规培养。DMEM培养基购自Gibco公司,胎牛血清购自杭州四季青公司,胰蛋白酶购自Sellect公司,lipofectamine2000购自Invitrogen公司,反转录试剂盒购自大连TaKaRa公司,双荧光素酶报告实验试剂盒购自Promega公司,Matrigel基质胶购自BD公司,Transwell小室购自Corning公司。基质金属蛋白酶(MMP)-2、MMP-9多克隆抗体均购自武汉博士德生物技术有限公司,辣根过氧化物酶标记的二抗购自Santa Cruz公司,GAPDH小鼠单克隆抗体购自Abcam公司。pcDNA3.1购自Addgene公司。实验中所涉及的质粒序列及引物的设计、合成均由上海吉玛生物公司完成。
1.2 4种子宫内膜细胞中CASC2、miR-155-5p表达的检测采用qRT-PCR法检测。分别收集hEEC、HEC-1A、KLE、HHUA细胞,用RNA抽提试剂盒提取细胞总RNA,然后用反转录试剂盒快速合成cDNA。按PCR试剂盒说明书操作,进行PCR扩增,检测CASC2、miR-155-5p。以U6作为内参,用2-ΔΔCt法计算CASC2、miR-155-5p的相对表达水平。CASC2上游引物序列5’-GCTGATCAGAGCACATT GGA-3’,下游5’-ATAAAGGTGGCCACAACTGC-3’。miR-155-5p上游引物序列5’-GGGGTTAATGCTA ATCGTGA-3’,下游5’-CAGTGCGTGTCGTGGAGT-3’。U6上游引物序列5’-CTCGCTTCGGCAGCACA-3’ ,下游5’-AACGCTTCACGAATTTGCGT-3’。
1.3CASC2与miR-155-5p靶向关系的验证利用在线靶基因预测工具TargetScan(http://www.targetscan.org/ )预测发现CASC2与miR-155-5p存在结合位点。利用双荧光素酶报告实验验证两者的靶向关系。含、不含结合位点的CASC2序列片段(CASC2-WT、CASC2-MUT)由上海吉玛生物公司设计合成,将其克隆至荧光载体psiCHECK2,构建荧光素酶报告基因载体。采用lipofectamine2000将CASC2-WT或CASC2-MUT与miR-NC或miR-155-5p mimics共转染入HEC-1A细胞中,24 h后按双荧光素酶报告实验试剂盒说明书操作,检测萤火虫荧光素酶、海肾荧光素酶的荧光活性,以两者的比值表示CASC2与miR-155-5p的结合力。
1.4过表达CASC2对HEC-1A细胞迁移能力及MMP-2、MMP-9蛋白表达的影响
1.4.1 实验分组 将对数生长期的HEC-1A细胞分为3组。未转染组细胞常规培养,余2组细胞分别转染空质粒pcDNA3.1和pcDNA3.1-CASC2。用lipofectamine2000试剂转染。
1.4.2 细胞中CASC2表达的检测 转染48 h后,qRT-PCR法检测细胞中CASC2的表达,方法同1.2。
1.4.3 细胞中MMP-2、MMP-9蛋白表达的检测 采用Western blot法。转染48 h后收集细胞,用蛋白裂解液充分裂解,提取总蛋白,定量后用沸水浴法进行变性处理。取变性蛋白上样电泳,电泳结束后用转膜仪将蛋白转移到PVDF膜上,用脱脂奶粉封闭处理,将膜转移到一抗溶液(MMP-2、MMP-9一抗稀释度1∶1 500)中,于4 ℃冰箱中孵育过夜,转膜至二抗溶液(稀释度1∶1 000)中,室温下孵育2 h。用ECL试剂盒显影,曝光。用Image J分析,以目的条带与内参GAPDH条带灰度值的比值表示目的蛋白的表达水平。
1.4.4 细胞迁移、侵袭能力的检测 采用Transwell小室实验。用无基质胶的Transwell小室检测细胞迁移能力。用有基质胶的Transwell小室检测细胞侵袭能力:将Matrigel胶在4 ℃冰箱中过夜融化,然后按1∶3的比例与无血清培养基混匀,取30~50 μL平铺于聚碳酸酯膜表面(以浸湿膜为准,不宜过多),然后将小室于37 ℃放置30 min。收集细胞,调整细胞密度并接种至6孔板,每孔106个,常规培养至汇合度约70%,更换培养基为无血清培养基过夜培养。次日,取200 μL加入小室的聚碳酸酯膜上,将600 μL含血清培养基加入下室,过夜培养。取出小室,用棉签擦去附着在下室的细胞,用PBS洗涤3次,甲醇固定30 min,结晶紫染色20 min,PBS洗涤2次。于400倍镜下观察,选取3个视野拍照计数细胞数,取平均值。
1.5抑制miR-155-5p对HEC-1A细胞迁移、侵袭能力及MMP-2、MMP-9蛋白表达的影响将对数生长期的HEC-1A细胞分为3组。未转染组细胞常规培养,余2组细胞分别转染anti-miR-NC和anti-miR-155-5p。48 h后,检测细胞中miR-155-5p和MMP-2、MMP-9蛋白的表达,Transwell小室法检测细胞的迁移和侵袭能力,方法同前。
1.6过表达miR-155-5p和CASC2对HEC-1A细胞迁移、侵袭能力及MMP-2、MMP-9蛋白表达的影响将对数生长期的HEC-1A细胞分为3组,分别转染pcDNA3.1、pcDNA3.1-CASC2+miR-NC、pcDNA3.1-CASC2+miR-155-5p。48 h后检测细胞中CASC2、miR-155-5p和MMP-2、MMP-9蛋白的表达,Transwell小室法检测细胞的迁移和侵袭能力,方法同前。
1.7统计学处理采用SPSS 21.0进行数据分析。多组细胞中CASC2、miR-155-5p表达,细胞迁移、侵袭能力及MMP-2、MMP-9蛋白表达水平的比较采用单因素方差分析和SNK-q检验,荧光素酶活性的比较采用两独立样本的t检验,检验水准α=0.05。
2 结果
2.1 4种子宫内膜细胞中CASC2、miR-155-5p的表达见表1。与hEEC细胞相比,HEC-1A、KLE、HHUA组胞中CASC2表达降低,miR-155-5p表达升高(P<0.05)。
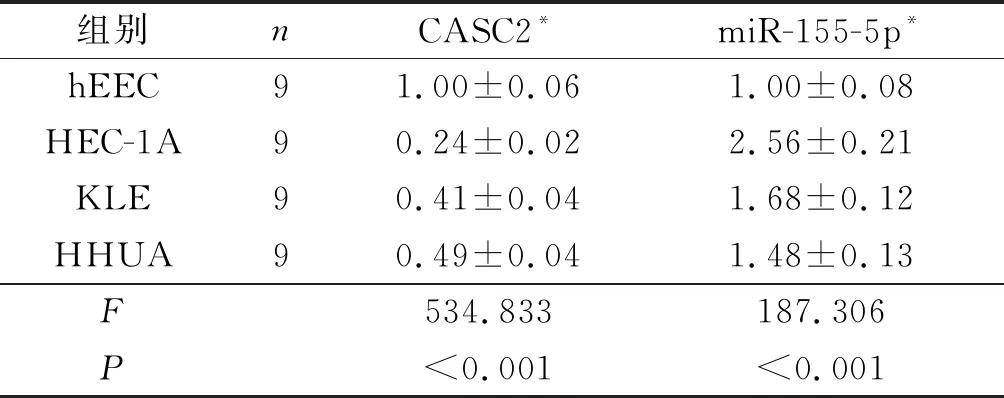
表1 4种子宫内膜细胞中CASC2、miR-155-5p的表达
*:组间两两比较,P均<0.05
2.2CASC2与miR-155-5p靶向关系的验证TargetScan预测结果显示,miR-155-5p与CASC2之间存在10个互补的结合位点(图1)。双荧光素酶报告实验结果显示,共转染miR-155-5p和CASC2-WT的细胞荧光素酶活性较miR-NC和CASC2-WT共转染细胞降低(表2)。
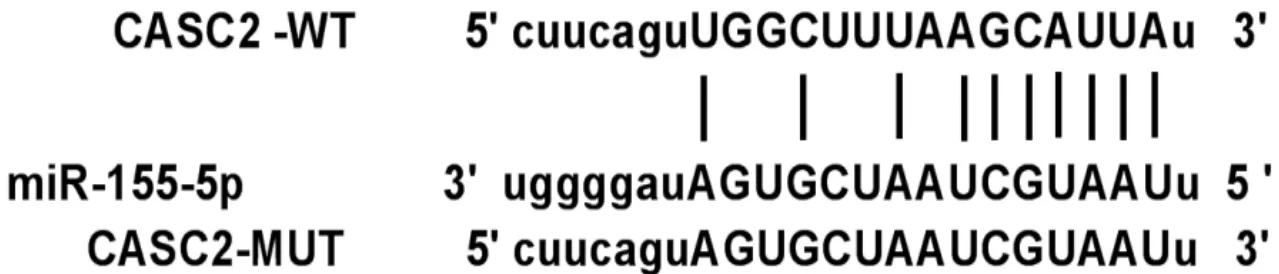
图1 CASC2与miR-155-5p的靶向结合位点
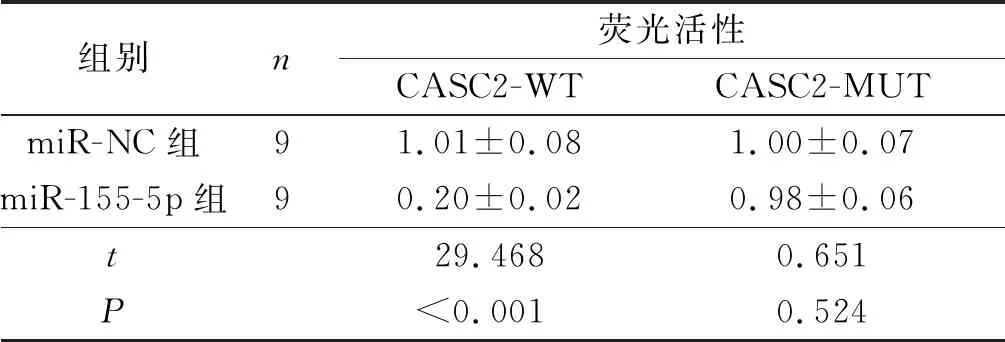
表2 双荧光素酶报告实验结果
2.3过表达CASC2的HEC-1A细胞迁移、侵袭能力及MMP-2、MMP-9蛋白表达的变化结果见图2和表3。与未转染组和pcDNA3.1组相比,pcDNA3.1-CASC2组CASC2表达水平升高,迁移细胞数和侵袭细胞数均降低,MMP-2、MMP-9蛋白表达亦降低(P<0.05)。
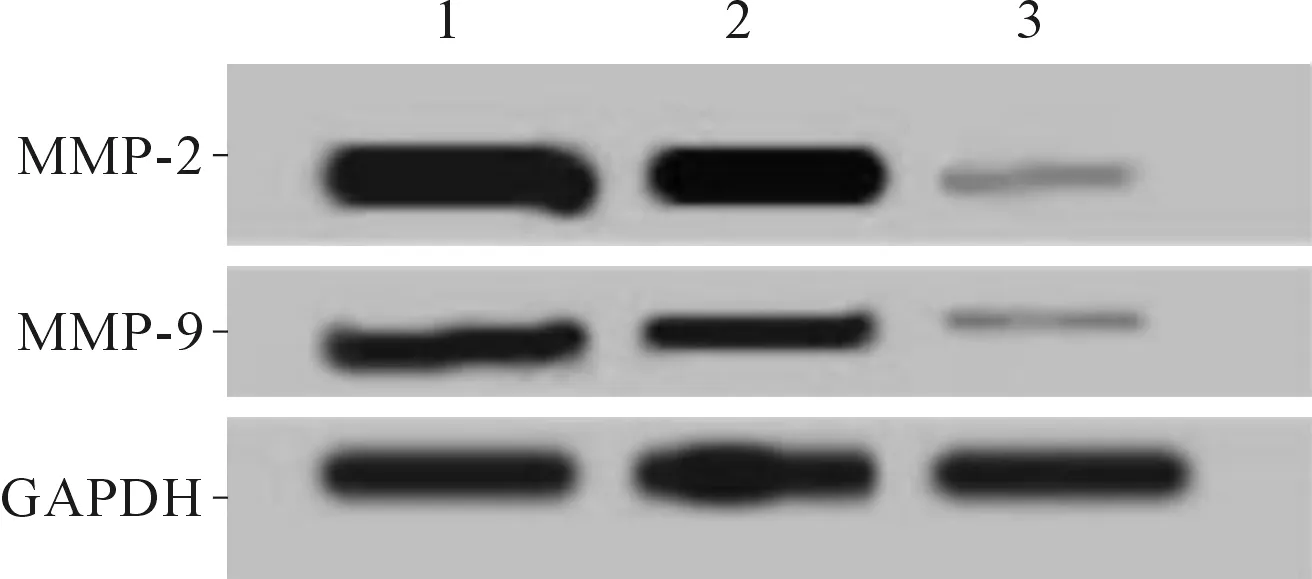
1:未转染组:2:pcDNA3.1组;3:pcDNA3.1-CASC2组
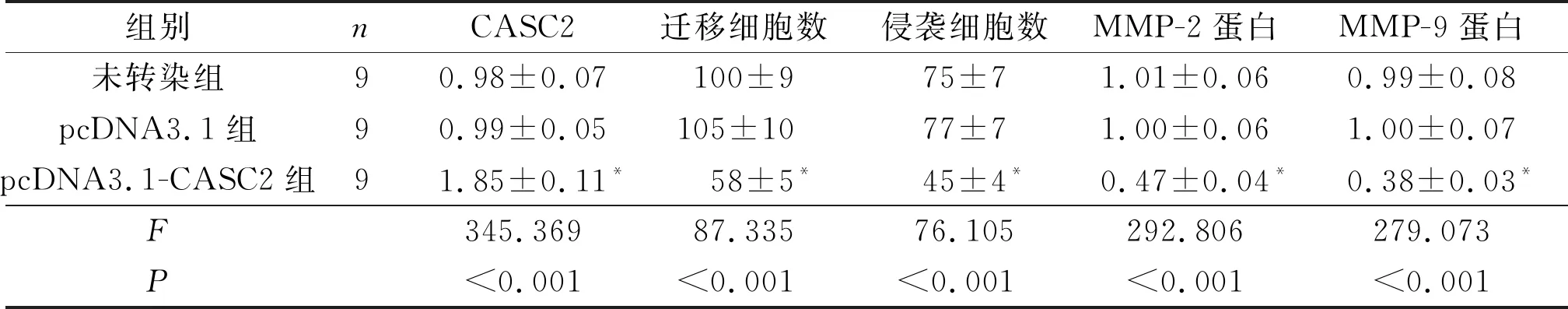
表3 3组迁移细胞数、侵袭细胞数,细胞中CASC2和 MMP-2、MMP-9蛋白表达水平的比较
*:与未转染组和pcDNA3.1组比较,P<0.05
2.4抑制miR-155-5p后HEC-1A细胞迁移、侵袭能力及MMP-2、MMP-9蛋白表达的变化结果见图3和表4。与未转染组和anti-miR-NC组相比,anti-miR-155-5p组细胞中miR-155-5p表达降低,迁移细胞数和侵袭细胞数均降低,MMP-2、MMP-9蛋白表达亦降低(P<0.05)。
2.5过表达miR-155-5p和CASC2后HEC-1A细胞迁移、侵袭能力及MMP-2、MMP-9蛋白表达的变化结果见图4和表5。与pcDNA3.1-CASC2和pcDNA3.1-CASC2+miR-NC组相比,pcDNA3.1-CASC2+miR-155-5p组细胞中CASC2表达降低,miR-155-5p表达升高,迁移细胞数和侵袭细胞数均升高,MMP-2、MMP-9蛋白表达水平亦升高(P<0.05)。
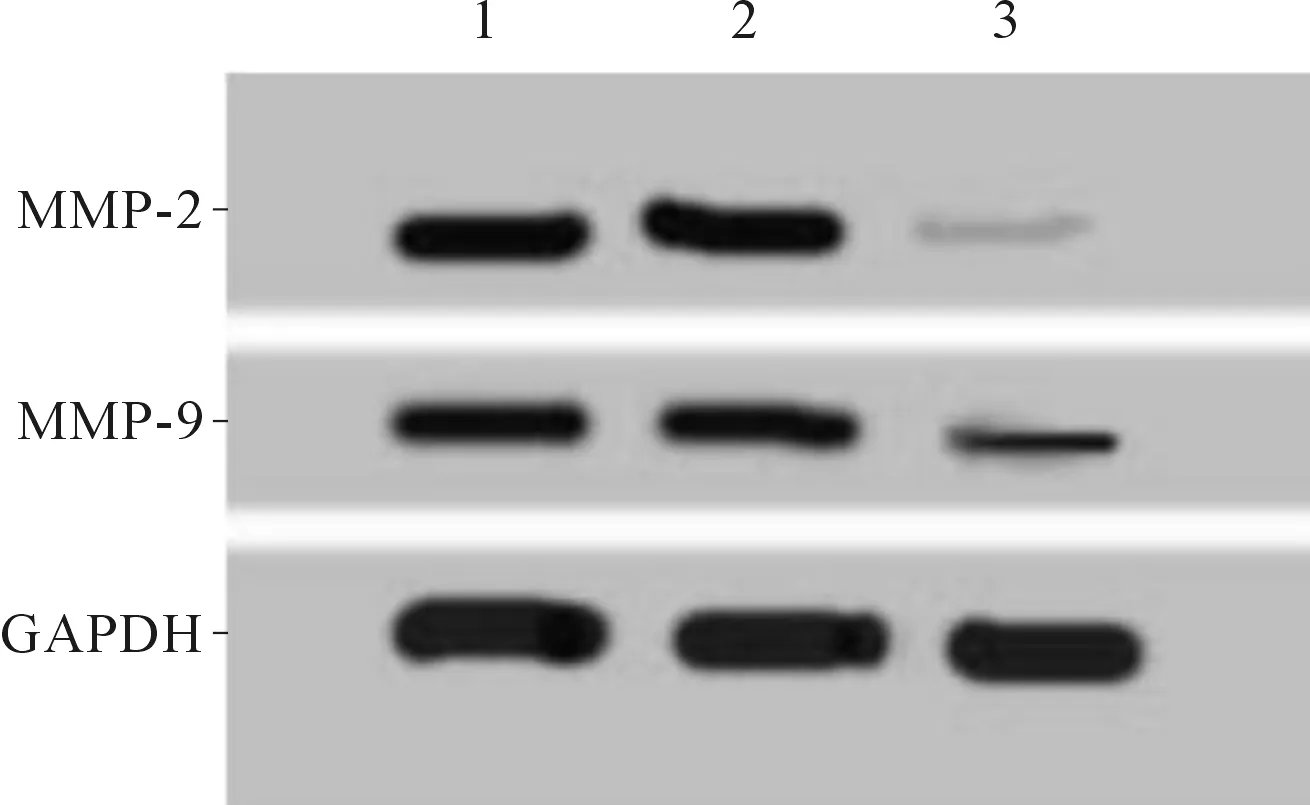
1:未转染组;2:anti-miR-NC组;3:anti-miR-155-5p组
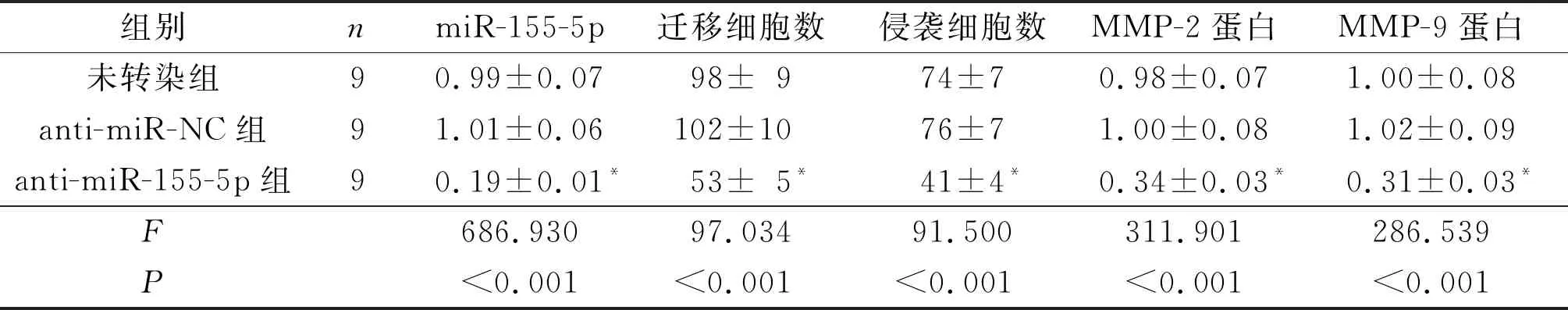
表4 3组迁移细胞数、侵袭细胞数,细胞中miR-155-5p和 MMP-2、MMP-9蛋白表达水平的比较
*:与未转染组和anti-miR-NC组比较,P<0.05
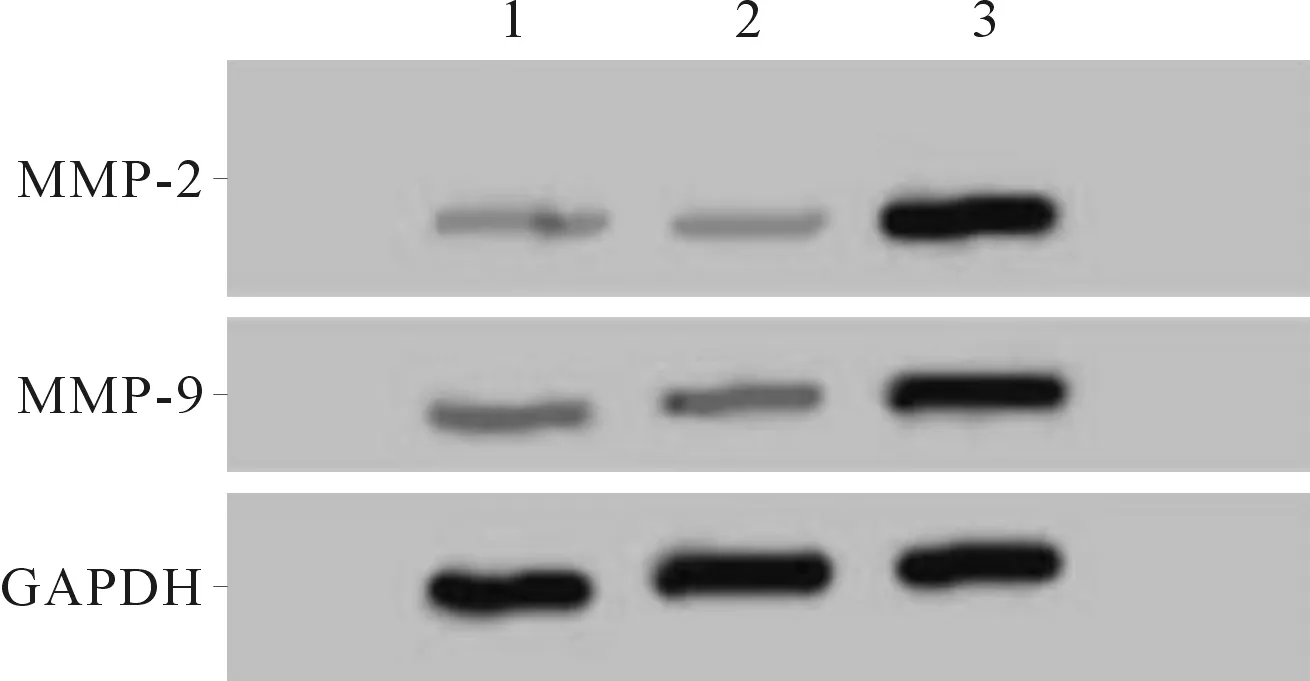
1:pcDNA3.1-CASC2组;2:pcDNA3.1-CASC2+miR-NC组;3:pcDNA3.1-CASC2+miR-155-5p组
图4 3组细胞中MMP-2、MMP-9蛋白的表达
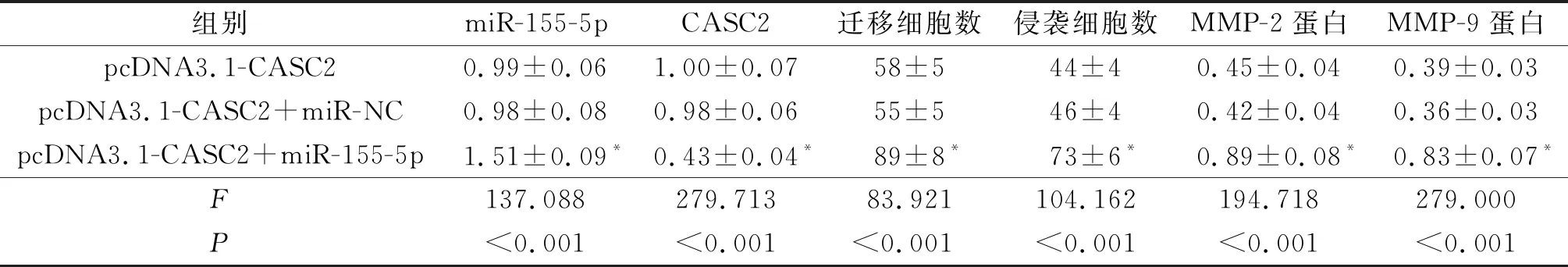
表5 3组细胞迁移、侵袭细胞数及细胞中CASC2、miR-155-5p和MMP-2、MMP-9蛋白表达的变化
*:与pcDNA3.1-CASC2组和pcDNA3.1-CASC2+miR-NC组比较,P<0.05
3 讨论
癌组织中LncRNA与miRNA之间的关系多为LncRNA靶向调控下游的miRNA的表达[10-11]。miRNA通过抑制下游靶基因的转录或翻译,或者受上游调控因子的作用,在癌症的发生发展过程中发挥重要作用[12-13],其中包括子宫内膜癌[14]。多项研究结果[7-9]表明LncRNA CASC2在子宫内膜癌组织中表达下调。我们应用生物信息学分析发现CASC2与miR-155-5p存在结合位点,经双荧光素酶报告实验证实两者存在靶向关系。已有研究[15-17]证实,子宫内膜癌患者血清和组织中miR-155表达均异常升高,且与癌症的分期、肿瘤大小、转移及预后相关。Banno等[18]通过分析子宫内膜癌组织差异miRNA表达谱发现,miR-155-5p为其中表达异常升高的miRNA之一。本实验结果也显示,子宫内膜癌细胞中CASC2表达下调,miR-155-5p表达上调。
细胞迁移和侵袭是肿瘤细胞的特征,体内肿瘤细胞的侵袭和迁移能力与细胞外基质(extracellular matrix,ECM)成分降解和上皮-间质转化(epithelial-mesenchymal transition,EMT)有关[19]。MMP-2、MMP-9是基质金属蛋白酶家族的重要组成部分,它们可以水解ECM,可促使细胞转移[20]。本研究结果显示,过表达CASC2和抑制miR-155-5p均可下调子宫内膜癌细胞中MMP-2、MMP-9的表达,降低癌细胞的迁移和侵袭能力;而过表达miR-155-5p可逆转CASC2对子宫内膜癌细胞迁移、侵袭的抑制作用。推测CASC2可能通过靶向负调节miR-155-5p的表达,参与调控子宫内膜癌细胞的迁移和侵袭。本研究为体外实验,下一步将在动物体内进一步验证上述结果。
综上所述,CASC2可抑制子宫内膜癌细胞的迁移、侵袭能力,其机制与靶向负调节miR-155-5p表达有关,这为子宫内膜癌的诊断、治疗提供了参考。

