盆底器官脱垂疾病mRNA和lncRNA差异表达谱的综合分析
张志磊, 赵 冰, 刘 灵,王君敏, 李林玉, 梁 肖, 王莹莹, 王肖帆, 乔艳华
1)郑州大学第三附属医院妇科 郑州 450052 2)郑州大学基础医学院人体解剖学教研室 郑州 450001 3)新乡医学院三全学院科研部 河南新乡 453000
盆底器官脱垂(pelvic organ prolapse,POP)是绝经后子宫切除的重要原因,中老年女性发病率较高,给患者的心理和生理带来了巨大的伤害[1-2]。研究[3]显示,POP是具有特定遗传倾向的个体在单个或多个获得性因素的作用下导致的盆底支持组织退化、损伤而引发的一种退行性疾病。子宫旁韧带群中胶原合成与分解的失衡、老化后的补充以及损伤后的修复障碍会破坏盆腔器官的支持结构[4]。经典Wnt信号通路的异常可影响子宫骶韧带成纤维细胞增殖和功能[5]。阴道分娩、年龄、BMI和绝经状态是普遍认同的POP影响因素[6-8]。但POP也可见于一些年轻未育女性,甚至是处女;绝大多数有过阴道分娩史甚至多产的妇女并不发生POP。POP的发病可能与基因水平的改变有关。本研究通过对POP患者子宫主韧带中mRNA和lncRNA进行高通量基因测序,Gene Ontology(GO)富集、KEGG信号通路分析、蛋白互作网络(protein-protein interaction,PPI)及mRNA-lncRNA共表达网络分析,探索与POP发生发展有关的潜在生物标志物和信号通路。
1 对象与方法
1.1研究对象选择2017年10月至2018年12月在郑州大学第三附属医院接受阴式子宫切除手术的POP患者6例和同期因良性病变(子宫腺肌症或子宫肌瘤)行子宫切除手术的非POP患者6例(对照组)。两组患者满足:年龄50~60岁,入院时已绝经,孕产次3~4次,且均为足月产,胎儿非巨大儿、无异常产褥病史,无高血压和糖尿病史,无性激素类药物应用史,术中无电刀等能量器械应用,且术后病理证实均不合并恶性病变。POP组患者POP-Q分级均Ⅲ度以上。对照组患者均不合并POP。本研究已获得患者本人知情同意并经郑州大学第三附属医院伦理委员会批准。
1.2标本处理术中在无菌操作下留取患者子宫主韧带(宫旁1 cm处)新鲜组织,0.5~1.0 cm3切块,两组各取3例标本立即置液氮中保存以备高通量测序,另3例标本放入体积分数10%甲醛中固定以制备HE染色和Masson染色切片,以及进行qRT-PCR和Western blot。
1.3RNA的提取、测序、差异基因的筛选及富集分析由上海欧易生物医学科技有限公司完成。使用mirVana miRNA分离试剂盒进行RNA提取,在Illumina测序平台(HiSeqTM2500)上进行测序,使用Express软件进行转录本定量,采用Fold Change(FC)值来衡量差异基因表达量的差异倍数,利用R包在P≤0.05、|log2FC|≥2条件下,筛选差异基因并进行GO及KEGG富集分析。
1.4PPI分析STRING(https://string-db.org/cgi)是提供有关蛋白质之间相互作用综合信息的数据库,基于网站默认confidence≥0.4,对满足|log2FC|≥5、容错率(FDR)≤0.05的差异表达基因建立PPI。然后导入Cytoscape软件可视化蛋白质间相互作用。
1.5mRNA-lncRNA共表达网络分析对差异表达mRNA和lncRNA的表达量进行Pearson相关分析,用R包根据Pearson相关系数>0.8和P<0.05 的阈值产生节点(node)和关系线(edge)数据,最后采用Cytosacape软件建立共表达网络图。
1.6采用qRT-PCR进行转录水平验证使用Trizol试剂从主韧带组织中提取总RNA,反转录合成cDNA,使用PCR试剂盒和实时PCR仪器进行qRT-PCR分析。反应体系:1 μL cDNA、5 μL 2×PCR Master Mix、0.2 μL上游引物、0.2 μL下游引物(引物序列见表1)和3.6 μL无核酸酶水。引物由上海生物医学科技有限公司设计合成。反应条件: 95 ℃预变性10 min;94 °C变性10 min,58 ℃退火20 s, 72 ℃延伸30 s,共35个循环。以ACTB基因作为内参,采用2-ΔΔCt方法计算基因的相对表达量。
1.7采用Western blot进行蛋白水平验证使用裂解缓冲液从组织中提取总蛋白,用BCA试剂盒测
定蛋白浓度,然后用SDS-PAGE分离蛋白2 h,转移到PVDF膜上,再用含50 g/L脱脂奶粉的TBST在37 ℃下浸泡封闭2 h。将兔抗人IL-6抗体(按1∶500稀释),兔抗人Nurr1抗体(按1∶500稀释)和兔抗人β-actin抗体(按1∶1 000稀释)添加到膜上,4 ℃孵育过夜。洗涤3次,加入山羊抗兔IgG二抗(按1∶1 000稀释)37 ℃摇床孵育2 h,用ECL发光试剂盒检测。以β-actin作为内参蛋白,采用Image J 1.8.0软件分析。以目的蛋白与内参蛋白条带灰度值的比值作为目的蛋白的相对表达水平。

表1 引物序列
1.8统计学处理采用Graphpad Prism 7分析数据及制作图表,组间差异基因表达量的差异倍数用FC值表示。检验水准α=0.05。
2 结果
2.1子宫主韧带组织的形态学分析对照组子宫主韧带组织中平滑肌束及胶原纤维束密集,排列整齐有序,且平滑肌细胞及成纤维细胞数量较多;而POP组子宫主韧带组织中胶原纤维束和平滑肌束走向紊乱,且较纤细,多断裂并伴玻璃样变性(图1)。
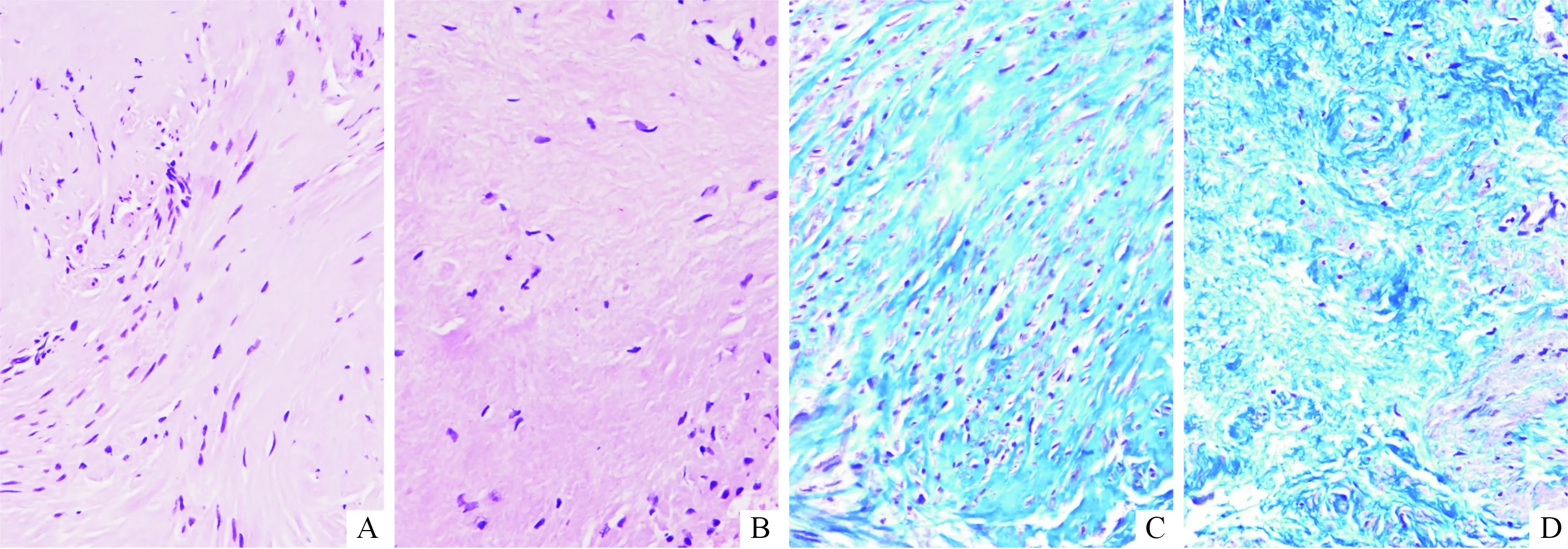
A和C:对照组;B和D:POP组
2.2差异表达mRNA和lncRNA的筛选得到差异表达的mRNA 794个(上调403个、下调391个),lncRNA 1 106个(上调584个、下调522个)。差异基因表达水平聚类分析见图2。
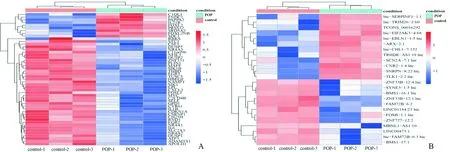
A:mRNA;B:lncRNA;红色:表达量升高;蓝色:表达量降低
2.3差异表达mRNA和lncRNA的富集分析
2.3.1 GO富集分析 GO富集分析结果显示:差异表达的mRNA在1 863个GO条目中富集。从富集TOP30条目(图3)可见,生物过程主要富集于核小体组装(GO:0006334)和染色质组织(GO:0006325)等,分子功能主要富集蛋白质异二聚化活性(GO:0046982)和DNA聚合(GO:0003677)等,细胞成分主要定位于核小体(GO:0000786)和核染色质(GO:0000790)等。使用TopGO软件对富集条目绘制有向无环图,结果显示这些差异基因的功能通路最终指向核小体及染色质的组装,所涉及的基因有36个是组蛋白相关基因,其中有16个满足FC>10,差异最显著的是HIST1H3J(FC=18.47,P=0.003)。而差异表达的lncRNA则在881个GO条目中富集,在L-α-氨基酸跨膜转运(GO:1902475)和中性氨基酸跨膜转运蛋白活性(GO:0015175)这两个条目富集最为显著。
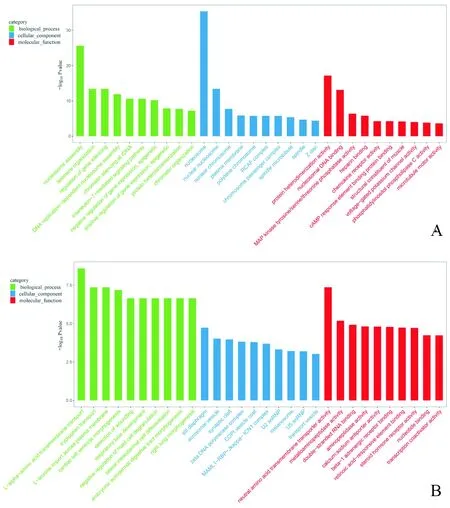
A:mRNA;B:lncRNA
2.3.2 KEGG富集分析 KEGG富集分析结果显示:差异表达mRNA在77个KEGG通路中富集,在一级通路中主要富集于感染性、免疫性、内分泌和代谢疾病通路中。从TOP20富集通路(图4)可见,系统性红斑狼疮(has:05322)、Wnt信号通路(has:04310)和人T淋巴细胞病毒感染通路(has:05166)富集显著。其中在Wnt通路中,主要富集于Wnt/β-Catenin通路。差异lncRNA则在51个KEGG通路中富集,主要涉及信号转导、感染性疾病、免疫系统疾病等通路,这一分布和mRNA的富集情况一致。
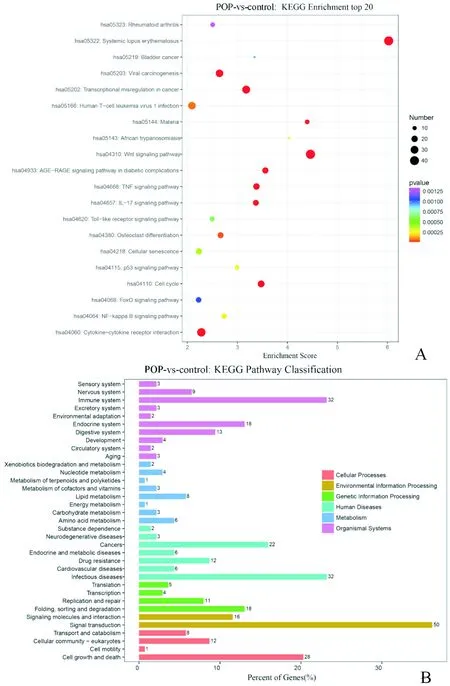
A:mRNA的TOP20气泡图;B:lncRNA的富集通路分类图
2.4PPI分析绘制的PPI包括152个节点和2 475个相互作用(图5)。整个网络由3个功能模块组成:A模块主要和转录调控基因有关,B模块主要和组蛋白基因有关,C模块主要和细胞周期调节基因有关。其中有数十个基因节点的连接度很高,连接度TOP10的核心基因见表2,连接最广泛的是IL-6。
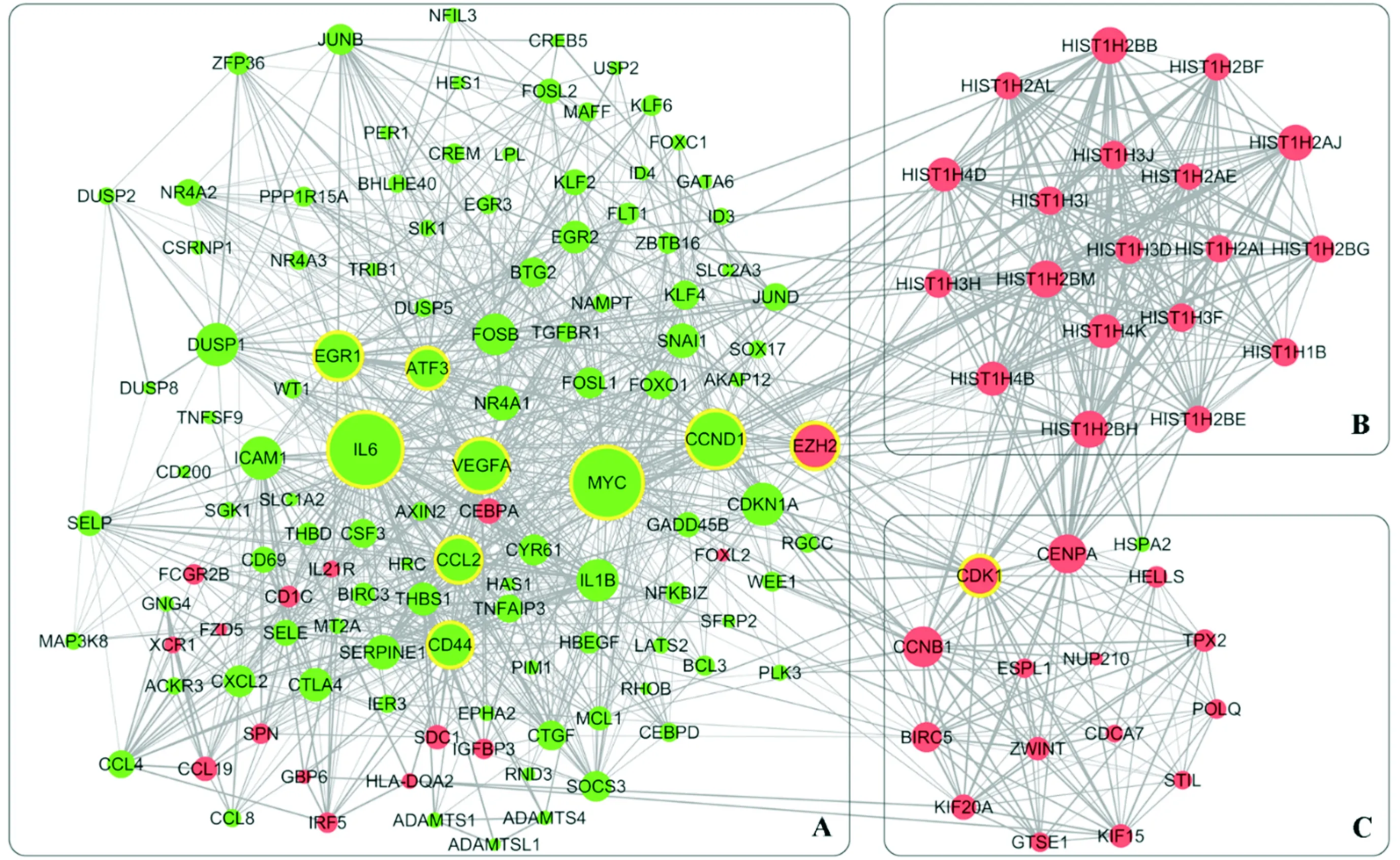
A:转录调控基因;B:组蛋白基因;C:细胞周期调节基因;节点大小和连接度有关;红色表示上调基因,绿色表示下调基因,黄色描边标记的节点是TOP10核心差异基因
图5PPI 分析图

表2 连接度TOP10核心基因
2.5mRNA-lncRNA共表达网络分析从共表达关系网络(图6)中发现lnc-ZNF727-12∶2与PPI网络中核心基因IL-6和下调显著的NR4A2均有共表达关系。
2.6部分差异基因的qRT-PCR和Western blot验证选取8个差异表达的mRNA通过qRT-PCR进一步验证,其中上调和下调的基因均为4个,所有被选的mRNA均与转录组测序表达量具有相同的表达趋势。由于IL-6是连接度最高的核心基因,且是下调幅度最为明显的基因,而NR4A2是Wnt通路中的核受体基因并同样差异表达显著,且和IL-6均与lnc-ZNF727-12∶2有共表达关系,故对IL-6和NR4A2进行Western blot验证,结果显示POP患者中这两个蛋白的表达水平均较对照组明显降低,与基因测序结果一致。

箭头节点表示lncRNA,圆形节点表示mRNA,红色字体表示表达上调,蓝色字体表示表达下调,黑色字体表示无统计学意义
3 讨论
子宫主韧带组织结构和功能的破坏是影响POP发生发展的重要因素[9]。本研究通过对子宫主韧带组织转录组高通量测序,共筛选出794个差异表达显著的mRNA和1 106个lncRNA,通过生物信息学分析发现它们的功能主要集中于组蛋白和核小体的装配、细胞的生成与死亡等方面,并通过Wnt/β-cantenin途径、细胞周期途径、组蛋白及转录调控途径,进一步影响韧带中成纤维细胞增殖与死亡的平衡以及胶原的代谢。
3.1Wnt/β-cantenin信号通路和细胞周期通路通过对差异基因的KEGG通路分析,作者发现有12个差异表达的基因在Wnt/β-cantenin途径富集,如FZD5、AXIN2、SOX17、MYC、JUN、FOSL1、CCND1、MMP7等。Wnt/β-Catenin信号通路可传导生长刺激信号,参与不同的发育机制,如影响细胞分化以及决定细胞的增殖等[10]。研究发现,膜受体FZD5可抑制下游胞质中AXIN2表达[11],而SOX17通过与AXIN2结合形成共调节因子[12],在转录水平反向抑制Wnt/β-cantenin通路中下游核心差异基因MYC的表达[13],进而导致核内靶基因FOSL1、MMP7等多个重要转录因子的表达抑制。MMP家族主要负责胶原纤维的代谢[14],FOSL1可与JUN蛋白二聚化形成转录因子复合物AP-1,而AP-1已显示是多种MMP的主要转录调节剂[14]。上述改变会进一步抑制细胞周期通路中细胞周期调节蛋白RGCC的表达。KEGG通路富集分析发现有17个差异表达的mRNA富集于细胞周期通路:如CDK1、CDKN1A、PLK1、CDC20、CDC45、TTK、CCNA2、CCNB2等。下调的RGCC在体内会关联并激活细胞周期蛋白依赖性激酶(CDK),进而影响G2/M转变[15]。PLK1是真核细胞周期中的关键参与者,介导真核生物的磷酸化调节,如G2/M转换、有丝分裂和胞质分裂等细胞周期进程[16-17]。本研究发现POP患者子宫主韧带组织中PLK1明显上调,提示G2/M转换异常。另外,表达显著下调的核心基因MYC是细胞周期特异性关键酶CDK-1的正调节剂,影响成纤维细胞的增殖活性及胶原的生物合成过程。POP患者宫旁韧带成纤维细胞中经典Wnt/β-Catenin信号传导通路受到抑制,可进一步级联影响细胞周期通路,进而降低成纤维细胞的增殖及合成胶原蛋白的能力[5]。
3.2组蛋白相关基因对转录调控的影响组蛋白基因表达上调是进入细胞周期阶段的标志之一[18-19]。本研究中有大量组蛋白家族mRNA表达明显上调。越来越多的实验[20]证实组蛋白N′端的碱基容易在翻译后被不同的基团修饰,从而具备调控基因表达的功能,H3组蛋白的磷酸化修饰在G2晚期出现,M期开始增加,H2A和H2B组蛋白的泛素化在M期开始减少。本研究分析了目前36个差异表达的组蛋白相关基因的改变,亦提示细胞周期G2/M转化异常。结合差异基因表达PPI分析图,组蛋白相关基因和细胞周期调控基因的异常表达可能共同引起子宫主韧带中成纤维细胞周期阻滞,进而影响韧带损伤后的自我修复和正常衰老细胞的补充。综上,作者推测组蛋白基因的高表达和细胞周期紊乱是促成POP发病的重要原因。
3.3IL-6与PPI和mRNA-lncRNA共表达网络本研究结果显示共表达网络中ZNF727-12∶2与IL-6和NR4A2有共表达关系,IL-6位于PPI的核心。IL-6是重要的多功能细胞因子,广泛参与炎症、免疫、细胞增殖与活化等生理病理过程[21]。结合KEGG富集分析结果显示,在人体器官系统通路类别中差异基因富集度最高的是免疫系统,作者考虑POP患者IL-6转录水平的抑制可能与局部微环境的免疫力降低有关。另外,结合对差异基因的GO富集分析提示,IL-6也参与胶原合成的调节和胶原代谢调节,IL-6表达水平的降低可影响局部组织的胶原合成代谢。NR4A2是核受体家族中重要一员,可被多种细胞外刺激因素激活而广泛参与调控生物的代谢、免疫以及细胞的生长、分化、凋亡等重要生理病理过程,其功能同时也受到磷酸化、蛋白质相互作用等多种途径的调控[22]。有研究[23]提示NR4A家族与Wnt/β-Catenin信号通路之间有明确的相互作用,如NR4A2可以抑制β-catenin介导的Axin2的表达。作者在PPI分析图中发现该家族中三种受体均在转录调控网络中发挥广泛作用。综上,作者推测在某些易感因素的刺激下(如分娩、感染等),ZNF727-12∶2调控序列被激活,他们可能参与抑制了包括IL-6与NR4A2等核心基因的表达,进而影响转录因子和组蛋白的调控网络以及Wnt/β-catenin信号通路,导致主韧带中成纤维细胞的增殖及补充障碍[5]。
总之,POP的发生发展与多基因的改变有关,包括转录调节因子(如IL-6、MYC、ATF3等)、Wnt/β-cantenin通路相关基因(如FZD5、AXIN2、MMP7等)、细胞周期调节基因(如CDK1、CCNB1等)以及组蛋白调控相关基因(如CENPA、ASF1B等),这些基因在PPI中相互作用,尤其是位于网络核心的IL-6及与其共表达的ZNF727-12∶2在整个差异表达谱中的作用不可忽视。但是,由于术中电刀、超声刀等能量器械的广泛应用会对样本造成破坏,导致临床中完全符合高通量测序要求的标本较少,今后的实验中我们将加大样本量进一步验证,也期待后续研究通过大样本量的生物信息挖掘得到整合结论,促进在基因层面对POP的认识。
致谢:真诚感谢上海欧易生物医学科技有限公司工作人员的技术支持及课题组其他成员的热心帮助。

