过表达Perilipin5和抑制PKA对大鼠肝星状细胞凋亡的影响
殷雪翠,汤有才,李 哲, 李恩耀,李元枭, 李璇璇, 郑鹏远
1 ) 郑州大学第五附属医院消化内科 郑州 450052 2)郑州大学第五附属医院儿科 郑州 450052 3) 郑州大学第五附属医院儿童康复科 郑州 450052 4) 郑州大学第五附属医院河南省康复医学重点实验室 郑州 450052 5) 郑州大学第五附属医院河南省慢性肝损伤国际联合实验室 郑州 450052 6)郑州大学第五附属医院康复科 郑州 450052 7)郑州大学第五附属医院儿童脑瘫科 郑州 450052
肝纤维化的特征是细胞外基质(extracellular matrix,ECM)在细胞外间隙中过度积累。多种慢性肝病,包括非酒精性脂肪性肝炎,均可能发展成肝纤维化。肝星状细胞(hepatic stellate cell,HSC)活化是肝纤维化发展的核心步骤,活化的HSC是α-SMA和胶原蛋白的主要来源。因此抑制HSC活化或诱导其凋亡是有效对抗肝纤维化的途径。有证据[1-5]表明细胞内脂质含量可能影响HSC的活化。Perilipin5(Plin5)也称富含氧化组织的PAT蛋白,是Perilipin家族一员。Plin5包被在存储中性脂质的脂肪滴表面,在脂质代谢旺盛的组织中高度表达,例如棕色脂肪细胞[2]、骨骼肌细胞[3]、心肌细胞[4]和肝细胞[6]等。蛋白激酶A(protein kinase A,PKA)又称依赖cAMP的蛋白激酶,其活化可使多种蛋白质底物的丝氨酸或苏氨酸残基磷酸化,进而调节靶蛋白活性,影响相关基因的表达。有研究[7]发现Plin1可通过PKA信号通路参与脂肪细胞的脂质调控;Plin5在体外活化的HSC中表达降低[8]。本研究制备过表达Plin5的HSC,观察PKA抑制剂H89应用对其增殖能力、凋亡的影响,探讨Plin5是否能够影响肝纤维化过程。
1 材料与方法
1.1细胞及主要试剂鼠肝星状细胞株HSC-T6购于上海普诺赛(中国)公司,人肾上皮细胞293T由郑州大学第五附属医院马歇尔医学研究中心保存。包膜质粒pHR8.2ΔR和pCMV-VSVG由美国Saint Louis大学实验室赠送。Lenti-XqRT-PCR慢病毒滴定试剂盒购于美国Clontech Laboratories公司。MTT购于美国Sigma公司。PKA抑制剂H89购于美国MedChen Express公司。t-PKA和磷酸化PKA(p-PKA)、Cyclin D1、P21、Bcl-2、Bax、β-actin、GAPDH抗体均购于美国Santa Cruz公司。荧光EnzCheck®Caspase-3活性测定试剂盒购于美国Invitrogen公司。QuantScript RT及荧光定量检测试剂盒购于日本TOYOBO公司。EcoRI、AgeI内切酶均购于德国Thermo Fisher Scientific公司。
1.2大鼠原代HSC的分离将雄性SD大鼠(200~250 g,购于郑州市惠济区华兴实验动物养殖场)以12 h光照、12 h黑暗循环的方式饲养在温度控制(23 ℃)设施中,允许随意获得正常饮食和水。大鼠应用方案由郑州大学动物管理和使用委员会批准。大鼠以水合氯醛麻醉,应用原位胶原酶灌注肝脏,灌注液经密度梯度离心法分离得原代HSC(HSC-Primary)。
1.3Plin5慢病毒的制备使用Trizol试剂从大鼠肝组织中提取总RNA反转录得cDNA。PCR反应体系为25 μL。PCR引物(NCBI参考序列为NM_025874.3):正义链5’-TTGCGAGAATTCACCATG GACCAGAGAGGTGAAGACA-3’,反义链5’-GTGGCGACCGGTGCGAAGTCCAGCTCTGGCATCATTG-3’。PCR反应条件:95 ℃预变性10 min;95 ℃ 10 s,60 ℃ 20 s,72 ℃ 15 s,共40个循环。将PCR产物(1 392 bp)用EcoRI和AgeI酶切后克隆到pFLRu载体中,制备pFLRu-Plin5表达质粒。复苏293T细胞,取指数生长期细胞,将pFLRu-Plin5、pHR8.2ΔR和pCMV-VSVG共转染入293T细胞。48 h后收集细胞培养液用0.45 μm滤器过滤,于 4 ℃超速(72 000×g)离心120 min,以浓缩慢病毒。同法制备空病毒。使用Lenti-XqRT-PCR滴定试剂盒定量慢病毒浓度,调整病毒滴度为5×105Tu/mL。
1.4过表达Plin5的HSC细胞模型的制备将HSC-Primary 和HSC-T6细胞接种到24孔板,每孔1×105个,于37 ℃、体积分数5%CO2培养箱中培养至细胞密度达2×105个/孔。然后,加入5×105Tu/mL的空病毒或Plin5慢病毒液(10 μL/孔),24 h后于荧光显微镜下观察荧光标签。应用Ploybrene筛选稳定感染Plin5慢病毒的细胞株。
1.5实验分组将HSC-Primary 和HSC-T6细胞均分为4组:空白对照组(未感染细胞), 过表达Plin 5组,H89组(用H89处理未感染细胞)和Plin5+H89组(用H89处理过表达Plin5的细胞)。H89剂量为10 mg/L。细胞分组处理48 h后进行后续实验。
1.6观察指标
1.6.1 细胞增殖率 将细胞以1×104个/mL的浓度接种至96孔板,每组3个复孔。培养24 h后吸去培养液,每孔加入20 μL MTT(5 g/L)于37 ℃孵育1 h,PBS洗涤细胞,加入DMSO振荡混匀(使结晶充分溶解),用酶标仪检测490 nm波长处的光密度值。以不含细胞的培养液孔为调零孔。细胞增殖率=(待测组光密度-调零孔光密度)/(空白孔光密度-调零孔光密度)×100%。实验重复3次。
1.6.2 Plin5、t-PKA、p-PKA、Cyclin D1、P21、Bcl-2、Bax蛋白的表达 采用Western blot法检测。按照1.5分组处理48 h后收集细胞,用RIPA裂解细胞得总蛋白。制备120 g/L的SDS-PAGE,蛋白上样量30 μg,100 V下电泳1 h后转PVDF膜,50 g/L 脱脂奶粉封闭液封闭1 h,分别加Plin5、t-PKA和p-PKA一抗(稀释度均为1∶1 000),细胞周期相关蛋白Cyclin D1、P21一抗(稀释度分别为1∶1 000、1∶250),凋亡相关蛋白Bcl-2、Bax一抗(稀释度分别为1∶500、1∶300),内参β-actin或GAPDH一抗(稀释度均为1∶1 000) 过夜,TBST洗膜后,加二抗室温孵育1 h。利用化学发光凝胶成像仪显影,使用Image J 分析。以目的条带与内参条带灰度值的比值表示目的蛋白的表达水平。以p-PKA与t-PKA表达水平的比值表示PKA磷酸化水平。实验重复3次。
1.6.3 细胞中Caspase-3活性 按照1.5分组处理48 h后,收集细胞,采用试剂盒检测Caspase-3活性,按试剂盒说明操作。实验重复3次。
1.7统计学处理所有数据采用SPSS24.0进行分析。未感染、感染空病毒和感染Plin5慢病毒的细胞中Plin5表达水平及PKA磷酸化水平的比较采用单因素方差分析及LSD-t检验,4组细胞增殖率、多种蛋白表达水平、Caspase-3活性的比较采用析因设计的方差分析。检验水准α=0.05。
2 结果
2.1过表达Plin5细胞株的鉴定及其PKA磷酸化水平的变化两种细胞未感染组、空病毒组和感染Plin5慢病毒组细胞中Plin5、t-PKA、p-PKA蛋白的表达见图1、表1。两种感染Plin5慢病毒组的细胞中Plin5蛋白表达均高于空病毒组和未感染组(P<0.05),提示成功构建了过表达Plin5细胞株。感染Plin5慢病毒组细胞中PKA磷酸化水平较未感染组和空病毒组提高(P<0.05)。
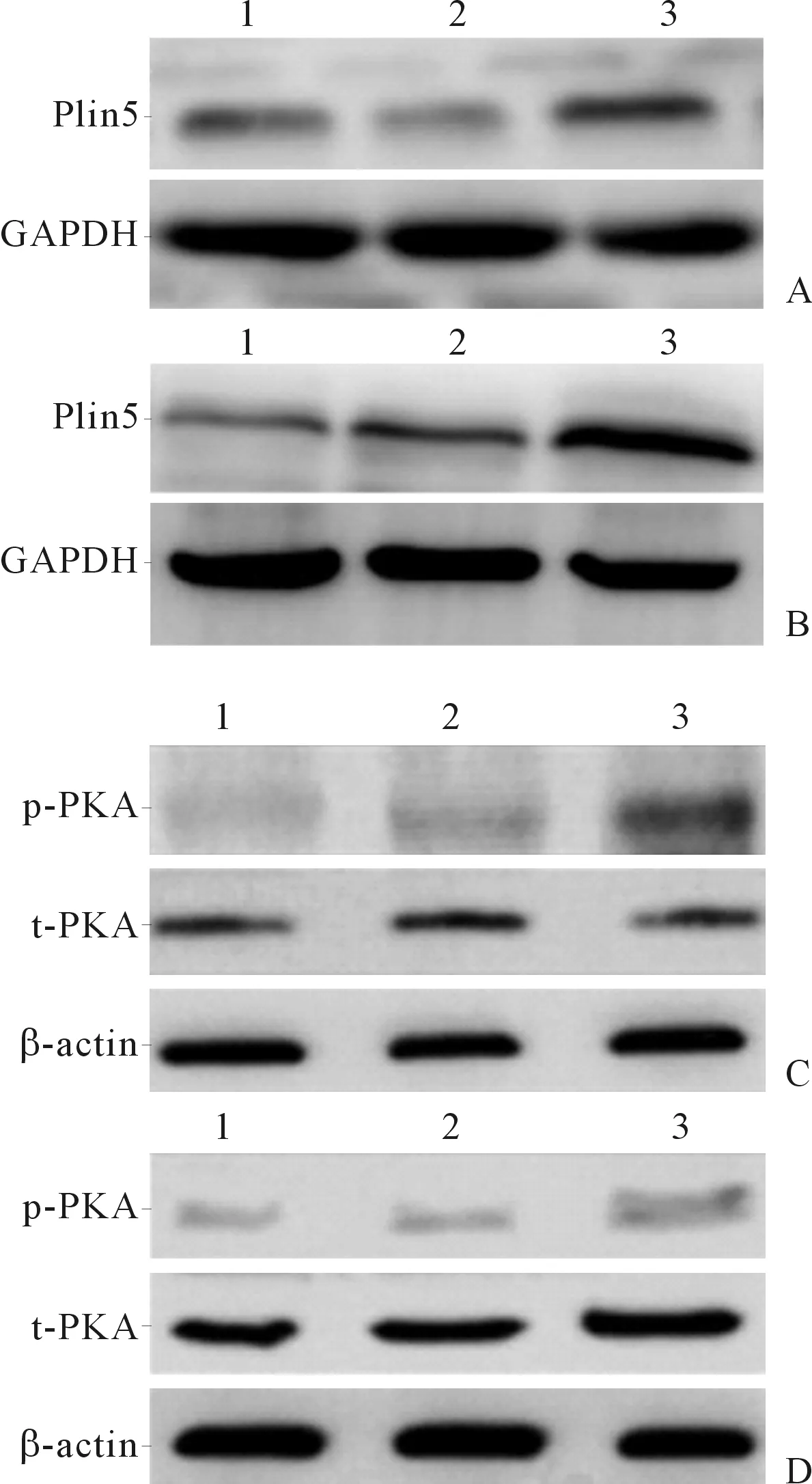
图1 HSC-Primary(A、C)和HSC-T6(B、D)细胞未感染组(1)、空病毒组(2)和感染Plin5慢病毒组(3)Plin5、PKA的表达
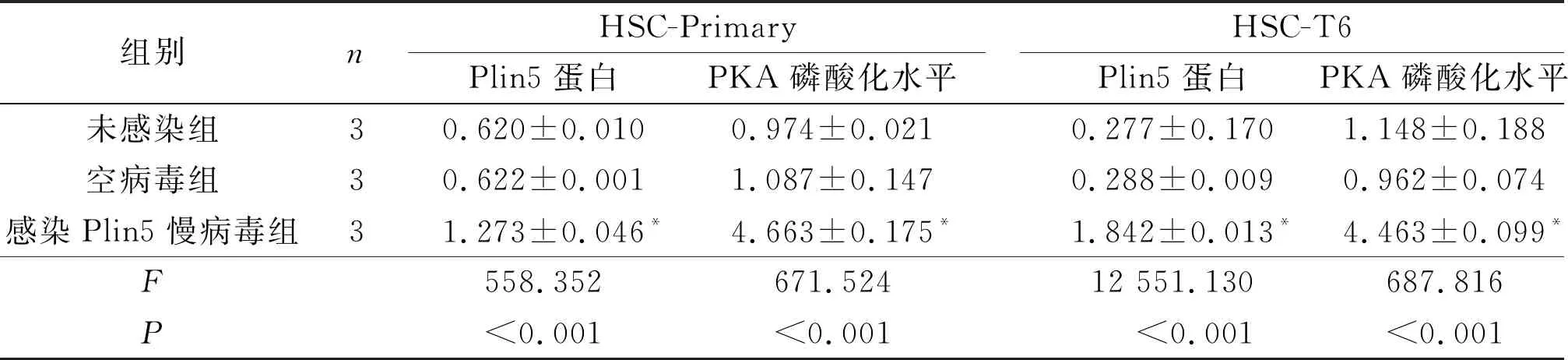
表1 两种细胞不同组别Plin5蛋白表达和PKA磷酸化水平的比较
* :与未感染组和空病毒组相比,P<0.05
2.2 4组细胞中Bcl-2和Bax蛋白表达的比较见图2、表2和3。过表达Plin5组抑凋亡蛋白Bcl-2表达较空白对照组下调,促凋亡蛋白Bax表达上调;Plin5+H89组Bcl-2表达较过表达Plin5组上调,Bax表达下调(P<0.05)。
2.3 4组细胞中Cyclin D1和P21蛋白表达的比较见图2、表2和3。过表达Plin5组促细胞周期蛋白Cyclin D1的表达较空白对照组下调,抑细胞周期蛋白P21表达上调;Plin5+H89组Cyclin D1表达较过表达Plin5组上调,P21表达下调(P<0.05)。
2.4 4组细胞增殖率的比较见表2、3。 过表达Plin5组细胞增殖率较空白对照组降低,Plin5+H89组细胞增殖率较过表达Plin5组升高(P<0.05)。
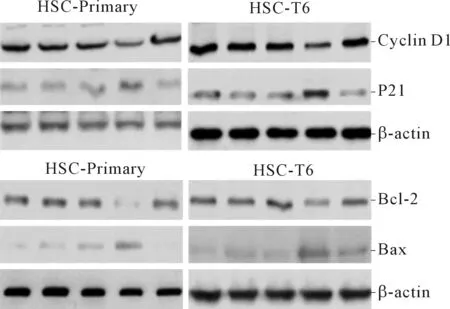
图2 两种细胞不同组别Cyclin D1、P21、Bcl-2和Bax蛋白的表达
2.5 4组细胞中Caspase-3活性的比较见表2、3。过表达Plin 5组Caspase-3活性较空白对照组升高,Plin5+H89组Caspase-3活性较过表达Plin5组降低(P<0.05)。

表2 4组HSC-Primary细胞增殖率、Cyclin D1、P21、Bcl-2和Bax蛋白表达水平及Caspase-3活性的比较
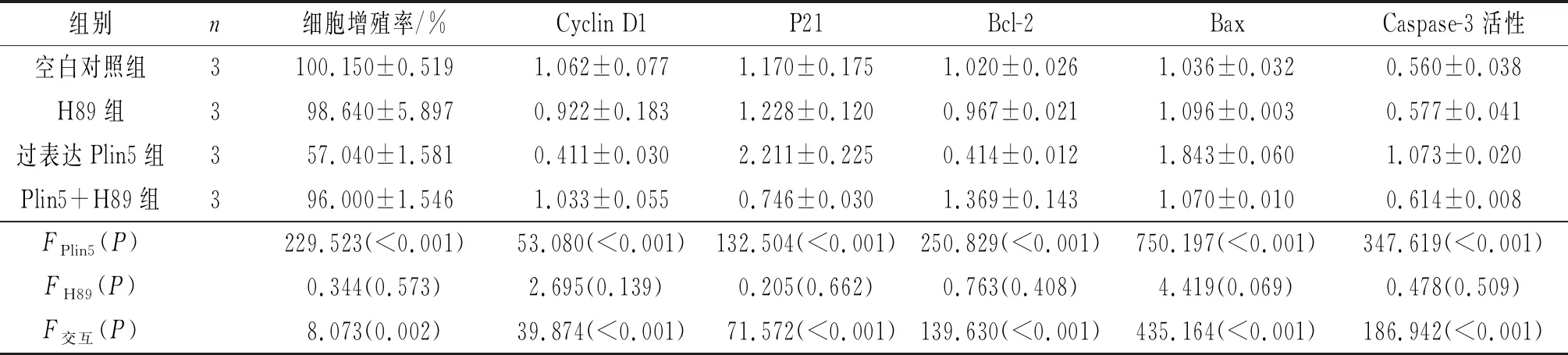
表3 4组HSC-T6细胞增殖率、Cyclin D1、P21、Bcl-2和Bax蛋白表达水平及Caspase-3活性的比较
3 讨论
HSC被认为是肝纤维化的效应细胞。在健康肝脏中,HSC处于静息状态,胞内储存大量脂滴,因此又称储脂细胞。在慢性肝损伤过程中,HSC被多种细胞因子激活,向肌成纤维细胞转化,同时伴有胞内脂肪滴丢失和过量ECM的产生。目前,还不能确定是脂肪滴丢失触发了HSC激活,还是HSC激活导致脂肪滴丢失,二者的因果关系有待进一步探讨[8-12]。研究[8,13]发现健康肝脏分离的原代HSC在体外培养超过7 d可自发性活化,为保持实验的严谨性,本实验同时选用体外分离的大鼠原代HSC和传代细胞系HSC-T6进行实验。
在正常肝细胞中存在着线粒体cAMP-PKA轴,通过增加ROS和诱导凋亡对葡萄糖缺乏产生应答[14]。PKA可通过调控各种蛋白的磷酸化介导细胞凋亡,如AKT、细胞内信号调节激酶(ERK)和STAT3等,在细胞增殖、转化过程中发挥重要作用[13,15-19]。有研究[20]报道上调cAMP-PKA轴可以抑制肝细胞癌来源细胞系的细胞周期和存活能力,而PKA激活剂cAMP能够抑制多种肝细胞癌细胞系的细胞周期,并导致细胞死亡[21]。这与PKA多向性作用及其在不同环境下发挥不同的生物学效应相一致。激活cAMP-PKA被假定为一个明确的抗肿瘤途径,既抑制细胞周期又诱导凋亡[22-23]。活化的HSC具有无限传代的特性,与癌细胞有一定的相似性。
Plin5与脂肪滴高度相关[6,13,24]。Plin5可调节肝细胞、心肌细胞、骨骼肌和胰岛中的脂质代谢、胰岛素分泌和线粒体功能[25-26]。该实验结果显示,外源性上调Plin5表达可以提高大鼠HSC中PKA磷酸化水平,降低促细胞周期蛋白Cyclin D1和抑凋亡蛋白Bcl-2的表达,上调抑细胞周期蛋白P21和促凋亡蛋白Bax的表达,增加细胞凋亡效应蛋白酶Caspase-3的活性,使HSC周期发生阻滞,细胞增殖受抑。这种作用可被PKA抑制剂H89阻断或逆转。提示Plin5可通过激活PKA通路,抑制HSC增殖并诱导细胞凋亡,可潜在促使活化的HSC回到静息状态。但是Plin5是否也是通过cAMP-PKA轴诱导HSC凋亡有待进一步证实。综上所述,我们的结果为Plin5诱导活化HSC凋亡提供了新的证据,Plin5有可能成为预防和治疗肝纤维化的靶点之一。

