抑制miR-134治疗大鼠癫痫持续状态实验研究
王小木 贾瑞华 姜瞾 王津存 夏峰*
(1空军军医大学西京医院神经内科,陕西 西安 710032; 2解放军457医院神经内科,湖北 武汉 430012)
癫痫持续状态(status epilepticus, SE)的年发病率为10/10万~40/10万,为神经内科中仅次于急性脑血管病的急危重症。探索新的起效快、作用强的治疗方法,成为神经科临床工作中亟待解决的难点问题。近年来研究发现微小核糖核酸(microRNAs, miRNAs)在癫痫的发生机制中扮演了重要角色[1-2]。其中微小核糖核酸-134(microRNA-134, miR-134)作为一种特异性的表达于神经系统的miRNA,主要参与神经元微观结构的调控,如树突棘的密度与长度等,进而调控局部神经回路的兴奋性[3-5]。既往研究表明,在动物癫痫持续状态发生过程中,海马miR-134表达出现了明显的上调[5]。结合其特异性的表达与生理功能,我们假设:miR-134可能参与了癫痫持续状态的发生,对其深入研究可能为癫痫持续状态的治疗提供一个新的靶点。本研究首先构建大鼠miR-134抑制慢病毒载体,再应用氯化锂-匹罗卡品腹腔注射建立大鼠癫痫持续状态模型,观察miR-134抑制对大鼠发作潜伏期,癫痫持续状态时间,发作严重程度,脑电图功率以及海马神经元凋亡的影响,以期阐明miR-134在癫痫持续状态发生中的作用。
材料与方法
一、构建大鼠miR-134抑制慢病毒载体
构建并验证大鼠miR-134抑制慢病毒载体[6]。
二、建立氯化锂-匹罗卡品大鼠SE模型
观察miR-134抑制对大鼠发作潜伏期,癫痫持续状态时间,发作严重程度,脑电功率以及海马神经元凋亡的影响。
1.实验动物及分组:雄性(Spraque-Dawley, SD)大鼠随机分为生理盐水组,病毒组及对照病毒组。
2.大鼠海马立体定向注射及海马脑电图电极安装:大鼠以10%的水合氯醛麻醉后固定于立体定位仪;以前囟作为参考点,前点:前囟后3.0 mm,偏右或偏左1.4 mm,深度3.0 mm;后点:前囟后4.0 mm,偏右或偏左4.4 mm,深度3.2 mm。在相应部位打开颅骨,利用微量注射器将3 L慢病毒注入海马。放置海马电极:前囟后3.0 mm,偏右或偏左2.0 mm,深度2.6 mm。参考电极置于双眼连线与矢状缝相交处。
3.大鼠癫痫持续状态模型的制备及脑电图记录:2 w后各组SD大鼠给予腹腔注射溴甲基东莨菪碱1 mg/kg;半小时后腹腔注射氯化锂(130 mg/kg),24 h后腹腔注射匹罗卡品50 mg/kg。发作剧烈程度按Racine分级标准进行评分,分级达Ⅳ级或以上者认定为造模成功。大鼠出现SE后40 min给予地西泮5 mg/kg终止发作;记录脑电图并计算脑电总功率。
4.免疫组织化学:10%水合氯醛麻醉大鼠;经左心室常规4%多聚甲醛灌注;取脑;脑组织置于4%多聚甲醛中固定8 h;置于40%蔗糖的磷酸缓冲溶液(phosphate buffer, PB)中,4 ℃存放,直至沉底。用冰冻切片机切成厚度为30 μm的薄片;进行末端脱氧核苷酸转移酶介导的生物素脱氧尿嘧啶核苷酸缺口末端标记(terminal deoxynucleotidyl transferase mediated biotinylated deoxyuridine triphosphate, TUNEL)及神经元核(neuronal Nuclei, NeuN)染色后。
5.实时定量聚合酶链反应(Real-time polymerase chain reaction, RT-PCR)检测慢病毒立体定向注射2 w后各组大鼠海马miR-134表达:各组大鼠总RNA提取后逆转录合成cDNA,以U6为内参,进行RT-PCR检测。具体实验方法参照TaKaLa RR716试剂盒说明书。检测所得数据通过2-△△CT法进行相对定量。引物序列为:5'-GCGTACCAGAGGGAAAAAA-3',5'-TGGGCCACCTAGTCACCAA-3'。
7.动物实验流程:如图1所示。
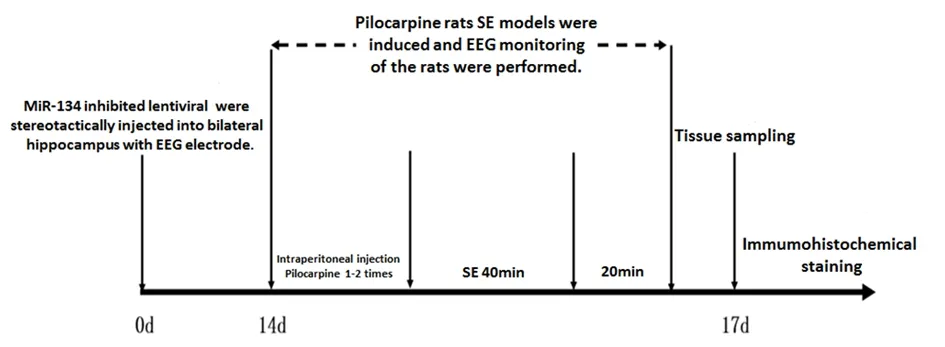
图1 实验动物流程
Fig 1 Animal experiment process
结 果
一、各组大鼠脑电图及发作潜伏期
1.比较匹罗卡品注射后各组大鼠癫痫Ⅴ级发作发作潜伏期:各组大鼠从腹腔注射匹罗卡品开始监测行为学,记录达到Ⅴ级发作的时间,生理盐水组(100%, 5/5),对照病毒组(100%, 7/7),病毒组(72%, 8/11)。统计学分析显示,病毒组潜伏期为(46.75±9.54)s,对照病毒组潜伏期(27.14±6.79)s,生理盐水组潜伏期为(29.60±7.06)s,病毒组潜伏期比对照病毒组缩短,差异具有统计学意义(P< 0.01),对照病毒组与生理盐水组潜伏期差异无统计学意义(P> 0.05)(图2)。
2.比较各组癫痫持续状态发作时间,发作剧烈程度及脑电图功率:病毒组(inhibiting miR-134)组、对照病毒组及生理盐水组Racine评分无明显差异(P> 0.05)(图3);同生理盐水组和对照病毒组相比,病毒组(inhibiting miR-134)组癫痫持续状态持续时间缩短(P< 0.05),生理盐水组和对照病毒组无明显差异(P> 0.05)(图4);计算脑电总功率,同生理盐水组和对照病毒组相比,病毒组(inhibiting miR-134)组脑电总功率降低(P< 0.001)(图5)。
二、慢病毒立体定向注射后大鼠海马miR-134的表达
带有红色荧光蛋白的慢病毒立体定向注射于大鼠海马2 w后,灌注,制备为30 μm脑片,利用荧光显微镜观察。在海马CA1、CA2及CA3区有红色荧光蛋白转染的阳性细胞表达(图6)。
三、RT-PCR检测慢病毒立体定向注射后各组大鼠海马miR-134的表达
立体定向注射慢病毒2 w后,正常对照组与对照病毒组miR-134表达无明显差异(P> 0.05)。相对于正常组及对照病毒组大鼠,miR-134抑制病毒组(inhibiting miR-134组)大鼠海马miR-134表达降低(图7) (P< 0.001)。

图2 病毒组(Inhibiting miR-134)较生理盐水组及对照病毒组Ⅴ级发作潜伏期延长
Fig 2 Compared to the control group and NS group, the virus group had longer racine score Ⅴ lantency
aP< 0.01,vsCont virus group and NS group.
图3 病毒组(Inhibiting miR-134)和生理盐水组及对照病毒组发作强度无明显差异
Fig 3 No significant difference in seizure severity was showed among the control group, NS group and virus group.
图4 病毒组(Inhibiting miR-134)同生理盐水组及对照病毒组相比,癫痫持续状态时间缩短
Fig 4 Compared to the control virus group, the virus group had shorter duration of SE
bP< 0.05,vsCont virus group and NS group.
图5 病毒组(Inhibiting miR-134)同生理盐水组及对照病毒组相比,脑电总功率降低
Fig 5 Compared to the control virus group, the virus group had lower total EEG power
cP<0.001,vsCont virus group and NS group.
图6 大鼠海马红色荧光蛋白表达
Fig 6 The expression of red fluorescence protein in rat hippocampus at 2 w after virus injection
图7 RT-PCR检测立体定向注射2 w后正常对照组、对照病毒组和miR-134抑制病毒组大鼠海马miR-134表达水平
Fig 7 Expression of miR-134 in virus group, contvirus group and normal cont group at 2 w after virus injection detected by RT-PCR
cP< 0.001,vsCont virus group.
四、NeuN染色及Tunel染色检测癫痫持续状态3 d后病毒组(inhibiting miR-134)和对照病毒组海马损伤情况
1.NeuN染色显示癫痫持续状态后3 d,病毒组(inhibiting miR-134)齿状回(dentate gyrus, DG),CA1及CA3区神经元均较和对照病毒组增多(图8~9)。
2.Tunel染色显示癫痫持续状态后3 d,病毒组(inhibiting miR-134)DG、CA1及CA3区凋亡细胞较对照病毒组减少(图10)。

图8 病毒组(Inhibiting miR-134)及对照病毒组海马DG、CA1及CA3区NeuN染色
Fig 8 NeuN staining in hippocampus (DG, CA1 and CA3) in virus group and cont virus group
A: NeuN staining in hippocampus of cont virus group; B: NeuN staining in hippocampus of virus group; C: NeuN staining in DG of cont virus group; D: NeuN staining in DG of virus group; E: NeuN staining in CA1 of cont virus group; F: NeuN staining in CA1 of virus group; G: NeuN staining in CA3 of cont virus group; H: NeuN staining in CA3 of virus group.

图9 病毒组(Inhibiting miR-134)海马DG, CA1及CA3区神经元均较对照病毒组NeuN阳性细胞数增多
Fig 9 The virus group (Inhibiting miR-134) had more NeuN-positive cells than the control virus group
A: Statistical representation for the NeuN-positive cells in DG; B: Statistical representation for the NeuN-positive cells in CA1; C: Statistical representation for the NeuN-positive cells in CA3.
bP< 0.05,cP< 0.001,vsCont virus group.

图10 病毒组(Inhibiting miR-134)及对照病毒组海马DG、CA1及CA3区Tunel染色
Fig 10 Tunel staining in hippocampus (DG, CA1 and CA3) in virus group and cont virus group
A: Tunel staining in DG of cont virus group; B: Tunel staining in CA1 of cont virus group; C: Tunel staining in CA3 of cont virus group; D: Tunel staining in DG of virus group; E: Tunel staining in CA1 of virus group; F: Tunel staining in CA3 of virus group.

图11 病毒组(Inhibiting miR-134)较对照病毒组海马DG、 CA1及CA3区Tunel染色阳性细胞减少
Fig 11 The virus group (inhibiting miR-134) had less Tunel-positive cells than the control virus group
A: Statistical representation for the Tunel-positive cells in DG; B: Statistical representation for the Tunel -positive cells in CA1; C: Statistical representation for the Tunel-positive cells in CA3.
cP<0.001,vsCont virus group.
讨 论
SE指一次癫痫发作超过30 min或者两次发作期间患者意识未恢复[7]。SE的发病率及死亡率很高,是威胁生命的神经内科急症之一[8],快速有效治疗癫痫持续状态的方法是目前神经科学研究的热点。
miRNA是一种高度保守的内源性的长约19~24个核苷酸的非编码小分子RNA,miRNA通过碱基互补配对原则特异性地与一个或多个靶基因的mRNA结合,导致mRNA降解或者翻译抑制,在转录后水平调节多种蛋白的翻译[9]。这些蛋白的功能涉及神经元形态、离子通道及神经元迁移等,越来越多证据表明表明microRNA在癫痫的发生机制中扮演了重要角色[10]。
MiR-134是一种脑内特异的miRNA,位于人类第14号染色体,表达于脑内神经元和树突[11]。SE可引起miR-134在海马表达增加,有研究表明在实验动物的海马和难治性癫痫患者的颞叶皮层中miR-134的表达水平增高[12]。为了探讨miR-134抑制在大鼠匹罗卡品癫痫持续状态模型中效果如何,我们首先制备抑制miR-134慢病毒,然后建立大鼠匹罗卡品癫痫持续状态模型,2 w后将抑制miR-134的慢病毒立体定向注射于大鼠海马,发现同对照病毒组相比SE发作潜伏期缩短(P< 0.01),发作脑电总功率较对照病毒组降低(P< 0.001),癫痫持续状态持续时间较对照病毒组缩短(P< 0.05),但发作剧烈程度无明显差别(P> 0.05)。通过免疫组化染色显示癫痫持续状态3 d后病毒组(Inhibiting miR-134)CA1、CA3及齿状回NeuN染色阳性细胞数较对照病毒组增加(P<0.001,P<0.05);而Tunel染色阳性细胞数叫对照病毒组减少(P<0.001),提示抑制miR-134表达可能有减少神经元凋亡作用。
综上所述,慢病毒介导miR-134表达抑制后可以缩短成年匹罗卡品大鼠癫痫发作的潜伏期,缩短SE发作时间,降低脑电功率,减少发作导致的神经元死亡。这些证据均为通过抑制miR-134治疗癫痫持续状态提供新的实验理论依据,为防治癫痫持续状态带来新希望。

