基于TGF-β1/Smad3信号通路观察促血小板生成素对阿霉素致心力衰竭大鼠心肌细胞凋亡的影响
牛 欢,陈曼丽,杨 波,何智余
(1.深圳大学总医院 心血管内科, 广东 深圳 518005; 2.深圳市宝安区妇幼保健院 内科, 广东 深圳 518000; 3.兰州大学第一医院 心血管内科, 兰州 730000)
原发性以及继发性的心血管疾病的终未期主要表现为心室充盈或射血功能受损,被称为慢性心力衰竭(chronic heart failure,CHF)[1],至今尚无根治性治疗手段。据统计CHF的5年生存率不足50%。目前CHF的发病机制已逐渐深入到分子生物学水平,为CHF的基因靶向治疗提供有力支撑[2]。研究表明[3]心肌纤维化导致的心室重构(ventricular remodeling,VR)进而造成心肌细胞的异常凋亡是CHF发生、发展过程中关键性的病理改变。Chang等[4]研究证实抑制心肌纤维化,能降低心肌细胞的凋亡率,减轻心力衰竭的程度。已有的实验研究表明[5]转化生长因子-β1(transforming growth factor-β1,TGF-β1)直接参与心肌纤维化的病理过程。研究显示TGF-β1可促进成纤维细胞(cadiacfibloblast,CFs)转化。CFs的增生刺激分泌细胞外基质(extra cellular matrix,ECM)蛋白,引起心肌组织胶原纤维积聚,进而改变心肌的基础空间结构,造成心肌细胞异常凋亡、坏死数量增加,导致心脏功能障碍。Heger等[6]研究证实TGF-β1能够促进大鼠心肌细胞的凋亡。促血小板生成素(thromobopoietin, TPO)是机体内调节血小板/巨核细胞系的最重要的造血蛋白生长因子,临床应用就是作为造血生长因子用于血小板减少症的治疗。近年来研究发现TPO对心脏具有保护作用[7]。张东涛等[8]体外研究H9C2细胞发现, TPO通过抑制细胞凋亡实现对体外心肌细胞的保护作用,但TPO在CHF中作用的报道较少。本研究通过建立大鼠CHF模型,从TGF-β1/Smad3的角度探讨TPO对CHF的保护作用,从而为临床上TPO的应用提供。
1 材料和方法
1.1 实验动物
48只8-10周SPF级SD雄性大鼠,体重220~250 g,[SCXK(甘)2018-0002],[SYXK(甘)2018-12],由深圳大学总医院实验动物中心提供;室温下标准饲料、自由饮水、分笼(4笼)适应性饲养一周后用于实验。实验动物的使用及操作均遵守3R原则,在过程中给与与动物人道的关怀,实验基本操作参照深圳大学总医院动物管理委员会关于基础实验动物的的规定进行,并经本院实验动物管理伦理委员会批准(JG-2019-0047)。
1.2 主要试剂与仪器
促血小板生成素注射液(thrombopoietin,TPO,沈阳三生制药有限公司,批准文号:国药准字:S20050048);阿霉素(注射用盐酸多柔比星,山西普德药业股份有限公司,批准文号:国药准字H14023879);TGF-β1特异性抑制剂SB431542(生产批号:1014-JA)采购自美国Selleck公司,异氟烷(生产批号:521 L -A)、戊巴比妥钠(生产批号:256O-0I)、链脲佐霉素(生产批号:AS-7802)、多聚甲醛(生产批号:WQ-2F)采购自Sigma公司;HE试剂盒(生产批号:KT-2018H567)、Masson染色试剂盒(生产批号:KT-2018M902)购自上海碧云天生物技术公司;BCA蛋白浓度测定试剂盒(生产批号:GW-147)、化学发光试剂盒(生产批号:GW-1857)购自广东锐博生物科技技术股份有限公司;TGF-β1(生产批号:AY-T201)、p-Smad3抗体(生产批号:AY-S269)、兔抗大鼠Caspase-3(生产批号:AY-C5TH)、兔抗GAPDH(生产批号:AY-GT34)以及山羊抗兔IgG(生产批号:AY-IJ70)采购自美国abcam公司,TUNEL试剂盒(生产批号:RN-S069)、Western blot试剂盒(生产批号:RN-WR672)购自德国Rebstock公司。
荧光显微镜(US-2018,尼康公司,日本),Bio-rad凝胶成像系统(8845-S型,Bio-rad公司,美国),-80℃深冷冰箱(WF-150 V,维根斯公司,德国),电镜(KW-06,三菱公司,日本),组织切片机(Leica RM2135,Leica公司,德国)。
1.3 实验方法
1.3.1 模型构建和分组处理
实验前使用标准医用生理盐水将注射用阿霉素配成2 mg/L溶液,将48只大鼠随机分为4组,每组12只,分别为对照组、模型组、TPO干预组(治疗组)、TGF-β1特异性抑制剂SB431542干预组(抑制剂组);据文献方法[9],将阿霉素溶液分别以7 mg/kg腹腔注射到模型组、治疗组、抑制剂组大鼠体内,每周1次,持续8周,构建心力衰竭大鼠模型;对照组大鼠腹腔注射等体积的医用生理盐水。8周后采用心脏彩超记录鼠心功能指数。同时开始进行药物干预治疗,治疗组大鼠每日腹腔注射给药5 μg/kg TPO; 抑制剂组大鼠每日腹腔注射给药1.2 mg/kg SB431542;对照组、模型组大鼠给予等体积的生理盐水,持续给药28 d。
1.3.2 心脏超声检査心脏功能
持续给药28 d后,异氟烷腹腔注射麻醉大鼠,固定于手术台,心脏彩超检查心脏功能。记录左室射血分数(LVEF)、左室收缩期内径(LVDS)、舒张期内径(LVDd)、短轴缩短率(FS)等数据。
1.3.3 各组大鼠心肌组织病理学改变
检查心脏彩超之后,戊巴比妥钠腹腔注射麻醉大鼠,腹主动脉放血处死。在无菌操作台上,开胸取出心脏,用无菌滤纸吸干水分,处理过后将心脏组织封存在液氮中,置于-80℃深冷冰箱中备用。取出20%心肌组织,分别用HE染色和Masson染色,制成切片,光镜下观察各组大鼠心肌组织病理改变。
1.3.4 免疫组化法检测心肌组织测Ⅰ、Ⅲ型胶原蛋白表达
取出20%心肌组织,固定包埋并切片,脱蜡后,柠檬酸盐缓冲液修复,3%的双氧水室温下封闭,分别加入一抗,4℃过夜孵育,次日,PBS冲洗3次后,分别加入二抗,清洗。加适量二氨基联苯氨 (diaminobenzidin ,DAB)显色,苏木素复染,乙醇梯度脱水,二甲苯浸泡,中性树胶封片,镜检观察并记录实验结果;每个样本独立重复测量3次。
1.3.5 TUNEL染色检测各组大鼠心肌细胞凋亡
取10%心肌组织,常规方法固定,冰冻切片,二甲苯浸洗两次,梯度酒精浸洗5 min,风干后3%双氧水-甲醇浸泡10 min,PBS漂洗3次,每次3 min,然后4℃预冷乙醇上进行如下操作:0.1% TRItonX-100、0.1%缓冲液处理2 min,PBS漂洗3次,每次3 min,加入TUNNEL反应混合液,加封口膜在暗湿盒中反应1 h,温度37℃,PBS漂洗,脱水后二甲苯透明,封片,US-2018荧光显微镜进行观察。
1.3.6 免疫荧光检测各组大鼠心肌组织中Caspase-3的表达情况
从冰箱中取出10%大鼠心肌组织,常规方法固定,冰冻切片,按照免疫荧光的试剂盒要求进行操作观察Caspase-3的表达情况。
1.3.7 Western blot检测各组大鼠脑组织中Caspase-3以及信号通路相关蛋白TGF-β1、p-Smad3的表达水平
从冰箱中取出10%大鼠心肌组织,组织裂解匀浆器,冰浴5 min后离心,留取上清,测定蛋白浓度后,电泳转移膜,封闭加入一抗稀释液(均为1∶1000),保持4℃过夜,次日清洗后,加入二抗稀释液(均为1∶10000),室温下孵育2 h,显色后Bio-rad凝胶成像仪下读取各条带的灰度值, 目的蛋白相对表达水平以GAPDH作为参照。
1.4 统计学方法

2 结果
2.1 心脏彩超检测大鼠心功能的变化
各组大鼠心脏彩超检测各组大鼠心功能后结果如图1,表1所示,与对照组相比,模型组大鼠的LVDS、LVDd明显出现升高(P<0.05),LVEF、FS明显出现下降(P<0.05),与模型组相比,治疗组、抑制剂组的LVDS、LVDd明显下降(P<0.05),LVEF、FS明显升高(P<0.05),差异均具有统计学意义(P<0.05)。治疗组、抑制剂组在大鼠心脏心功能指数差异不具有统计意义(P>0.05)。
2.2 各组大鼠心肌组织病理学
HE染色结果如图2所示,对照组大鼠心肌细胞结构完整,清晰可辨,细胞整齐排列,细胞间质无水肿情况,心肌横纹清晰且规则,细胞连接紧密。模型组大鼠心肌细胞肥大且不规则、细胞排列紊乱,心肌浊肿明显,细胞间质水肿明显及细胞外基质增多,可见大量炎性细胞浸润,纤维增生明显,心肌细胞间质充血严重,心肌横纹消失;与模型组相比,治疗组、抑制剂组大鼠心肌细胞较模型组排列更规则,心肌纤维变性较轻,纤维组织增生明显减少,基本无出血点,心肌细胞损伤症状明显减轻。
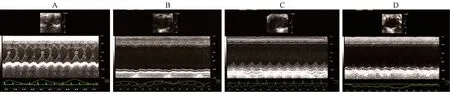
注:A:对照组;B:模型组;C:治疗组;D:抑制剂组。图1 各组大鼠心脏超声结果Note. A, control group. B, model group. C, treatment group. D, inhibitor group.Figure 1 Cardiac ultrasound results of rats in each group
表1各组大鼠心功能指数比较
Table1Comparison of the heart function index of rats in each group
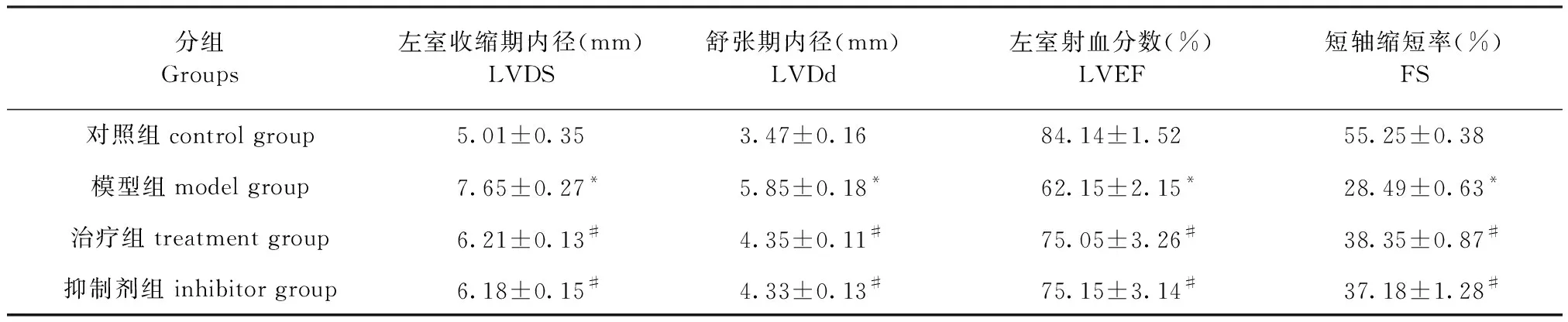
分组Groups左室收缩期内径(mm)LVDS舒张期内径(mm)LVDd左室射血分数(%)LVEF短轴缩短率(%)FS对照组control group5.01±0.353.47±0.1684.14±1.5255.25±0.38模型组model group7.65±0.27*5.85±0.18*62.15±2.15*28.49±0.63*治疗组treatment group6.21±0.13#4.35±0.11#75.05±3.26#38.35±0.87#抑制剂组 inhibitor group6.18±0.15#4.33±0.13#75.15±3.14#37.18±1.28#
注:与对照组相比,*P<0.05;与模型组相比,#P<0.05。
Note. Compared with the control group.*P<0.05. Compared with the model group.#P<0.05.

注:A:对照组;B:模型组;C:治疗组;D:抑制剂组。图2 HE染色结果Note. A, control group. B, model group. C, treatment group. D, inhibitor group.Figure 2 HE staining

注:A:对照组;B:模型组;C:治疗组;D:抑制剂组。图3 Masson染色结果Note. A, control group. B, model group. C, treatment group. D, inhibitor group.Figure 3 Masson staining
光镜下观察大鼠心肌细胞Masson染色,心肌细胞呈现红色,胶原纤维呈现蓝色,本研究中Masson染色结果如图3所示,对照组只是少量的胶原纤维散在细胞间隙中;模型组心肌细胞及血管周围均可见大片蓝色的心肌胶原纤维分布;与模型组相比,治疗组、抑制剂组心肌细胞及血管周围的胶原纤维明显减少。
2.3 免疫组化法检测心肌组织测Ⅰ、Ⅲ型胶原蛋白表达
免疫组化结果如图4所示:与对照组相比,模型组、治疗组、抑制剂组Ⅰ、Ⅲ型胶原蛋白的表达均出现明显的升高(P<0.05)。与模型组相比,在进行药物干预后,治疗组、抑制剂组Ⅰ、Ⅲ型胶原蛋白的表达出现明显的下降(P<0.05),治疗组、抑制剂组在大鼠心脏Ⅰ、Ⅲ型胶原蛋白的表达差异不具有统计意义(P>0.05)。推断促血小板生成素和抑制剂SB431542均可抑制心衰大鼠心脏Ⅰ、Ⅲ型胶原蛋白的表达。
2.4 TUNEL染色检测各组大鼠心肌组织中的细胞凋亡
TUNEL染色结果如图5所示,与对照组相比,模型组大鼠的细胞凋亡率明显升高(P<0.05),与模型组相比,治疗组、抑制剂组大鼠的细胞凋亡率明显降低(P<0.05),治疗组和抑制剂组相比,细胞凋亡率的差异(P>0.05),不具有统计学意义。
2.5 免疫荧光检测各组大鼠心肌组织中Caspase-3的表达情况
Caspase-3作为细胞程序性凋亡的最终执行分子。本研究中免疫组化和Western blot结果如图6所示,与对照组相比,模型组Caspase-3的表达明显升高(P<0.05);与模型组相比,治疗组、抑制剂组Caspase-3的表达明显降低(P<0.05);治疗组和抑制剂组相比,大鼠心肌组织Caspase-3表达差异(P>0.05),不具有统计学意义。
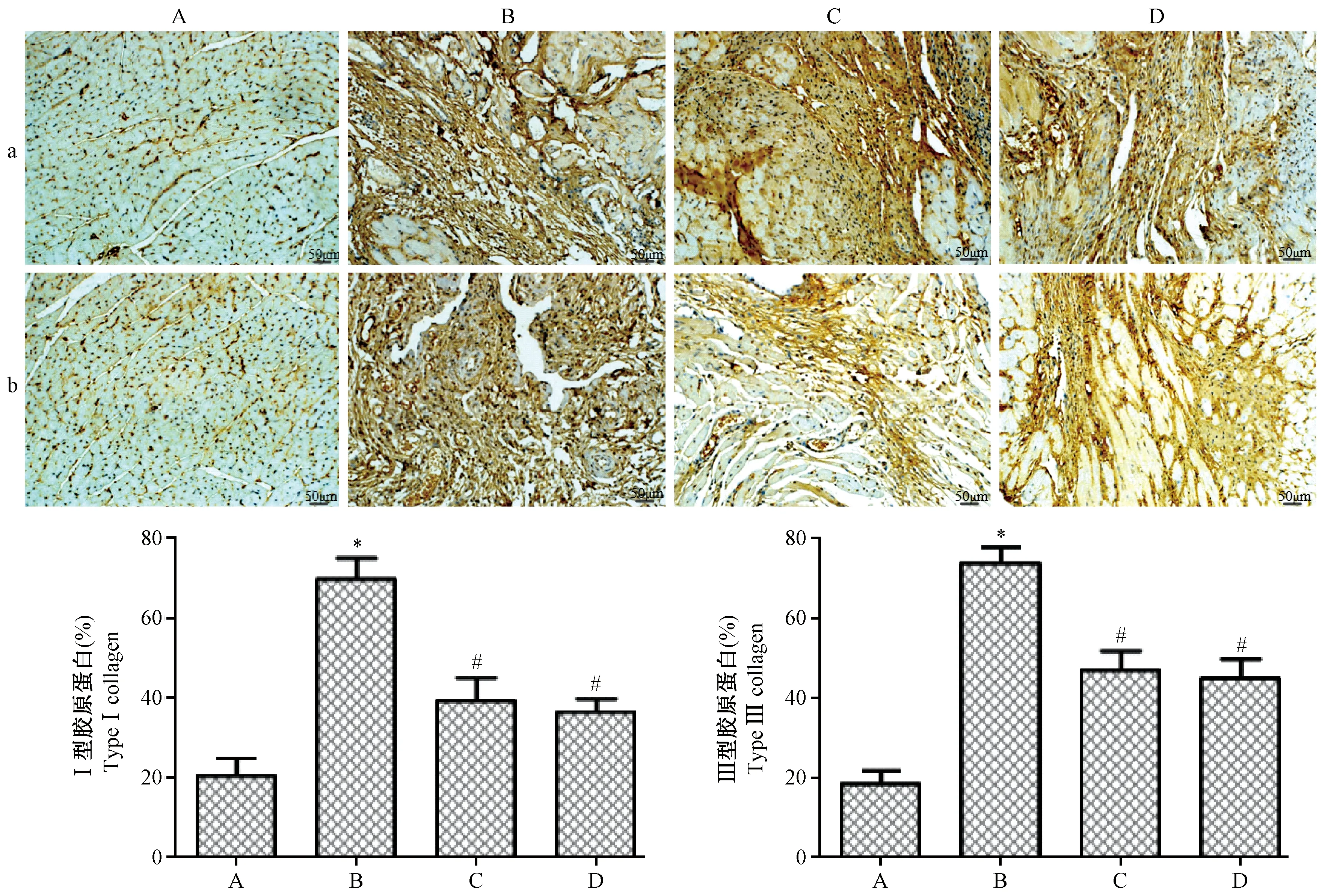
注:A:对照组;B:模型组;C:治疗组;D:抑制剂组。a:Ⅰ型胶原蛋白;b:Ⅲ型胶原蛋白。与对照组相比,*P<0.05;与模型组相比,#P<0.05。图4 免疫组化检测Ⅰ、Ⅲ型胶原蛋白表达结果Note. A, control group. B, model group. C, treatment group. D, inhibitor group. a, type I collagen. b, type III collagen. Compared with the control group,*P<0.05. Compared with the model group, #P<0.05.Figure 4 Immunohistochemical staining of type I and III collagen

注:A:对照组;B:模型组;C:治疗组;D:抑制剂组。与对照组相比,*P<0.05;与模型组相比,#P<0.05。图5 TUNEL染色检测心肌组织中的细胞凋亡Note. A, control group. B, model group. C, treatment group. D, inhibitor group. Compared with the control group,*P < 0.05. Compared with the model group,#P < 0.05.Figure 5 TUNEL staining for the detection of cell apoptosis in myocardial tissue
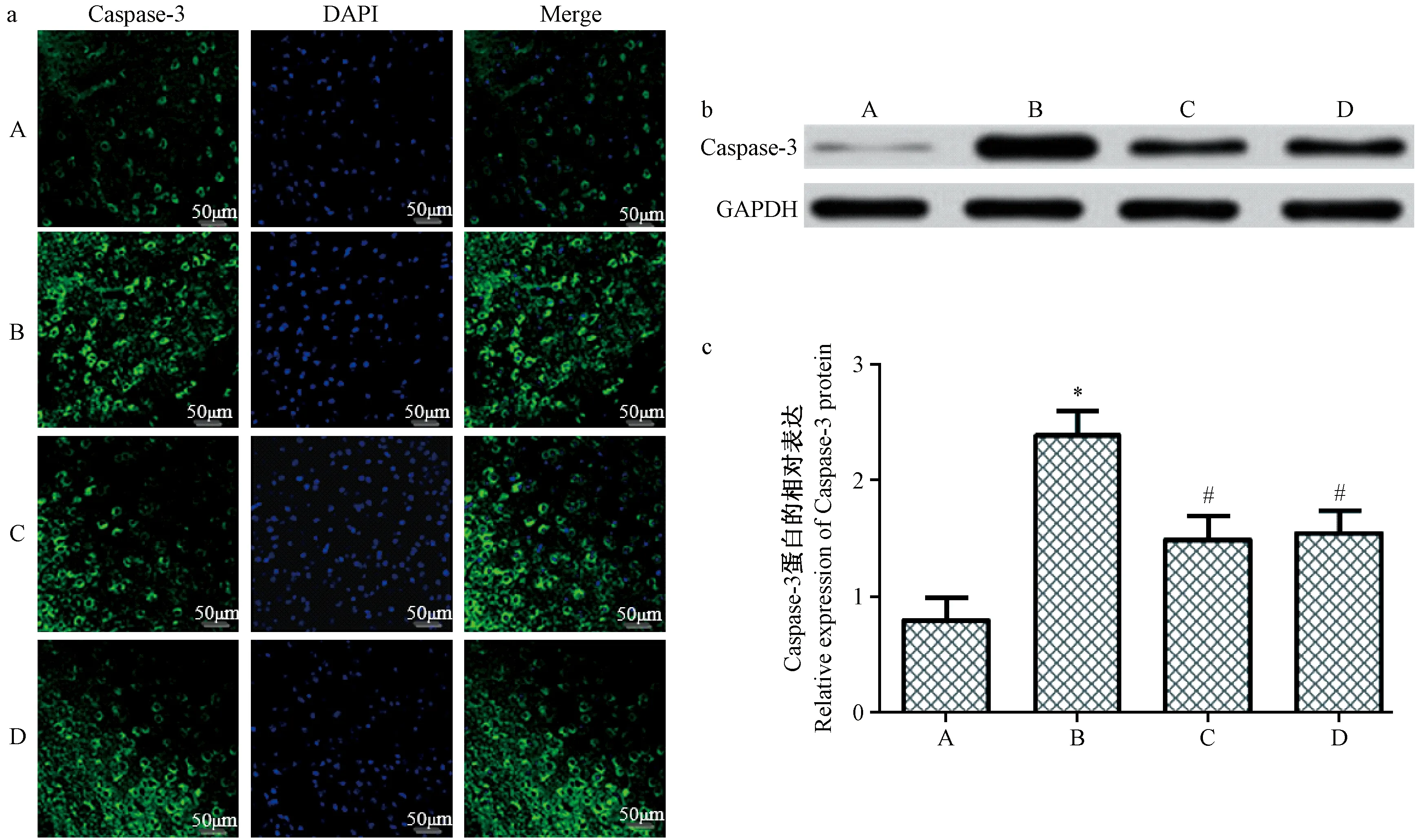
注:A:对照组;B:模型组;C:治疗组;D:抑制剂组。a:免疫组化检测各组大鼠心肌组织Caspase-3的表达;b:Western blot检测各组大鼠心肌组织Caspase-3的表达;c:各组大鼠心肌组织中Caspase-3的表达差异。与对照组相比,*P<0.05;与模型组相比,#P<0.05。图6 各组大鼠心肌组织中的Caspase-3的表达Note. A, control group. B, model group. C, treatment group. D, inhibitor group.a, Immunofluorescence detection of the expression caspase-3. b, Western blot detection of the expression of caspase-3. c, Difference in the expression of caspase-3. Compared with the control group,*P<0.05. Compared with the model group, #P<0.05. Figure 6 Expression of Caspase-3 in myocardial tissue of rats in each group
2.6 Western blot检测TGF-β1、p-Smad3蛋白的表达
本研究采用Western blot检测各组大鼠心脏组织TGF-β1、p-Smad3蛋白的表达,结果如图7所示,与对照组相比,模型组大鼠心肌细胞的TGF-β1、p-Smad3的表达明显升高(P<0.05);与模型组相比,治疗组、抑制剂组大鼠心肌细胞的TGF-β1、p-Smad3的表达明显降低(P<0.05)。治疗组、抑制剂组在大鼠心脏心肌细胞TGF-β1、p-Smad3表达差异不具有统计意义(P>0.05)。
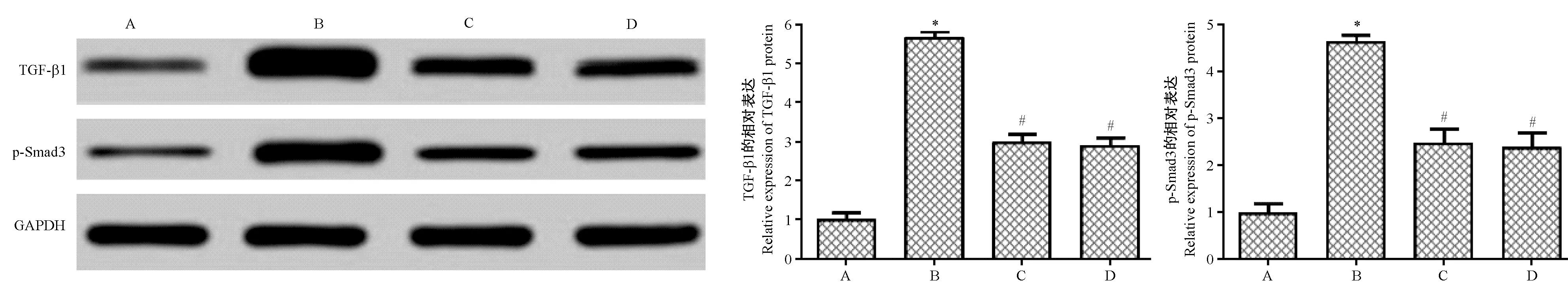
注:A:对照组;B:模型组;C:治疗组;D:抑制剂组。与对照组相比,*P<0.05;与模型组相比,#P<0.05。图7 Western blot检测各组大鼠心脏组织TGF-β1、p-Smad3蛋白的表达Note. A, control group. B, model group. C, treatment group. D, inhibitor group. Compared with the control group,*P<0.05. Compared with the model group,#P<0.05.Figure 7 Western blot detection of the expression of TGF-β1 and p-Smad3 proteins
3 讨论
慢性心力衰竭(chronic heart failure,CHF)是以心脏收缩或舒张功能障碍为标志的器质性心血管系统的综合症[10],死亡率高,预后不佳。近年来,随着研究的深入,许多学者从形态学、分子生物学等角度研究证实心肌细胞凋亡是CHF发生、发展中的重要生理病变过程。
细胞异常凋亡致使心肌细胞数量骤减,心室充盈压失常、心房排血量减少,最终导致心室壁变薄,心腔扩大,心肌肥大等心肌重构(Ventricular remodeling,VR)发展成CHF[11]。促血小板生成素(thromobopoietin, TPO)具有介导血小板生成和调节巨核细胞增殖、分化的功能[12]。近年来研究发现TPO还能在其他系统发挥作用[13]。王晓东等[14]研究发现TPO能促进小鼠神经细胞的增殖,稳定线粒体膜电位,发挥抗凋亡的作用。Besbes等[15]研究发现TPO能够影响卵巢细胞的增殖和凋亡。而TPO对心血管系统的保护作用引起关注[16]。Wang等[17]TPO能保护H9C2细胞免受多柔比星诱导的细胞自噬,发挥心肌细胞保护的作用。Chan等[18]采用TPO 治疗心梗大鼠发现TPO能明显改善其左心室功能,促进血管新生,减小心梗面积。但是TPO 在CHF中的作用未见有研究报道。
阿霉素(adriamycin)是一线抗肿瘤化疗药物,但是由于其心脏毒性,限制了在临床上的应用[19]。本研究中在给与阿霉素8周后,大鼠心脏LVDS、LVDd明显升高,LVEF、FS明显降低,与人CHF症状相似。CHF大鼠模型建立成功。阿霉素造成CHF的机制上不明确,有研究报道[20]证实大鼠在注射阿霉素后,导致心肌细胞凋亡,致使心肌细胞数量骤减,心脏结构发生改变,心室功能降低。本研究中模型组大鼠心脏LVDS、LVDd明显升高(P<0.05),LVEF、FS明显降低(P<0.05),心肌细胞及血管周围均可见心肌胶原纤维沉积,心肌CHF损伤症状明显;细胞凋亡率明显升高(P<0.05)。细胞凋亡是有许多分子共同调控的结果,Caspase-3是凋亡过程中的最重要的效应蛋白[21]。模型组大鼠心肌细胞Caspase-3的表达明显升高。在经过TPO治疗后,治疗组大鼠心脏功能明显改善,心肌细胞凋亡率明显降低(P<0.05);治疗组大鼠心肌细胞及血管周围的胶原纤维明显减少,心肌细胞CHF损伤症状明显减轻。由此可推断促血小板生成素能够抑制有阿霉素导致的心肌凋亡,改善心脏功能。
TGF-β1主要在成纤维细胞、上皮细胞和平滑肌细胞中表达,TGF-β1是激活成纤维细胞的关键因子,可刺激胶原纤维的合成[22]。研究表明[23]TGF-β1/ Smad3信号通路在心脏重塑和CHF的过程中发挥关键性的作用。研究证实[24]抑制TGF-β1的作用能够有效的抑制由糖尿病等导致的CHF的中的心室重构;动物实验研究证实[25]在心肌梗死早期抑制TGF-β1信号通路,能够明显改善心功能。本研究中免疫组化结果显示,模型大鼠Ⅰ、Ⅲ型胶原蛋白的表达均明显升高,在使用TPO和TGF-β1抑制剂干预后,治疗组、抑制剂组大鼠心肌胶原纤维表达明显下降,两组大鼠CHF病理指标改善差异不明显,初步推断TPO可能通过抑制说TGF-β1的表达来改善大鼠CHF症状。进一步研究发现,与对照组相比,模型组大鼠心肌细胞的TGF-β1、p-Smad3的表达明显升高;与模型组相比,治疗组、抑制剂组大鼠心肌细胞的TGF-β1、p-Smad3的表达明显降低,推断TPO 能抑制说TGF-β1的表达。
综上所述,TPO能够改善由阿霉素导致CHF大鼠的心脏功能,降低心肌细胞凋亡率,其机制可能与抑制TGF-β1/Smad3信号通路有关。虽然TPO对心脏的保护作用在动物实验中效果令人欣慰,但是就TPO在临床上治疗心力衰竭的安全性、用药的最佳时间、以及最佳剂量等问题还需要进一步研究。

