心脉隆注射液对阿霉素所致心肌细胞损伤的保护机制研究
,
心脉隆注射液对阿霉素所致心肌细胞损伤的保护机制研究
袁李礼1,蒋宇2
目的探讨心脉隆注射液对阿霉素所致心肌细胞损伤的保护作用和机制。方法建立阿霉素所致的H9C2心肌细胞损伤模型,并采用心脉隆注射液干预。采用CCK8法测定心肌细胞活性,检测细胞超氧化物歧化酶(SOD)和丙二醛(MDA)含量,检测Caspase-3活性,WesternBlot分析Caspase-3表达,免疫荧光分析细胞自噬相关蛋白LC3B。结果与对照组比较,阿霉素组细胞活性明显降低(P<0.05);SOD含量降低(P<0.05),MDA含量升高(P<0.05);心脉隆注射液干预后细胞活性较阿霉素组高(P<0.05),SOD含量升高(P<0.05),MDA含量降低(P<0.05),且呈现剂量依赖性;与对照组比较,阿霉素组Caspase-3活性和表达明显升高(P<0.05),LC3B绿色荧光聚积,心脉隆注射液干预后较阿霉素组Caspase-3活性和表达均降低(P<0.05),LC3绿色荧光聚积减少。结论心脉隆注射液能减轻阿霉素所致心肌细胞损伤和氧化应激,可能与其调节自噬和凋亡有关。
心肌细胞损伤;心脉隆注射液;阿霉素;自噬;超氧化物歧化酶;丙二醛
阿霉素作为一种蒽环类抗肿瘤药,临床上常用于白血病、淋巴瘤、乳腺癌等疾病治疗[1],取得显著效果,但其引起的心脏毒性效应使其临床应用受到限制[2],如何防治阿霉素心脏毒性是临床和基础关注的重要问题和研究热点。心脉隆注射液是美洲大蠊中分离出的一种新型药物,有研究表明其具有抗氧化和心脏保护作用[3-4],但对阿霉素所致心脏损伤的作用机制尚不完全明确。本研究观察心脉隆注射液对阿霉素所致心肌细胞损伤的影响,并进一步探讨其可能机制。
1 材料与方法
1.1 实验材料 大鼠心肌细胞系H9C2细胞(中科院上海细胞库),心脉隆注射液(云南腾药)、阿霉素(上海阿拉丁),DMEM低糖培养基、胰酶、胎牛血清、青霉素链霉素(Gibco),CCK8试剂(日本同仁),超氧化物歧化酶(SOD)检测试剂盒、丙二醛(MDA)测定试剂盒、Caspase-3活性检测试剂盒(江苏碧云天),BCA蛋白定量试剂盒(WellBiology),兔抗LC3B单克隆抗体(Sigma),鼠抗Caspase-3单克隆抗体(Proteintech),荧光二抗(Invitrogen),β-actin抗体(博士德)。
1.2 方法
1.2.1 细胞培养和分组H9C2细胞接种于DMEM低糖培养基(含10%胎牛血清)中,培养条件为5%CO2、37 ℃、待细胞生长至融合度80%~90%,以1∶3比例传代培养,将培养的细胞分为对照组、阿霉素组、阿霉素+心脉隆组;对照组采用常规培养,阿霉素组采用5μg/mL阿霉素处理,阿霉素+心脉隆注射液组采用5μg/mL阿霉素处理同时给予不同浓度心脉隆注射液。
1.2.2CCK8法分析心肌细胞活性 以5×103个细胞/孔接种于96孔板,分组处理,对照组(常规培养)、阿霉素组(5μg/mL阿霉素)、阿霉素+不同浓度心脉隆注射液组(5μg/mL阿霉素+0.25mg/mL、0.50mg/mL、0.75mg/mL、1.00mg/mL心脉隆注射液),每组设6个复孔,培养48h后,每孔加入20μLCCK8试剂,孵育2h后,使用酶标仪450nm处测定吸光度。
1.2.3SOD和MDA试剂盒分析心肌细胞氧化应激 以5×103个细胞/孔接种于96孔板,分组处理,对照组(常规培养)、阿霉素组(5μg/mL阿霉素)、阿霉素+不同浓度心脉隆注射液组(5μg/mL阿霉素+0.25mg/mL、0.50mg/mL、0.75mg/mL、1.00mg/mL心脉隆注射液),每组设6个复孔,培养48h后,收集细胞,分别采用试剂盒检测心肌细胞SOD和MDA,具体操作依照试剂盒说明书进行。
1.2.4Caspase-3活性检测和WesternBlot分析心肌细胞凋亡 以105个细胞/孔接种于24孔板,分组处理,对照组(常规培养)、阿霉素组(5μg/mL阿霉素)、阿霉素+心脉隆注射液组(5μg/mL阿霉素+0.75mg/mL心脉隆注射液),每组设6个复孔,培养48h后,收集细胞,使用于Caspase-3活性检测和WesternBlot分析。Caspase-3活性检测具体操作依照试剂盒说明书进行;Westernblot检测:按照RIPA裂解法提取H9C2细胞总蛋白,BCA试剂盒定量,取20μg蛋白进行SDS-PAGE电泳分离后转移至PVDF膜,5%脱脂奶粉封闭1h,分别以Caspase-3抗体或β-actin抗体孵育过夜后,二抗孵育1h,ECL化学发光显影。
1.2.5 免疫荧光分析心肌细胞自噬 将细胞爬片置于24孔板内,以105个细胞/孔接种于24孔板,分组处理,对照组(常规培养)、阿霉素组(5μg/mL阿霉素)、阿霉素+心脉隆组(5μg/mL阿霉素+0.75mg/mL心脉隆注射液),每组设4个复孔,培养48h后,多聚甲醛固定,透膜封闭,LC3B一抗孵育过夜后,荧光二抗孵育1h,荧光显微镜下观察。
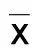
2 结 果
2.1 心脉隆注射液对阿霉素所致H9C2心肌细胞活性的影响 与对照组比较,阿霉素处理H9C2心肌细胞48h后平均吸光度值明显降低,细胞活性明显抑制(P<0.05);心脉隆注射液处理后平均吸光度值升高,细胞活性较阿霉素处理恢复(P<0.05),且呈现剂量依赖性。详见表1。

表1 心脉隆注射液对阿霉素所致H9C2心肌细胞活性的影响(±s)
2.2 心脉隆注射液对阿霉素所致H9C2心肌细胞氧化应激的影响 与对照组比较,阿霉素处理H9C2心肌细胞48h后SOD含量降低(P<0.05),MDA含量升高(P<0.05),细胞氧化应激水平升高;与阿霉素组比较,心脉隆注射液处理后SOD含量升高(P<0.05),MDA含量降低(P<0.05),缓解其细胞氧化应激状态,且呈现剂量依赖性。详见表2。

表2 心脉隆注射液对阿霉素所致H9C2心肌细胞氧化应激的影响(±s)
2.3 心脉隆注射液对阿霉素所致H9C2心肌细胞凋亡的影响 与对照组比较,阿霉素处理H9C2心肌细胞48h后Caspase-3活性升高(P<0.05);与阿霉素组比较,心脉隆注射液处理后Caspase-3活性降低(P<0.05),降低其细胞凋亡程度。Westernblot结果显示:阿霉素阿霉素处理H9C2心肌细胞48h后Caspase-3表达升高,而心脉隆注射液干预后Caspase-3表达降低。详见图1。

注:与对照组比较,*P<0.05;与阿霉素组比较,#P<0.05。A为Caspase-3活性检测;B为Western blot检测。
2.4 心脉隆注射液对阿霉素所致H9C2心肌细胞自噬的影响 与对照组比较,阿霉素处理H9C2心肌细胞48h后自噬相关蛋白LC3B绿色荧光聚集;与阿霉素组比较,心脉隆注射液处理后LC3B绿色荧光聚集减少。详见图2。

图2 心脉隆注射液对阿霉素所致H9C2心肌细胞自噬的影响
3 讨 论
阿霉素是临床广泛应用的广谱抗肿瘤药物,其嵌入DNA碱基对之间,阻止DNA依赖性RNA聚合酶的作用,干扰转录过程,抑制RNA的生成,阻止DNA的复制,属于细胞周期非特异性药物[5]。阿霉素抗肿瘤的临床效果显著,但由于其所导致心脏毒性效应而应用受限,目前临床上用于缓解阿霉素心脏毒性的药物仅有右丙亚胺[6],寻找合适的心脏保护药物是防治阿霉素心脏毒性的有效方法,更有利于阿霉素的临床应用和疗效。
阿霉素所致的心脏毒性机制尚不完全明确,氧自由基学说是较公认的致病机制之一[7]。细胞凋亡认为发挥重要作用,氧化应激或各种细胞内的改变均可能引起细胞凋亡,加重心肌细胞毒性。近年来,凋亡在阿霉素心脏毒性中的作用日益关注,拮抗心肌细胞凋亡认为是防治阿霉素所致心脏毒性的重要方法之一[8]。心脉隆注射液作为美洲大蠊中提取出的一种新型药物,其有效成分为复合核苷碱基及结合氨基酸等,临床上常用于心力衰竭的辅助治疗。近期研究表明心脉隆注射液可抑制缺氧导致新生大鼠心肌细胞凋亡[9],但对阿霉素导致心肌细胞凋亡的影响和作用机制尚未阐明。
本研究观察H9C2心肌细胞活性和氧化应激水平的改变,明确心脉隆注射液对阿霉素所致心肌细胞损伤的影响,结果显示阿霉素处理后心肌细胞活性明显抑制,心脉隆注射液能部分恢复阿霉素所引起的心肌细胞活性抑制,且呈现剂量依赖性。在氧化应激方面,阿霉素处理后心肌细胞SOD含量降低,MDA含量升高,心脉隆注射液干预能使细胞SOD含量升高,MDA含量降低,部分减轻阿霉素所致的心肌细胞氧自由基清除能力受损和脂质过氧化。证实心脉隆注射液能在一定程度上改善阿霉素所致的心肌细胞活性及氧化应激损伤[10]。
凋亡和自噬间存在复杂的交互调控,二者被多种应激刺激共同激活、互相协调和转化[11]。本研究表明阿霉素可导致H9C2心肌细胞凋亡相关分子Caspase-3的活性和表达增加,心脉隆注射液干预减少细胞凋亡程度;同时免疫荧光实验发现阿霉素导致H9C2心肌细胞自噬相关蛋白LC3B绿色荧光聚集,心脉隆注射液干预能减少阿霉素处理所引起的LC3绿色荧光的聚集。有研究报道,阿霉素所致的心肌毒性时自噬途径激活,但自噬清除途径出现障碍,细胞内有害物质聚积,导致心肌细胞凋亡和心功能的损伤[12]。提示心脉隆注射液可能通过促进自噬清除途径,减少细胞内有害物质聚积,减轻心肌细胞凋亡和细胞损伤。
综上所述,心脉隆注射液可减轻阿霉素所致心肌细胞损伤和氧化应激,发挥对阿霉素化疗后心脏毒性的防护作用。从机制上进一步考虑,心脉隆注射液通过促进自噬清除途径,减轻细胞内有害物质聚积导致心肌细胞凋亡和损伤,发挥对阿霉素心脏毒性的防护,为心脉隆注射液用于阿霉素心脏毒性的防治提供新思路和实验依据。
[1]CarvalhoC,SantosRX,CardosoS,etal.Doxorubicin:thegood,thebadandtheuglyeffect[J].CurrMedChem,2009,16(25):3267-3285.
[2]CarvalhoFS,BurgeiroA,GarciaR,etal.Doxorubicin-inducedcardiotoxicity:frombioenergeticfailureandcelldeathtocardiomyopathy[J].MedResRev,2013,34(1):106-135.
[3]QiJ,YuJ,TanY,etal.MechanismsofChineseMedicineXinmailong’sprotectionagainstheartfailureinpressure-overloadedmiceandculturedcardiomyocytes[J].SciRep,2017,7:42843.
[4] 胡长军.心脉隆注射液的研究进展综述[J].现代中药研究与实践,2013(4):86-87.
[5] 周荣,杨彩红,王强,等.两种给药方式建立阿霉素心肌病大鼠模型的评价[J].中西医结合心脑血管病杂志,2009,7(11):1315-1317.
[6]HarakeD,FrancoVI,HenkelJM,etal.Cardiotoxicityinchildhoodcancersurvivors:strategiesforpreventionandmanagement[J].FutureCardiol,2012,8(4):647-670.
[7]AngsutararuxP,LuanpitpongS,IssaragrisilS.Chemotherapy-inducedcardiotoxicity:overviewoftherolesofoxidativestress[J].OxidMedCellLongev,2015,2015(11):795602.
[8]KalyanaramanB,JosephJ,KalivendiS,etal.Doxorubicin-inducedapoptosis:implicationsincardiotoxicity[J].MolCellBiochem,2002,234-235(1-2):119-124.
[9] 张丽娜,钟荣梅,吴星恒.心脉隆注射液对缺氧缺血性脑损伤模型新生大鼠心肌细胞凋亡的影响[J].南昌大学学报(医学版),2010,50(4):22-26.
[10] 刘伟,段昕波,徐鑫.心脉隆注射液对阿霉素所致大鼠心脏毒性的预防效果及其作用机制研究[J].中西医结合心脑血管病杂志,2014,12(2):210-211.
[11]MarioG,NisosantanoM,BaehreckeEH,etal.Self-consumption:theinterplayofautophagyandapoptosis[J].NatRevMolCellBiol,2014,15(2):81-94.
[12]SishiBJN,BenjaminL,JacquesVR,etal.Autophagyupregulationpromotessurvivalandattenuatesdoxorubicin-inducedcardiotoxicity[J].BiochemPharmacol,2013,85(1):124-134.
R392 R285.5
A
10.3969/j.issn.1672-1349.2017.23.010
1672-1349(2017)23-2977-04
1.湖南省第二人民医院(长沙 410007);2. 湖南省人民医院/湖南省急救医学研究所
蒋宇,E-mailjiangyu146@hotmail.com
信息:袁李礼,蒋宇.心脉隆注射液对阿霉素所致心肌细胞损伤的保护机制研究J.中西医结合心脑血管病杂志,2017,15(23):2977-2980.
2017-09-15)
(本文编辑 薛妮)
——以心脉医疗为例

