应用哺乳动物细胞表面抗体展示技术构建动脉粥样硬化抗体库*
施黎银, 周 辉, 赵 明△
(1南方医科大学基础医学院病理生理学教研室, 广东 广州 510515; 2南方医科大学第三附属医院, 广东 广州 510630)
当今,心血管疾病逐年增高并越来越年轻化,而动脉粥样化则是心脑血管疾病的病理基础。动脉粥样硬化的发病机制至今仍在探索中,有多种学说从不同角度对它进行了阐述。近年来,越来越多的研究证明动脉粥样硬化是一种多因素作用的自身免疫性疾病,天然免疫和获得性免疫均参与了动脉粥样硬化的发生发展过程[1]。有研究发现[2]多种自身抗原参与了动脉粥样硬化的形成。目前已证实的氧化低密度脂蛋白(oxidized low-density lipoprotein, ox-LDL)是动脉粥样硬化形成过程中的重要抗原,具有高免疫原性,可以刺激机体产生ox-LDL抗体。LDL在致氧因子的作用下氧化形成ox-LDL,ox-LDL刺激巨噬细胞吞噬氧化低密度脂蛋白,进而堆积形成泡沫细胞。ox-LDL引起的炎症反应还可以引起血管内皮细胞功能紊乱,从而刺激中膜平滑肌细胞及肌源性泡沫细胞迁移至内膜,结合单核细胞上的Toll样受体4(toll-like receptor 4,TRL4),激活单核细胞,导致大量泡沫细胞的形成[3],最终形成动脉粥样硬化斑块。
大量实验表明ox-LDL刺激机体产生的ox-LDL抗体[4]与动脉粥样硬化进展有关。研究人员在雄性动脉粥样硬化小鼠模型中发现了ox-LDL抗体的滴度与动脉粥样硬化的进展呈正相关。第1个被发现的是E06(一个鼠IgM单克隆抗体),其次是鼠单克隆IgG MDA2抗体[5],经过MRI的检查,均证实了该抗体在动脉粥样硬化过程中确实起到了保护性作用。因此,用抗体来治疗动脉粥样硬化成为一个新的研究方向。
目前筛选人源抗体应用最广泛的技术包括噬菌体抗体展示技术[6]和哺乳动物细胞展示技术,噬菌体展示技术主要是将抗体融合在丝状噬菌体(filamentous phage)的外壳蛋白上,使抗体能够表达在噬菌体颗粒表面。通过数轮对抗体的筛选和富集,即可获得针对特定抗原的特异性单克隆抗体。但是,噬菌体展示技术不能筛选出全长抗体,只能得到例如抗原结合片段(fragment of antigen binding, Fab)或单链可变区抗体片段(single chain variable fragment, scFv)等抗体片段[7]。而且抗体的表达和修饰过程是在细菌中进行,如果将获得的抗体基因转入哺乳动物细胞,抗体要么无法表达,要么表达量极低。近年来,越来越多的研究锁定在利用哺乳动物细胞表面展示系统来获得人源抗体[8],它主要通过跨膜序列将全长抗体展示在细胞表面,从而可以通过流式细胞仪进行高通量筛选得到与抗原结合的抗体。所以,应用哺乳动物细胞表面展示系统可展示全长人源抗体,筛选得到的抗体的空间结构与天然抗体结构更为接近,全长双价抗体也可发挥抗体恒定区的效应功能[9]。因此,本研究旨在构建一个大容量的动脉粥样硬化抗体细胞库,以此筛选得到具有治疗作用的特异性的动脉粥样硬化抗体。
材 料 和 方 法
1 材料
本文中的外周血来自广东省人民医院心内科12名年龄大于60岁的动脉粥样硬化患者,这12名均为已确诊且需要行血管成形术和支架植入术的患者。载体pcDNA5/FRT、LipofectamineTM2000和Flp-InTM-CHO(FCHO)细胞购自Invitrogen;RNA提取试剂盒和DH5 α化学感受态细胞购买自北京天根生物技术有限公司;藻红蛋白(phycoerythrin, PE)标记的鼠抗人Kappa 链抗体购自BD,DMEM和血清购自HyClone,淋巴细胞分离液购自天津灏洋公司,Taq DNA聚合酶、限制性内切酶SfiI、BsmB I购自NEB;逆转录酶和T4 DNA连接酶购自Promega;质粒DNA回收试剂盒和DNA纯化试剂盒购自北京擎科生物科技有限公司;Hanm's-F 12培养基购自Life Technologies。
2 载体
载体pcDNA5/FRT包括CMV启动子,FLP重组酶(flippase,Flp)识别位点(flippase recognition target, FRT),氨苄青霉素(ampicillin,Amp)和潮霉素(Hygromycin, hygro)抗性基因,见图1。

Figure 1. Vector of pcDNA5/FRT.
3 方法
3.1分离外周血单个核细胞(peripheral blood mono-nuclear cells, PBMC) 抽取12名动脉粥样硬化患者静脉血分离PBMC并提取总RNA(参照说明书操作),以总RNA为模板,设计特异性引物[10]逆转录合成cDNA第1链。
3.2构建初级库载体及二级库双表达载体pcDNA-DHL
3.2.1构建载体pcDNA5-VH-TM和pcDNA5-CK 首先PCR扩增重链及跨膜序列(VH-TM)和轻链全长(CK),再用限制性内切酶XhoI和NheI酶切载体pcDNA5/FRT,利用重叠重组法分别将酶切后的载体和扩增片段拼接形成新的载体。将上述连接体系转化感受态大肠杆菌DH5α,克隆鉴定后,分别命名为pcDNA5-VH-TM和pcDNA5-CK,提质粒保存备用。
3.2.2二级库双表达载体pcDNA-DHL构建及验证 以载体pcDNA5-VH-TM和pcDNA5-CK分别为模板,利用PCR扩增出完整的HC-TM表达框、载体骨架和完整的Kappa表达框,通过重叠重组,转化,构建出双表达载体pcDNA-DHL,见图2。将瞬时转染质粒pcDNA-DHL的细胞作为阳性对照,将仅转染pcDNA5-CK的细胞作为阴性对照,将不转染质粒DNA的作为空白对照。同时共转染质粒pcDNA5-VH-TM + pcDNA5-CK的细胞作为阳性对照转染293F细胞。

Figure 2.Vector of pcDNA5-DHL.
3.3 构建动脉粥样硬化抗体基因库pDHL-As
3.3.1构建动脉粥样硬化全人源初级重链抗体库pcDNA-vh和初级轻链抗体库pcDNA-ck 以cDNA第1条链为模板,用相应引物PCR扩增抗体全套Kappa轻链和重链可变区基因。用限制性内切酶AgeI和XhoI酶切轻链全长基因的扩增产物及载体pcDNA5-CK,回收酶切后片段,用T4 DNA连接酶按3∶1 比例混合连接,在16 ℃反应24 h后导入感受态DH5α,构建轻链基因初库pcDNA-ck。将转化后的细菌倍比稀释,均匀涂在含100 mg/L 氨苄青霉素的LB固体平皿上,倒置于37 ℃孵箱12~18 h,计数平皿上的菌落数,并计算出轻链的库容量。将平皿上的所有菌落收集起来,即为轻链抗体基因库。以同样的方法构建重链基因初库pcDNA-vh。分别从重、轻链抗体库中各挑50个单克隆扩大培养,小提质粒,送华大基因测序并软件分析序列。
3.3.2动脉粥样硬化二级抗体基因库pDHL-As的构建 用内切酶SfiI酶切后可用于插入抗体轻链的全长基因片段,用BsmB I酶切后可用于插入抗体重链的可变区基因片段。同时以BsmB I和SfiI对载体pcDNA-DHL进行双酶切,经1%琼脂糖凝胶电泳鉴定,并分离纯化5 kb和3 kb的两段目的片段。再用SfiI和BsmB I分别对前面制备好的轻链和重链基因初库进行酶切,进行DNA的凝胶电泳分离纯化备用。将上面获得的2个载体片段、1个轻链全长片段和1个重链可变区片段按1 ∶1 ∶ 3 ∶3分子比例混合,用T4DNA连接酶,16 ℃连接24 h,将连接产物转入感受态细菌DH5α,转化后的细菌接种于含有100 mg/L氨苄青霉素的LB固体平皿上,倒置于37 ℃孵箱12~18 h,计数平皿上的菌落数,并计算出库容量。
3.3.3抗体基因稳定转染Flp-InTM-CHO细胞 将处于对数生长期的Flp-InTM-CHO细胞以每孔5×105个的密度接种于6孔板中,12 h后换新鲜培养基。4 μg混合质粒(0.4 μg PDHL质粒+3.6 μg poG44质粒加入250 μL opti-MEM培养基中,充分混匀后往里加8 μL LipofectamineTM2000脂质体,混匀室温放置20 min,将混合物加入对应的6孔板中,4 h后换液并培养48 h,加入含500 mg/L潮霉素培养基加压筛选,每2天换1次液,筛选2周后收集生长状态好的活细胞保存备用。
3.4抗ox-LDL抗体的筛选及初步鉴定 我们选择ox-LDL作为抗原来筛选出特异性抗体。根据FITC标记试剂盒的说明书,用FITC标记ox-LDL,常规培养动脉粥样硬化抗体细胞库,用不含胰酶的细胞消化液进行消化回收后用PE标记鼠抗人抗体和FITC标记ox-LDL进行双染,随后经流式细胞分选仪检测、分选表达抗ox-LDL抗体的FCHO细胞。
结 果
1 外周血单个核细胞总RNA的提取
抽取动脉粥样硬化患者的外周血,经淋巴细胞分离液分离出PMBC。按TRIzol试剂说明书操作,提取总RNA,并用1%琼脂糖凝胶电泳验证RNA完整性,做了3个批次,可见3条清晰的28 s、18 s和5 s条带,说明提取的总RNA完整性较好,见图3。
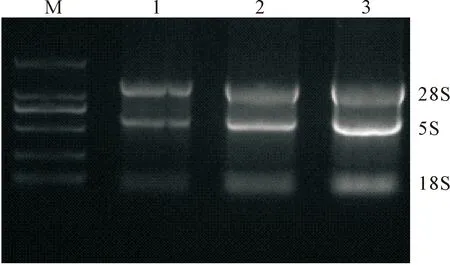
Figure 3.Total RNA extracted from PBMCs.Three different batches. M: Marker; 1~3: 3 different batches.
2 PCR扩增重链及跨膜序列(VH-TM)片段和轻链全长(CK)
PCR扩增得到的VH-TM长约为1 600 bp, CK约为800 bp左右,分别连接至载体pcDNA-FRT,构建载体pcDNA5-VH-TM和pcDNA5-CK,见图4。
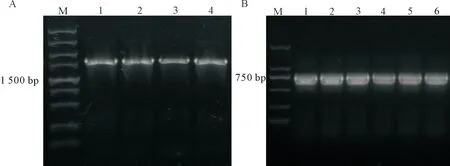
Figure 4.PCR results for constructed fragmentVH-TM and fragment CK. A: 1~4 PCR amplification of the genes fragment of VH-TM;B: 1~6 PCR amplification of the genes fragment of CK. M: marker.
3 双表达载体pcDNA-DHL的酶切鉴定
用限制性内切酶sfiI、BsmB I酶切验证重组载体pcDNA-DHL是否正确,酶切后片段大小各为800bp、4 900 bp、400 bp、2 700 bp,见图5。
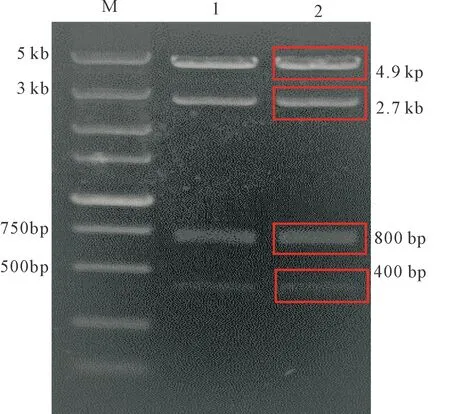
Figure 5.The vector pcDNA-DHL digested by Sfi I and BsmB I. We get four fragments. M: Marker; 1~2: two identical samples.
4 二级双表达载体pcDNA-DHL在293F细胞表面展示
双表达抗体基因库(pcDNA-DHL)转染293F细胞,使用流式细胞仪分析全长抗体库在293F细胞表面的展示,结果显示,用pcDNA5-VH-TM和pcDNA5-CK共转染的293F细胞可以检测到阳性细胞总量为27%,见图6B,转染了pcDNA-DHL的293F细胞可以检测到阳性细胞总量为39.2%,见图6D。说明全长抗体可以成功地展示在293F细胞的表面。
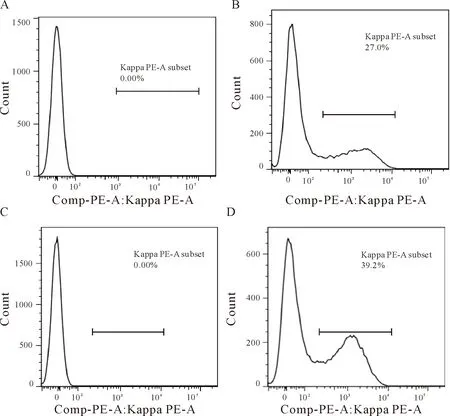
Figure 6.FACS analysis of antibody library expression on 293F cell surface.A: negative control (non- transfected 293F cells); B:positive control (pcDNA5-VH-TM and pcDNA5-CK co-transfected 293F cells); C: 293F cells transfected with pcDNA5-CK and labeled with PE-Kappa;D: 293F cells transfected with pcDNA-DHL and labeled with PE-Kappa.
5 抗体基因的扩增
将重链可变区(VH)产物和轻链(CK)基因产物,在琼脂糖凝胶电泳中可见约0.38 kb的重链可变区条带和0.70 kb Kappa轻链条带,为目标条带,见图7。
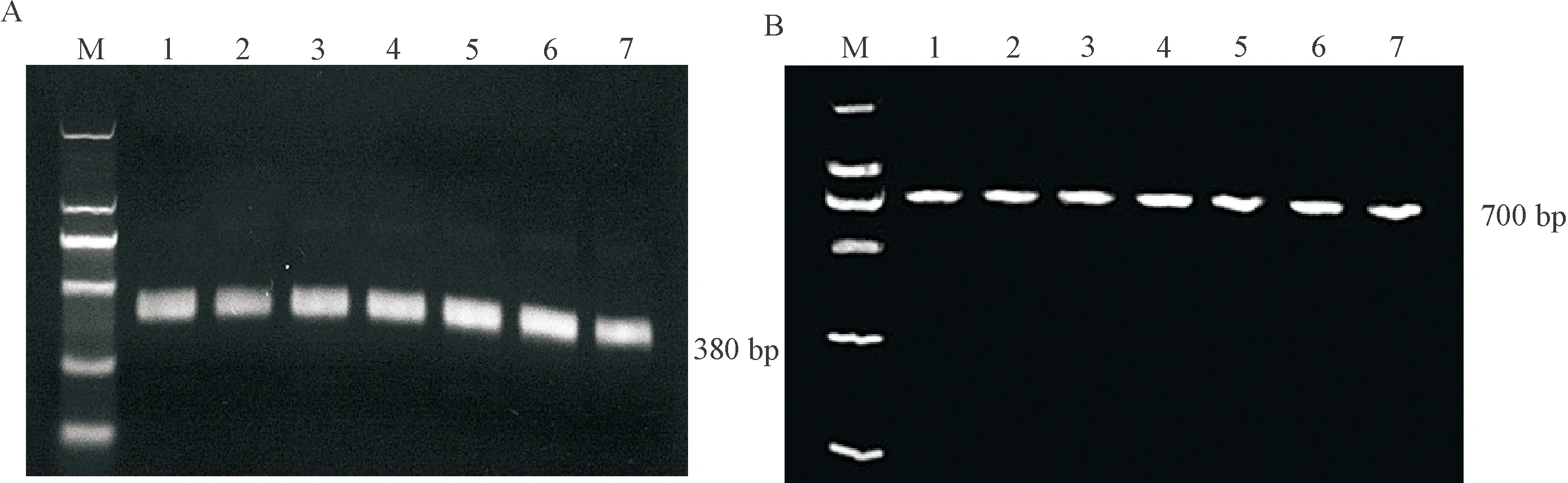
Figure 7.PCR amplification of the genes encoding the light and heavy chains of human antibodies. A: heavy chain variable region; B: Kappa chain. 1~7: 7 different batches. M: Marker.
6 轻、重链抗体初库的构建,库容量的计算与测序结果分析
将酶切后的重、轻链PCR产物,分别插入载体pcDNA5-VH-TM和pcDNA5-CK,并导入感受态DH5α。计数在带有氨苄青霉素抗性的LB固体平皿上的菌落数,即可计算出所构建的抗体基因初库容量。结果显示,重链基因初库容量为1.79×105,轻链基因初库容量为1.80×105。分别随机挑选出50个轻链单克隆和50个重链单克隆,进行测序分析。再分别从重链轻链的50个克隆中挑选出20个测序结果分析,结果如图所示,20个重链克隆中有16个克隆含有正确的阅读框架;20个轻链克隆有18个克隆含有正确的阅读框架。理论上抗体库多样性为2.32×1010[(1.79×105×80%)×(1.8×105×90%)],见图8。
Figure 8.Analysis for the sequences of the regions of the healy chains (A) and light chains (B).
7 动脉粥样硬化抗体基因库的构建
酶切后的重、轻链初库产物,酶切后的载体pcDNA-DHL片段,利用四片段连接法连接后,转化入感受态DH5α。计数在含有氨苄青霉素抗性的LB固体平皿上的菌落数,即可获得所构建的抗体基因库容量。结果显示双表达抗体基因库容量为1.81×105。
8 全长抗体在Flp-InTM-CHO细胞表面的表达
将抗体库质粒DNA与质粒poG44共转染Flp-InTM-CHO细胞,然后用流式细胞仪分析抗体在Flp-InTM-CHO表面的表达情况,结果显示,17.1%的细胞表面可检测到抗体的表达,见图9。
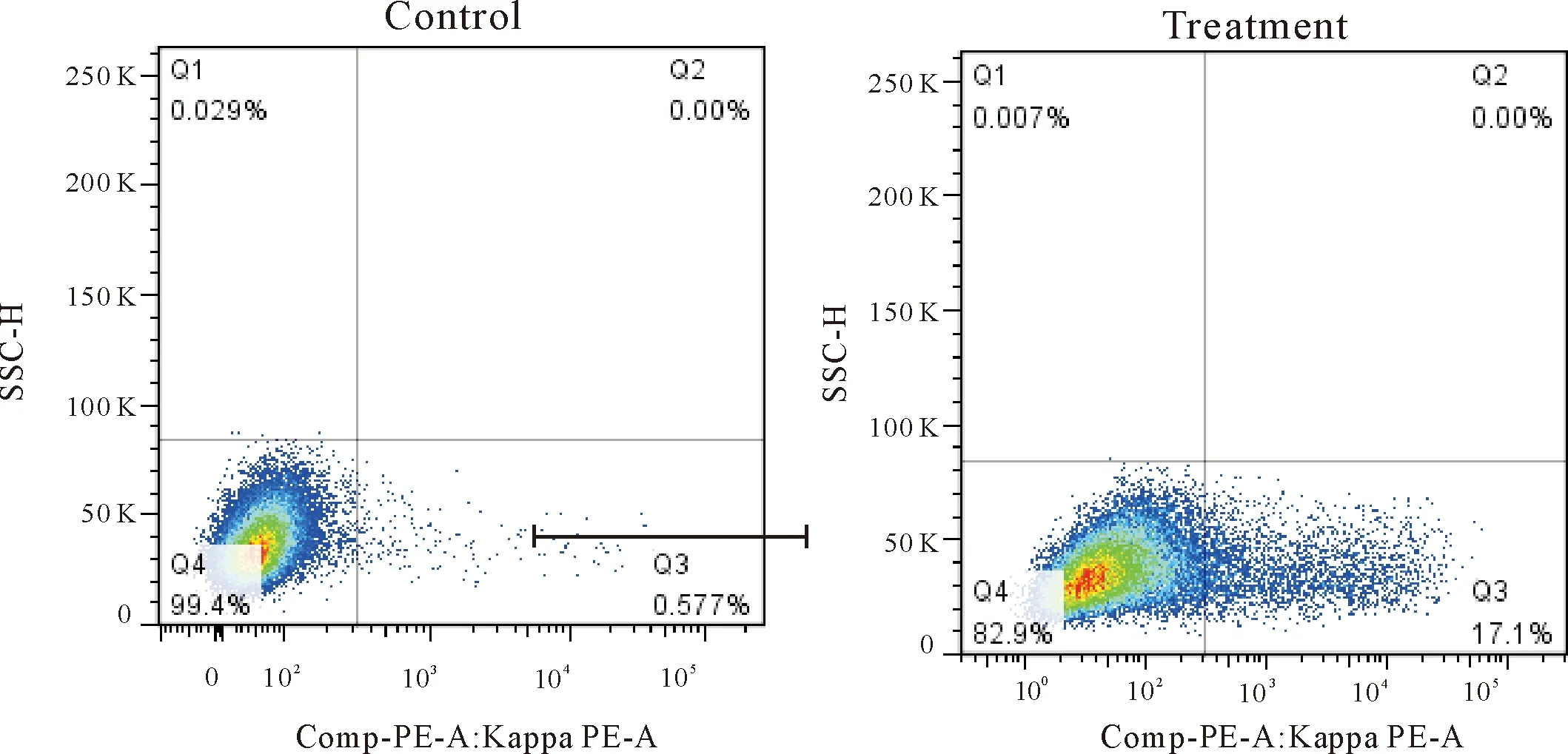
Figure 9.Flow cytometry for detecting the expression of human antibodies on Flp-InTM-CHO cell surface.
9 抗ox-LDL抗体的筛选及初步鉴定
用PE标记的鼠抗人抗体和FITC标记的ox-LDL进行双染,随后经流式细胞分选仪分选出45个表达抗ox-LDL抗体的FCHO细胞,见图10。

Figure 10.The PE and FITC double positive cells were sort by flow cytometry. A: control; B: treatment.
讨 论
血管内的免疫反应可致动脉粥样硬化发生已被广泛接受,科学家们便研究是否可以利用这方面的知识来开发治疗心血管疾病的新方法。ox-LDL也成为研究热门的靶点之一,其中之前研究较为深入的ox-LDL治疗抗体BI-206,已在小鼠[11]和恒河猴[12]等动物模型中展示了对动脉粥样硬化的良好治疗效果,但在2015年的二期临床试验(使用)结果中却无明显疗效。其中的潜在的原因可能是因为这个抗体是在从单链抗体噬菌体库(n-CoDeR)筛选出来的,使用的是噬菌体展示技术。由于筛选过程是在细菌中进行,原核表达和哺乳动物细胞中表达存在一定差异,抗体的空间结构未必与天然抗体结构相似,故筛选出的抗体在后续应用中可能存在一定劣势。哺乳动物细胞表面展示系统可展示全长人源抗体,筛选到的抗体空间结构与天然抗体结构更为接近,在动物、临床研究中的治疗效果应该更具优势,故本研究使用哺乳动物细胞表面展示系统筛选ox-LDL抗体。
为保证抗体库的特异性,选择的PBMCs来源于大于60岁的动脉粥样硬化患者外周血。其次,为保证PBMCs中抗体基因的完整性,减少特异性抗体基因的丢失,提取RNA后检测RNA质量符合要求方可进入后续实验。此外构建双启动子表达载体pcDNA-DHL的目的是一次性同时转入轻链和重链载体,减少因多次转染导致的同一个CHO细胞同时转入多个轻链载体或重链载体。本研究通过改造载体pcDNA5-FRT,使得我们构建的二级双表达载体上带有FRT位点和潮霉素抗性基因。我们同时转染pcDNA5/FRT和poG44两个质粒,poG44会表达Flp重组酶,pcDNA5/FRT带有目的基因。在Flp重组酶的催化下,pcDNA5/FRT上的FRT位点和染色体上已经存在的FRT位点发生重组,将质粒上的目的基因重组到细胞染色体上,从而实现目的基因的组成型表达。经过潮霉素的筛选和淘汰[13],从而实现一个细胞展示一种抗体。双表达载体pcDNA-DHL中抗体基因表达结构包含启动子、FLP重组酶识别位点FRT及血小板衍生生长因子受体跨膜序列(plateletderived growth factor receptor trans- membrane,PDGFR-TM)。载体重链尾部加上跨膜序列TM,使抗体可以展示在细胞膜表面。再用流式进行抗体库的筛选,抗轻链抗体标记,即可获得全长抗体在细胞表面的表达情况[14]。
利用此抗体库,用ox-LDL作为抗原,筛选出了45个跟ox-LDL亲和力高的细胞,接下来,我们将从这45个细胞里筛选出可稳定表达抗体的单克隆细胞株,扩大培养,表达抗体,以供后续的细胞和动物实验。由于抗体片段与载体连接效率,细菌转化效率,细胞转染效率等步骤的实际操作存在限制,导致抗体库的容量局限在105左右,因而,本研究可以选择电转化来提高转化效率,在现有的基础上提高连接效率等,筛选出更大库容量的抗体库。
——一道江苏高考题的奥秘解读和拓展

