Npc1基因突变引起脂质代谢异常从而诱导肾脏细胞凋亡并促进纤维化*
牛俪丹, 杨记超, 管丽红, 杜 江, 乔 梁, 刘彦礼△, 林俊堂, 3, 4
(新乡医学院 1生物医学工程学院, 2干细胞与生物治疗技术研究中心, 3精神与神经研究院, 4生命科学技术学院, 河南 新乡 453003)
尼曼-匹克病(Niemann-Pick disease)属于常染色体隐性遗传病,以先天性糖脂代谢障碍为特征,累及患者全身脏器[1-3];其临床发病率约为1/25 000,主要分为4种类型:A、B型属于神经鞘磷脂酶缺乏或活性不足,而C、D型属于细胞内胆固醇代谢运输障碍。目前研究发现95%的C1型尼曼-匹克病(Niemann-Pick disease type C1,NPC1)患者源于第18对染色体上的Npc1基因突变,引起细胞内胆固醇累积,并随患者年龄增长而导致机体脂质代谢异常加剧[1-4]。NPC1具有致命性,早期临床症状不明显,极易被误诊,患者多在3~7岁出现神经系统症状,多数患者死于青少年期[2-6]。
已有研究证明,Npc1基因突变小鼠的病理改变和临床症状与NPC1患者极为相似,是研究NPC1发病机制的合适动物模型。Npc1基因突变小鼠与NPC1患者成纤维细胞中均存在脂质与胆固醇异常沉积,并出现细胞损伤自噬[7];且Npc1基因突变小鼠较正常小鼠嗅觉神经元凋亡显著增多[8]。目前,NPC1相关研究多集中在神经系统和肝脾器官等[9-13],而Npc1基因突变对肾脏的影响鲜有报道。因此,本研究主要通过观察与检测Npc1基因突变对小鼠肾脏功能与相关病理特征的影响,以期为临床上对NPC1患者的管理和用药提供参考资料。
材 料 和 方 法
1 实验动物
SPF级Npc1+/-小鼠(BALB/cNctr-Npc1m1N/J)由浙江大学段树民院士课题组馈赠。选取8周龄Npc1+/-雄鼠与Npc1+/-雌鼠按雄雌比例1∶2合笼, 交配得子鼠,基因鉴定后,按雄雌比例3∶2选取Npc1+/+和Npc1-/-小鼠各5只,养至2月龄。本研究所用实验动物均饲养于SPF环境中,温度20~25 ℃, 相对湿度35%~65%, 换气25次/h,12 h/12 h明暗交替,基因鉴定方法参考文献[14]。
2 实验试剂
苏木素和油红O均购自Sigma;伊红Y(水溶性)购自国药集团;TUNEL细胞凋亡检测试剂盒和BCA蛋白浓度测定试剂盒均购自碧云天公司;SDS-PAGE凝胶制备试剂盒购自索莱宝公司;抗Bax、Bad和Bcl-2抗体购自博士德公司;抗α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)、波形蛋白(vimentin)和GAPDH单克隆抗体及相关Ⅱ抗购自Cell Signaling Technology(CST);硝酸纤维素膜购自Millipore。
3 主要方法
3.1肾脏组织分离采集 取出生后第60天(postnatal day 60,P60)的Npc1+/+和Npc1-/-小鼠各5只,乙醚麻醉后,快速分离肾脏并置于10%中性福尔马林固定,常规脱水后部分进行石蜡包埋切片(4 μm),苏木素-伊红(HE)染色,观察肾脏组织形态;部分肾脏组织进行常规冰冻切片(4 μm),进行下一步的油红O染色、TUNEL凋亡染色以及α-SMA和vimentin免疫荧光染色。剩余组织冻存于-80 ℃冰箱进行Western blot检测。本实验小鼠处理和实验步骤按照新乡医学院医学与实验动物委员会的指导方针进行。
3.2HE染色 将石蜡切片依次放入二甲苯Ⅰ(10 min)、二甲苯Ⅱ(10 min)、无水乙醇Ⅰ(5 min)、无水乙醇Ⅱ(5 min)、95%乙醇(3 min)、90%乙醇(3 min)、80%乙醇(2 min)、70%乙醇(2 min),然后蒸馏水浸洗2 min。切片入Mayer氏苏木素染液染色5~7 min,双蒸水浸洗返蓝,风干后中性树胶封片。光学显微镜下观察肾组织形态结构变化,并进行图像采集。
3.3油红O染色 冰冻切片用甲醛-钙固定10 min后蒸馏水浸洗,60%异丙醇浸洗,油红O染液染10 min,60%异丙醇分色至背景无色,蒸馏水洗。Mayer苏木素复染5~7 min,自来水洗(蓝化)1~3 min;蒸馏水洗后水溶性封片剂封片。光学显微镜下观察,并进行图像采集。
3.4TUNEL染色 取冰冻切片,按试剂盒所示步骤进行操作,检测肾小管细胞凋亡及坏死状况,并进行凋亡细胞数计数。共聚焦显微镜下观察并进行图像采集,每张切片随机选取10个视野,计算每个视野内平均阳性细胞数,进行统计分析。
3.5Western blot BCA法定量后,SDS-PAGE分离后将蛋白转移至PVDF上,5%脱脂奶粉室温封闭1 h;含吐温20的TBS(TBST)洗膜后,分别加入Bax、Bad和Bcl-2 Ⅰ抗(1∶1 000稀释),4 ℃孵育过夜;TBST洗3次后加入相应Ⅱ抗(1∶2 000稀释),室温孵育2 h,TBST浸洗后进行ECL反应曝光,并进行图像采集。对所采集图像通过ImageJ软件分析目的蛋白与内参蛋白(GAPDH)灰度值,进行统计分析。
3.6免疫荧光 取冰冻切片,体积分数0.4%的Triton透膜15 min,5%山羊血清封闭60 min,分别滴加α-SMA及vimentin单克隆抗体(1∶100稀释),4 ℃孵育过夜后加入相应荧光Ⅱ抗,室温孵育90 min,共聚焦显微镜观察,并在同一曝光强度下进行图像采集。将所采集图像利用ImageJ软件转为黑白格式,通过计算灰度值来半定量图片中荧光强度和荧光面积,并进行统计分析。
4 统计学处理
所有检测数据以均数±标准差(mean±SD)表示,组间均数比较采用Student’st检验,用SPSS 13.0软件完成统计,以P<0.05为差异有统计学意义。
结 果
1 Npc1基因突变导致小鼠肾脏组织形态及脂质代谢异常
截止P60取材前,Npc1+/+组小鼠饮食、排泄正常,活动灵敏;而Npc1-/-组小鼠反应逐渐迟钝,精神萎靡,至生长后期,体型消瘦、排尿出现异常。P60取材,与Npc1+/+组小鼠相比,Npc1-/-组小鼠肾脏体积缩小而质地坚韧。随后肾脏HE染色结果显示,Npc1+/+组小鼠肾脏中肾小球结构正常,间质细胞无过度增生肥大;而Npc1-/-组小鼠肾组织出现明显的空泡(图中黑色箭头所示),见图1。进一步,油红O染色结果显示,Npc1+/+组小鼠肾脏组织脂质染色阳性,细胞脂质正常,可见鲜红色脂滴沉积(图2C中黑色箭头所示),而Npc1-/-组小鼠肾组织中无明显脂质沉积,见图2。

Figure 2.Oil red O staining results showed no lipid deposition in the renal tissue of Npc1-/- mice. A and C: oil red O staining was performed to examine the lipid deposition in the renal tissue of Npc1+/+ mice (scale bar = 25 μm), and the red lipid droplets were clearly observed and uniformly distributed (indicated by black arrow);B and D: compared with Npc1+/+ mice, no lipid droplet was observed in the renal tissue of Npc1-/-mice, which suggested that the mutation of Npc1 gene could lead to abnormal lipid metabolism in kidney cells (scale bar=25 μm).
2 Npc1基因突变促进小鼠肾脏细胞显著凋亡
TUNEL染色结果如图3A中白色箭头所示,P60Npc1+/+组小鼠肾脏细胞仅存在极少量凋亡细胞,而Npc1-/-组小鼠肾脏细胞中,TUNEL阳性细胞显著增多(P<0.01),见图3A、B; Western blot结果显示,与Npc1+/+组小鼠相比,Npc1-/-小鼠组肾脏组织中促凋亡蛋白Bax与Bad的表达均显著增加(P<0.01),而抗凋亡蛋白Bcl-2的表达则显著下降(P<0.05),见图3C、D。
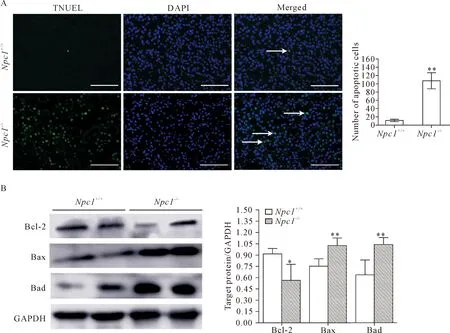
Figure 3.Npc1 gene mutation induced significant apoptosis of renal cells in mice. A: TUNEL staining was used to detect the apoptosis of kidney cells in mice, and the apoptotic cells were indicated by white arrows (scale bar = 25 μm); B: Western blot was used to examine the protein expression of Bcl-2, Bax and Bad. Mean±SD. n=5. *P<0.05, **P<0.01 vs Npc1+/+ group.
3 Npc1基因突变增加小鼠肾脏组织纤维化
在发育成熟的肾脏组织中,α-SMA阳性表达常见于病理情况下,而vimentin阳性表达常见于间充质细胞及成纤维细胞中。免疫荧光检测结果示,Npc1+/+组小鼠肾脏细胞中α-SMA和vimentin阳性表达细胞较少,而Npc1-/-组小鼠肾脏细胞中α-SMA及vimentin阳性表达细胞的荧光表达强度和面积均显著增高(P<0.01),见图4。

Figure 4.Npc1 gene mutation promoted the fibrosis of renal tissues in mice. Immunofluorescence was used to detect the expression of α-SMA (A) and vimentin (B) in renal tissue of mice, and the α-SMA/vimentin positive cells were indicated by white arrow (scale bar=25 μm). Mean±SD. n=5. **P<0.01 vs Npc1+/+ group.
讨 论
以脂质代谢异常为病理特征的NPC1患者,临床表现常以神经系统异常为主,并伴随骨髓和肝脏出现标志性泡沫细胞[15-16],故神经系统病变常作为目前主要的研究方向和临床治疗侧重点[9-11]。除神经系统病变外,临床上亦有报道NPC1成人患者出现严重肾损伤[17],而长期病理状态会导致的肾小管上皮细胞不可逆凋亡, 是引起肾纤维化的重要机制之一[18]。同时,凋亡导致大量实质细胞的减少,促进组织结构重塑并参与组织纤维化发展[19-20]。此外,本课题组前期研究发现与P60的Npc1+/+小鼠相比,Npc1-/-小鼠的体重和肾脏重量显著降低,肝肾功能明显减退,且出现衰老现象[14]。
而本实验进一步显示Npc1-/-小鼠肾脏组织出现大量空泡,油红O染色结果阴性,确认Npc1基因突变可导致肾脏细胞脂质代谢异常;而脂质代谢异常进一步促进Npc1-/-小鼠肾脏细胞发生明显凋亡;并且肾脏组织中抗凋亡蛋白显著降低,促凋亡蛋白显著增加,表明Npc1基因突变可导致肾脏功能和形态学异常。此外,在正常肾组织中α-SMA和vimentin表达水平较低[21],但Npc1-/-小鼠肾脏组织中二者表达量显著增加。而α-SMA和vimentin作为间充质细胞和肌成纤维细胞的重要标志物,与组织纤维化有着密切联系,该结果提示Npc1-/-小鼠组肾脏组织中存在大量间质细胞及成纤维细胞,且间充质细胞可转分化为肌成纤维细胞,最终促进肾脏组织纤维化。基于上述实验结果推测Npc1基因突变导致的肾脏组织中脂质代谢异常,随后损伤肾脏细胞促进细胞凋亡,导致肾功能减退,并加重肾脏组织纤维化。深入研究Npc1基因突变导致肾脏细胞凋亡并促进纤维化发生的潜在机制,将为NPC1的治疗提供参考资料。
综上所述,本研究结果表明Npc1基因突变可导致肾脏细胞凋亡并促进肾脏组织纤维化,该结果可为NPC1患者的治疗提供借鉴。而临床上除关注NPC1患者神经系统病变治疗外,也应对患者其他脏器(如肾脏)的功能异常进行相关干预治疗,系统性改善患者机体功能,延缓机体全身性损伤,提高患者生存质量。

