曲格列汀诱导高糖条件下肾系膜细胞表达HO-1*
伍先明, 李爱琼, 周丽丽, 彭小珊, 李 坚
(郴州市第一人民医院 1老年病科, 2儿童医院,湖南 郴州 423000; 3重庆青年职业技术学院,重庆 400712; 4湘南学院基础医学院,湖南 郴州 423000)
糖尿病肾病(diabetic nephropathy,DN)是糖尿病患者最常见的并发症之一,其机制非常复杂,高血糖诱导活性氧簇(reactive oxygen species,ROS)生成导致的氧化应激是重要的发病因素[1]。正常情况下机体内存在多重抗氧化应激系统拮抗病理生理条件下的氧化应激损伤,其中以核因子E2相关因子2(nuclear factor E2-related factor 2,Nrf2)-血红素氧合酶 1(heme oxygenase-1,HO-1)系统最重要。HO-1是哺乳动物体内参与血红素代谢的一种多种功能氧化酶。研究表明,HO-1不但能降解血红素为一氧化碳,胆绿素和Fe2+发挥抗氧化活性,也参与了肾髓质微循环。在高糖所致氧化应激中,机体可代偿性诱导HO-1的表达从而抗细胞氧化应激损伤[2]。对于糖尿病患者而言,即便血糖控制得到改善,ROS介导的血管应激反应持续存在依然可引起持续性的血管损伤[3-4],因此采用药物诱导抗氧化应激基因如HO-1的表达,有望改善糖尿病肾病的治疗效果。胰高血糖素样肽1(glucagon-like peptide-1,GLP-1)是肠道L 细胞分泌的一种激素,GLP-1主要发挥稳定血糖的作用,并能改善高糖条件下的血管内皮功能,生理情况下GLP-1的半衰期非常短,能迅速被二肽基肽酶4(dipeptidyl peptidase-4,DPP-4)降解。临床上对于2型糖尿病患者的治疗策略主要是通过抑制DPP-4活性或使用GLP-1类似物来增加肠促胰岛素反应[5]。除此之外,某些DPP-4抑制剂也显示出抗氧化能力[6]。曲格列汀是由日本武田公司最近开发的一种DPP-4抑制剂[7- 8]。然而迄今为止曲格列汀是否也像其它DPP-4抑制剂一样具有抗氧化应激活性仍不清楚。本研究旨在探讨曲格列汀对高糖条件下人肾系膜细胞(human renal mesangial cells,HRMCs)表达HO-1的影响,并初步探讨其机制。
材 料 和 方 法
1 主要实验材料
人肾系膜细胞由中国科学院干细胞库提供。曲格列汀购自Takeda;RNA提取试剂盒购自Qiagen。鼠抗人Nrf2抗体购自Santa Cruz;抗Akt磷酸化抗体购自Cell Signaling。siRNA由广州瑞博公司合成。
2 方法
2.1细胞培养与分组 HRMCs用含10%热灭活的胎牛血清、5×104U/L青霉素和50 mg/L链霉素的DMEM培养基,于37 ℃、5% CO2条件下培养。待细胞生长到视野80%~90%密度时,弃培养基,加入5 mL无菌PBS漂洗3次,经胰酶消化后,加入新鲜培养基并按照比例进行传代。本研究用的HRMCs传代次数在25~30次。实验分为对照组、高糖组及曲格列汀干预组,其中对照组的葡萄糖浓度为5 mmol/L,高糖组的葡萄糖浓度为25 mmol/L,曲格列汀干预组在高糖组的基础上分别加入浓度为1、5和10 μmol/L的曲格列汀作用24 h。
2.2RT-qPCR检测HO-1 mRNA的表达 采用Qiagen公司提供的RNA提取试剂盒提取细胞总RNA。随后将其逆转录为从cDNA后,采用实时定量PCR分析HO-1 mRNA的表达。HO-1的上游引物序列为5’-AGAGCCTGCAGCTTCTCAGA-3’, 下游引物序列为5’-ACAAAGTCTGGCCATAGGAC-3’; GAPDH的上游引物序列为5’- CCACTCCTCCACCTTTGAC-3’,下游引物序列为5’- ACCCTGTTGCTGTAGCCA-3’。扩增反应于ABI Prism 7900上进行,结果用2-ΔΔCt表示。
2.3Western blot分析蛋白表达 HRMCs处理结束后,加入RIPA裂解液,冰上裂解30 min;12 000 r/min、4 ℃离心20 min,上清即为总蛋白。对于核蛋白提取,使用Pierce提供的试剂盒提取细胞核总蛋白。随后获取各处理组蛋白进行SDS-PAGE并转印至硝酸纤维素膜上。经封闭和洗膜后,根据实验目的的不同,分别用抗HO-1、p-Akt、total-Akt、Nrf2和β-actin(Santa Cruz)孵育。随后用HRP标记的II抗孵育,最后经化学发光、显影,并用ImageJ软件进行灰度扫描。
2.4HO-1活性的测定 经处理后的HRMCs用PBS洗涤,然后超声离心(18 000×g,10 min,4 ℃),所得微粒体颗粒再悬浮于冰冷磷酸钾缓冲液(100 mmol/L)中。上清蛋白(1 mg)与含小鼠肝细胞溶胶(1 mg蛋白)、50 μmol/L血红素、1 mmol/L NADPH、2 mmol/L葡萄糖-6-磷酸和0.2 U葡萄糖-6-磷酸脱氢酶的混合物在pH 7.4的100 mmol/L磷酸钾缓冲液中,避光孵育1 h。然后用1 mL氯仿提取胆绿素,并用酶标仪测定其吸光度。HO-1活性以每毫克蛋白每小时形成的胆红素表示。
2.5ROS生成的测定 以H2DCF-DA为荧光探针,用荧光法测定ROS的生成。即,细胞在37 ℃下用探针孵育30 min,PBS漂洗后用荧光分光光度计分别在485 nm和538 nm的激发和发射波长下分析细胞荧光强度。
2.6RNA干扰实验 采用Mirus公司提供的TransIT-TKO试剂沉默HRMCs中的Nrf2。简言之,使用TransIT-TKO试剂将Nrf2特异性siRNA转染至培养的HRMCs中(每孔2.5×105个)。转染后24 h更换为无血清培养基用于下一步实验。本研究使用的siRNA序列是为5’-GAGUAUGAGCUGGAAAAACdTdT-3’和5’-GUUUUUCCAGCUCAUACUCdTdT-3’,siRNA由广州瑞博合成;用于阴性对照的nontarge-ting siRNA购自Dharmacon。
3 统计学处理
应用SPSS 18.0统计软件进行统计分析。所有数据以均值±标准差(mean±SD)表示,采用单因素方差分析 (one-way ANOVA)后应用SNK-q检验进行各组均数间两两比较。以P<0.05,为差异有统计学意义。
结 果
1 不同浓度曲格列汀对HO-1表达及酶活性的影响
首先我们采用RT-qPCR检测了不同浓度曲格列汀对HRMCs中HO-1 mRNA表达的影响,结果显示,与5 mmol/L葡萄糖浓度组相比,25 mmol/L高糖培养后的HRMCs中HO-1 mRNA表达仅轻微增高,而同时给予1、5和10 μmol/L曲格列汀作用12 h可明显上调HO-1的mRNA表达水平(P<0.05),见图1A。同时,Western blot也显示曲格列汀处理24 h后的HRMCs内HO-1蛋白表达水平也显著增高(P<0.05),见图1B,同时,HO-1的酶活性也随着曲格列汀浓度的增高而增高(P<0.05),见图1C。
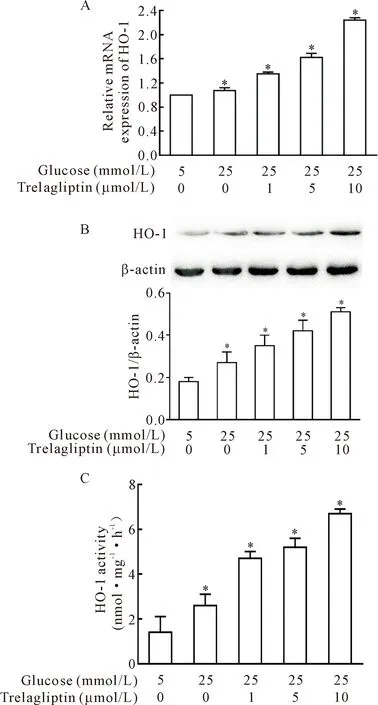
Figure 1.Effect of trelagliptin at different concentrations on mRNA expression (A), protein expression (B) and enzyme activity (C) of HO-1. Mean±SD. n=3. *P<0.05 vs 5 mmol/L glucose group.
2 曲格列汀诱导HO-1表达与细胞内ROS有关
HRMCs在25 mmol/L葡萄糖作用下,细胞内ROS的荧光强度仅轻微增高,而采用1、5和10 μmol/L曲格列汀作用8 h后,HRMCs内ROS的荧光强度明显高于对照组(P<0.05)。此外,给予ROS清除剂N-乙酰基-L-半胱氨酸(N-acetyl-L-cysteine,NAC)10 mmol/L预处理1 h后,可明显抑制曲格列汀诱导的HO-1表达(P<0.05),见图2。
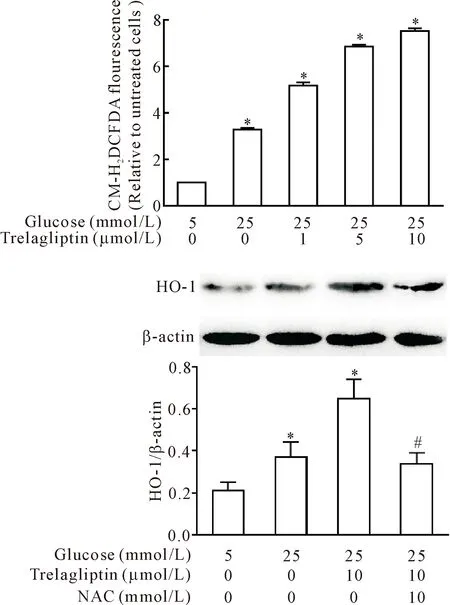
Figure 2.The effects of trelagliptin on the production of ROS in the HRMCs with high glucose culture. Mean±SD. n=3. *P<0.05 vs 5 mmol/L glucose group; #P<0.05 vs 25 mmol/L glucose+trelagliptin group.
3 曲格列汀通过PI3K/Akt通路诱导HO-1表达
为了观察高糖条件下曲格列汀对PI3K/Akt通路的影响,本研究首先采用Western blot检测了不同浓度曲格列汀对Akt磷酸化的影响。结果显示,1、5和10 μmol/L曲格列汀作用HRMCs 8 h后,Akt的磷酸化水平明显上调(P<0.05),见图3A。为了探究PI3K/Akt是否参与HO-1的表达,我们采用PI3K特异性抑制剂LY294002预处理HRMCs 1 h,Western blot结果显示,HO-1表达水平明显减少(P<0.05),见图3B。
4 曲格列汀经ROS和PI3K/Akt激活核转录因子Nrf2
为了观察曲格列汀是否能激活Nrf2,我们采用Western blot检测了Nrf2的核转位,结果显示高糖条件下细胞核内Nrf2蛋白表达水平仅轻微增加,而曲格列汀处理后,Nrf2的核转位进一步增多,而分别采用ROS清除剂NAC和PI3K抑制剂LY294002处理后,细胞核内的Nrf2表达水平明显减少(P<0.05),见图4。
5 敲减Nrf2表达后曲格列汀丧失诱导HO-1表达的效应
采用特异性siRNA敲减Nrf2表达后,HRMCs中Nrf2蛋白表达减少,见图5A,再用10 μmol/L曲格列汀诱导细胞18 h,Western blot结果显示,Nrf2-siRNA组HO-1的表达也减少(P<0.05),见图5B。
讨 论
GLP-1 受体广泛表达于心脏、肺组织、消化系统以及肾脏等,它除了能促进胰岛素的分泌并增强其敏感性之外,还具有胰岛素外的作用[9]。研究表明,DPP-4 抑制剂不但可延长 GLP-1 的半衰期,还具有多种GLP-1之外的效应[10],如西格列汀除了降血糖外,还能缩小动脉粥样硬化斑块的面积,并能抑制细胞因子的分泌,并对糖尿病肾损伤具有保护作用[11]。曲格列汀作为一种新型的DPP-4抑制剂,其降糖之外的活性目前尚不清楚。在本研究中,我们得到了以下重要发现:(1) 曲格列汀能上调HRMCs内源性ROS的生成,并能激活PI3K/Akt信号通路;(2)曲格列汀能活化下游核转录因子Nrf2,最终上调HO-1的表达。
糖尿病肾病的发病机制非常复杂,但其核心机制是高血糖所致的自由基的生成与清除失衡[12-13],正常情况下,人体存在多种抗氧化机制来拮抗ROS损伤。在本研究中,我们发现曲格列汀不但可上调HO-1的mRNA和蛋白表达,同时也能增强其酶活性。HO-1可通过其降解血红素的产物发挥抗氧化损伤,另一方面也可下调TGF-β1的表达而发挥抑制炎症反应的作用[14],这表明曲格列汀能有效上调高糖条件下肾系膜细胞中HO-1的表达而改善氧化应激状态,该机制独立于血糖调节之外。
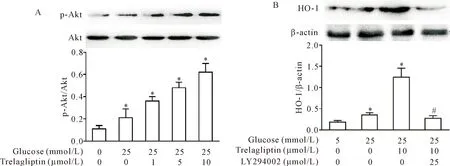
Figure 3.The effects of trelagliptin on the expression PI3K/Akt signaling-related protein in the HRMCs. A:the effect of trelagliptin at different concentrations on the Akt phosphorylation; B: the effects of PI3K inhibitor on the expression of HO-1 in HRMCs induced by trelagliptin. Mean±SD. n=3. *P<0.05 vs 5 mmol/L glucose group; #P<0.05 vs 25 mmol/L glucose+trelagliptin group.
为了进一步明确曲格列汀诱导HO-1表达的分子机制,我们随后对其调控机制进行了探讨。HO-1的表达主要受核转录因子Nrf2的调控[15],此外,PKC,PI3K/Akt和NAPDH氧化酶也参与了HO-1的表达[16-17]。为了明确上述分子是否参与了曲格列汀诱导HO-1的表达,本研究首先测定了处理前后细胞内ROS的变化。在正常血糖条件下,HRMCs内ROS的含量较低,高糖条件下ROS有一定的增高,但曲格列汀处理后,可促进ROS进一步增高。随后采用ROS清除剂处理后,HO-1表达明显减少。这表明ROS在HO-1的表达过程中发挥了信使分子的作用。PI3K/Akt是调控HO-1表达的另一关键信号通路[18]。本研究也发现高糖条件下Akt磷酸化水平也有轻微增高,但曲格列汀处理后,Akt磷酸化水平显著增高。采用PI3K/Akt抑制剂预处理后,HO-1减少,表明PI3K/Akt也参与了HO-1的表达。最后,本研究也发现曲格列汀能上调细胞核内Nrf2水平,而ROS清除剂NAC以及PI3K/Akt抑制剂处理后,Nrf2活性有所降低,表明ROS和PI3K/Akt位于Nrf2的上游,两者通过激活Nrf2而最终促进HO-1的表达。
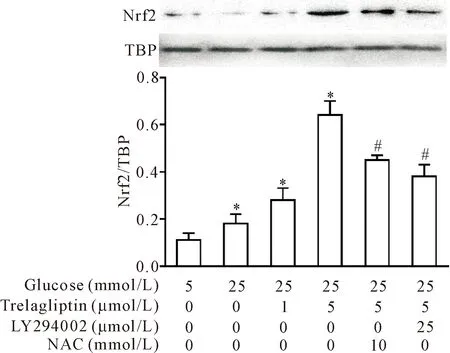
Figure 4.The effects of PI3K inhibitor LY294002 and ROS scavenger N-acetylcysteine (NAC) on the protein expression of Nrf2 in the HRMCs with trelagliptin induction. Mean±SD. n=3. *P<0.05 vs 5 mmol/L glucose group; #P<0.05 vs 25 mmol/L glucose+trelagliptin group.
总之,本研究证实曲格列汀能增加高糖条件下HRMCs 的HO-1表达,从而改善氧化应激水平。HO-1能够降低由氧化应激损伤导致的组织细胞损伤,最终发挥对肾脏的保护功能,为糖尿病肾病的治疗提供了一个新的策略和思路。
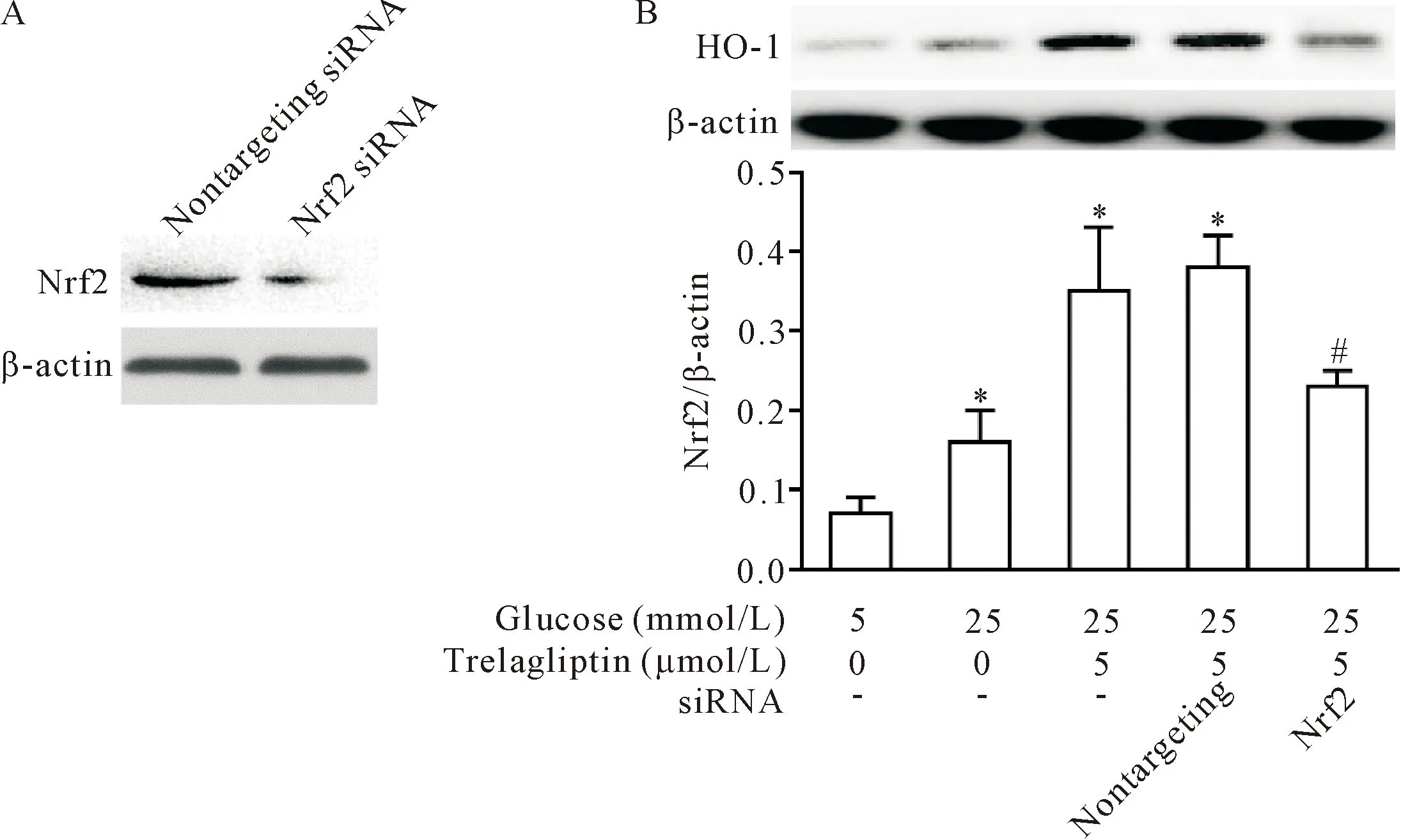
Figure 5.The effects of Nrf2 expression knock-down on the HO-1 expression induced by trelagliptin in the HRMCs. Mean±SD. n=3. *P<0.05 vs 5 mmol/L glucose group; #P<0.05 vs nontargeting siRNA group.

