miR-17对大鼠血管平滑肌细胞衰老的调控作用
李书国, 刘菊菊, 叶 明, 邓娟娟, 张 丹, 彭 艳
(三峡大学老年医学研究所&宜昌市中心人民医院老年病科, 湖北 宜昌 443003)
细胞衰老是细胞在外界环境改变或内部特定基因表达变化等因素作用下丧失增殖能力后进入的一种相对稳定的状态[1]。细胞衰老是一种正常的生理机制,也是一个动态的过程,其可以引起组织修复能力减弱,还通过分泌衰老相关分泌表型因子[2],参与细胞增殖、凋亡、炎症反应和上皮间质转化等,与糖尿病、动脉粥样硬化、骨质疏松和神经退化性疾病等慢性疾病有关[3]。研究表明,血管平滑肌细胞(vascular smooth muscle cells,VSMCs)衰老在动脉粥样硬化发生机制中起着重要作用[4-5],因此,VSMCs衰老的调控可能成为未来动脉粥样硬化防治的靶点。
近年来研究发现微小RNA(microRNAs,miRNAs)在细胞衰老过程中有重要的作用,参与细胞衰老的miRNAs包括miRNA-15、17、29、34、217和885等[6-9],其中miR-17可以抑制细胞老化,促进细胞增殖[10]。本实验以大鼠血管平滑肌细胞为研究对象,采用化学修饰方法探讨miR-17对VSMCs衰老的影响及机制,以了解miR-17可能在VSMCs衰老调控中的潜在作用。
材 料 和 方 法
1 实验动物及主要试剂
10只雄性Sprague-Dawley(SD)清洁级大鼠,6周龄,体重150~200 g,由三峡大学医学院实验动物中心提供。DMEM培养液购自Sigma;p16和p21单克隆抗体购自Santa Cruz。D-半乳糖和β-半乳糖苷酶染色试剂购自上海阿拉丁生化公司;逆转录及PCR反应试剂盒购自Gene Copoeia。
2 方法
2.1大鼠胸主动脉VSMCs体外培养与分组 采用颈椎脱位法处死大鼠。无菌条件下剪开大鼠皮肤,分离胸主动脉,采用组织块贴壁法培养VSMCs。用含20%胎牛血清的DMEM培养液,于37 ℃、5%CO2条件下培养细胞,待细胞生长至完全汇合后传代培养,获得纯度98%以上的VSMCs,取3~6代VSMCs用于后续实验。采用免疫荧光方法鉴定VSMCs。细胞随机分为6组:诱导衰老+miR-17过表达(aging induction+miR-17 mimics, A-miR-17)组、诱导衰老+miR-17敲减(aging induction+miR-17 inhibitor, A-anti-miR-17)组、诱导衰老对照(A-control)组、正常培养+miR-17 mimics (normal+miR-17 mimics, N-miR-17)组、N-anti-miR-17组和N-control组。取处于对数生长期的细胞采用脂质体转染的方式将miR-17-mimics和miR-17-inhibitor导入相应的过表达或敲减组,24 h后加入D-半乳糖(10 g/L)诱导细胞衰老,正常培养组则加常规培养液。
2.2脂质体转染 取生长状态良好的VSMCs,转染前1天将细胞接种于6孔板, 37℃、5%CO2培养箱中培养过夜;转染前2 h换成无血清DMEM培养液。每个培养孔加转染混合液1 mL,并前后轻轻摇动细胞培养板使混合液与培养板中的培养液混匀;细胞于37 ℃、5% CO2培养箱中培养,6 h后吸出混合液换入完全培养液继续培养。
2.3β-半乳糖苷酶染色 各组细胞衰老检测严格按照试剂盒说明书进行操作。吸出细胞培养液,清洗液清洗1次,加入β-半乳糖苷酶染色固定液,室温静置5 min后吸出固定液,加入适量酸性液(pH 6.0),10 min后吸出酸性液,加入预热的染色工作液,置入37 ℃、无CO2的培养箱,孵育3~16 h后光学显微镜下观察并摄片。计数蓝染的细胞为阳性细胞,每次随机选取3个视野,计数100个细胞,衰老细胞阳性率(%)=衰老细胞数/100个细胞×100%,每组实验重复3次。
2.4RT-qPCR检测相关基因的表达 采用RT-qPCR检测各组细胞不同时期miR-17和衰老相关基因的表达情况。提取细胞总RNA合成cDNA,构建合适的反应体系,反应条件:25 ℃ 5 min,50 ℃ 15 min,85 ℃ 5 min,4 ℃ 10 min; RT-qPCR检测:50 ℃ 2 min, 95 ℃ 10 min;95 ℃ 30 s,60 ℃ 30 s,重复40个循环;70 ℃~90 ℃绘制熔解曲线。每个样本检测3次,p16和p21以GAPDH为内参照,miR-17以U6为内参照,采用2-ΔΔCt方法进行评估,分析目的基因的表达。引物由北京擎科生物技术有限公司合成,序列如下:miR-17(扩增长度为248 bp,Tm=56 ℃):上游引物序列为5′-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACCTACCTGC-3′,下游引物序列为5′-TGCGCCAAAGTGCTTACAGTGCA-3′;U6的上游引物序列为5′- CGCTTCGGCAGCACATATAC-3′,下游引物序列为5′-AAATATGGAACGCTTCACGA-3′;p16(扩增长度为241 bp,Tm=56 ℃)的上游引物序列为5′-CGTACCCCGATACAGGTGATG-3′,下游引物序列为5′-CGTCGTGATGTCCCCGCTCT-3′;p21(扩增长度为188 bp,Tm=56 ℃):上游引物序列为5′-CTGGTGATGTCCGACCTGTTCC-3′,下游引物序列为5′-ACGCTCCCAGACGTAGTTGCC-3′;GAPDH (扩增长度为253 bp,Tm=56 ℃)上游引物序列为5′-ACAGCAACAGGGTGGTGGAC-3′,下游引物序列为5′- TTTGAGGGTGCAGCG-AACTT-3′。
2.5免疫组化(免疫荧光)检测相关基因的表达 细胞爬片;4%的多聚甲醛固定15 min,空气干燥5 min,PBS清洗标本3次,0.5% Triton X-100孵育20 min。PBS清洗标本1次,3% H2O2孵育15 min;PBS清洗标本1次;封闭血清孵育20 min,滴加I抗工作液,37 ℃孵育1~2 h或4 ℃过夜; PBS清洗标本3次,滴加适量生物素标记II抗工作液,37 ℃孵育10~30 min;PBS 冲洗,DAB显色剂显色3~5 min;苏木精复染,脱水,透明,封片。免疫荧光与免疫组化步骤相同,换用带荧光标记的II抗。免疫组化染色检测p16蛋白表达,免疫荧光检测p21蛋白表达情况。所有的免疫组化图片采用Image-Pro Plus 6.0软件测量平均吸光度值,进行半定量分析。
3 统计学处理
采用GraphPad Prism 6.0软件对实验数据进行统计分析,实验数据按照均数±标准差(mean±SD)表示,两组均数间比较用卡方检验,以P<0.05为差异有统计学意义。
结 果
1 VSMCs鉴定
大鼠VSMCs原代提取、培养,通过抗α-平滑肌肌动蛋白(α-smooth muscle antibody, α-SMA)免疫荧光染色鉴定,高倍镜下可见大量细胞呈典型的“谷-峰状”生长,细胞质内有大量红色的、与细胞长轴平行的纤维丝,即α-肌动蛋白丝,核居中,呈卵圆形,表明血管平滑肌细胞培养成功。见图1。

Figure 1.The immunofluorescence staining was used to identify the rat vascular smooth muscle cells.
2 血管平滑肌细胞miR-17表达水平的检测
D-半乳糖诱导VSMCs衰老的第14天收集细胞,提取RNA,采用RT-qPCR检测细胞内miR-17的表达水平变化,结果显示,A-control组miR-17的表达显著高于A-anti-miR-17组(P<0.01),而较A-miR-17组显著降低(P<0.01),见图2,说明miR-17-inhibitor和miR-17-mimics成功转入细胞。

Figure 2.The expression of miR-17 in VSMCs on the fourteenth day after D-galactose induced senescence. Mean±SD. n=3. **P<0.01 vs A-control group; #P<0.05 vs N-control group.
3 miR-17对D-半乳糖诱导的VSMCs衰老的影响
3.1光镜观察VSMCs形态 D-半乳糖诱导后的第3天,在100倍光镜下观察VSMCs形态。结果显示,D-半乳糖诱导的衰老细胞与正常培养基组的细胞相比显著增大,形态多样化,见图3。
Figure 3.The morphology of VSMCs on the third day after D-galactose induced senescence.
3.2β-半乳糖苷酶染色鉴定细胞衰老 D-半乳糖诱导后的第3天,采用β-半乳糖苷酶染色方法鉴定细胞衰老情况,结果显示,与N-miR-17组相比,A-miR-17组β-半乳糖苷酶阳性细胞显著增加(P<0.05);与N-anti-miR-17组相比,A-anti-miR-17组β-半乳糖苷酶阳性细胞显著增加(P<0.01);与N-control组相比,A-control组β-半乳糖苷酶阳性细胞显著增加(P<0.01)。A-anti-miR-17 组β-半乳糖苷酶阳性细胞显著高于A-miR-17组(P<0.05),见图4。

Figure 4.The expression of β-galactosidase in VSMCs on the third day after D-galactose induced senescence. Mean±SD.n=3. *P<0.05 vs N-miR-17 group; ##P<0.01 vs N-anti-miR-17 group; △P<0.05 vs N-control group; ▲P<0.05 vs A-miR-17 group.
3.3免疫组化检测p16蛋白表达 D-半乳糖诱导衰老后的第14天采用免疫荧光法检测VSMCs中p16蛋白的表达变化。结果显示,p16蛋白在A-miR-17组的表达较 N-miR-17组显著增加(P<0.01),在A-anti-miR-17组的表达较N-anti-miR-17组显著增加(P<0.01),而在A-control组的表达较A-anti-miR-17组显著降低(P<0.01),其余各组相互之间无显著差异,见图5。
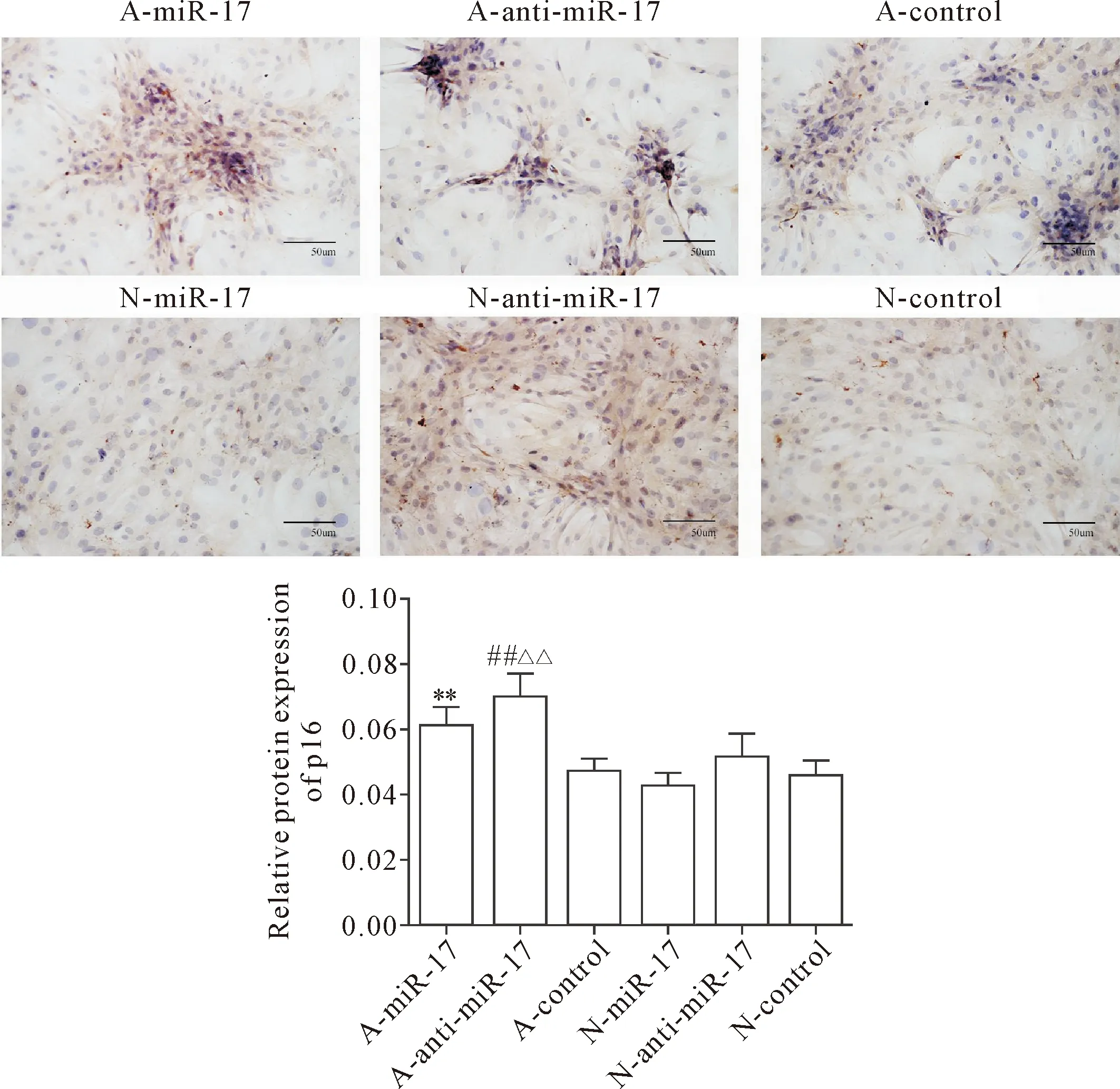
Figure 5.The p16 protein expression in VSMCs on the fourteenth day after D-galactose induced senescence. Mean±SD. n=3. **P<0.01 vs N-miR-17 group; ##P<0.01 vs N-anti-miR-17 group; △△P<0.01 vs A-control group.
3.4免疫荧光法检测p21蛋白表达 D-半乳糖诱导衰老后的第14天采用免疫荧光法检测VSMCs中p21蛋白的表达。结果显示,A-anti-miR-17组p21的表达较A-miR-17和A-control组显著增加(P<0.01);N-anti-miR-17组p21的表达较N-miR-17和N-control组显著增加(P<0.01)。p21 在D-半乳糖诱导组中的表达较对应的正常培养组均显著增加(P<0.01),见图6。

Figure 6.The p21 expression in VSMCs on the fourteenth day after D-galactose induced senescence. Mean±SD. n=3. **P<0.01 vs A-anti-miR-17 group;##P<0.01 vs N-anti-miR-17 group;△△P<0.01 vs N-miR-17 group;▲▲P<0.01 vs N-anti-miR-17 group; &&P<0.01 vs N-control group.
3.5RT-qPCR检测p16和p21的mRNA表达 D-半乳糖诱导后的3、7和14天采用RT-qPCR检测VSMCs细胞内p16和p21的mRNA表达。p16 mRNA的RT-qPCR结果显示,在第3天和第7天,6组相互之间均没有显著差异(P>0.05),在第14天,A-anti-miR-17组的p16 mRNA显著高于A-miR-17组,其余各组间p16 mRNA表达亦无显著差异,见图7。
p21 mRNA的RT-qPCR结果显示,导入anti-miR-17的细胞,无论是否加入D-半乳糖诱导,p21 mRNA表达随培养时间延长显著增加(P<0.01)。在D半乳糖诱导和正常衰老过程中,过表达miR-17使VSMCs 的p21表达显著减少,抑制miR-17导致VSMCs 的p21表达显著增加(P<0.01),见图7。
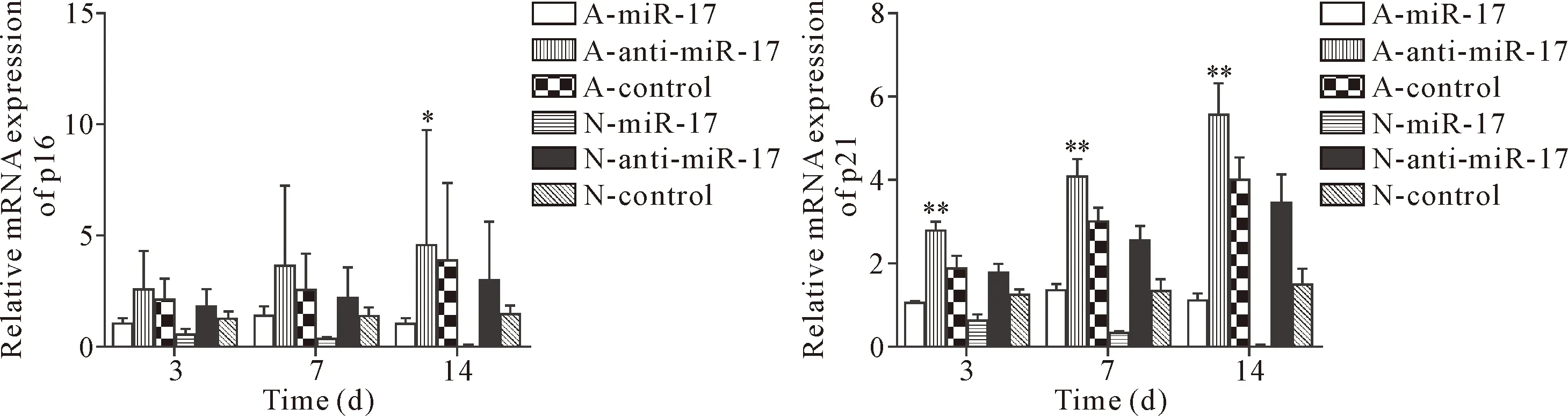
Figure 7.The p16 and p21 mRNA expression in VSMCs was detected using RT-qPCR on days 3,7 and 14 after D-galactose-induced senescence.Mean±SD.n=3.* P<0.05,**P<0.01 vs A-control group.
讨 论
细胞衰老是指细胞生长永久阻滞在细胞周期的G1期,细胞在形态、生化及表观遗传上出现特征变化,是正常细胞必然的归宿[11]。在人体内,细胞衰老与许多慢性疾病的发生发展密切相关,如高血压、动脉粥样硬化、糖尿病以及慢性肾脏病等[12-13]。
VSMCs衰老导致血管老化,衰老的VSMCs表型转换促使血管壁中层肥厚、胶原沉积和血管钙化等血管重构,导致血管疾病产生[14-15]。研究显示[16],动脉粥样硬化斑块平滑肌细胞衰老与端粒重复序列结合因子2(telomere repeat binding factor 2, TRF2)有关,衰老的VSMCs既促进动脉粥样硬化,又促进斑块易损性,预防VSMCs衰老可能是动脉粥样硬化潜在的治疗靶点。
本实验通过观察D-半乳糖诱导3 d后,衰老诱导组的VSMCs较N组细胞明显增大,细胞形态呈现多样化。D-半乳糖诱导的细胞β-半乳糖苷酶阳性细胞率较正常细胞均明显增加,说明D-半乳糖诱导的VSMCs衰老模型建立成功。通过检测VSMCs内miR-17 mRNA的表达水平显示miR-17-mimics和miR-17-inhibitor成功转入VSMCs细胞。D-半乳糖诱导3 d后,A-anti-miR-17 组β-半乳糖苷酶阳性细胞明显高于A-miR-17组,说明miR-17能够抑制大鼠VSMCs衰老。
根据引起衰老原因的不同,细胞衰老可被分为复制性衰老[15]和过早型衰老[17]2种,复制性衰老主要依赖于p53-p21Cip1/Waf1信号通路[18],过早型衰老的发生与p53-p21Cip1/Waf1和p16INK4a/Rb信号通路的激活相关[19]。p16INK4a/Rb与p53-p21Cip1/Waf1信号通路是细胞衰老过程中至关重要的2条信号通路[20],当这2条通路中的关键调控因子,如p21蛋白表达下降或细胞周期蛋白cyclin D的表达上调时,可以延缓细胞衰老或绕过衰老程序继续增殖。
本实验检测p16蛋白和mRNA表达结果显示,诱导衰老组和正常培养组早期表达没有显著增加,但14 d后有显著增加。过表达和抑制miR-17未导致p16显著变化,说明miR-17抑制VSMCs衰老不是通过p16实现的。本实验同时检测p21蛋白和mRNA的表达显示,诱导衰老组和正常培养组VSMCs中p21表达随培养时间延长均有显著增加;过表达miR-17导致p21表达显著减少,抑制miR-17表达使p21表达显著增加,说明miR-17抑制VSMCs衰老与p21有关。
综上所述,miR-17能够抑制D-半乳糖诱导的大鼠VSMCs衰老,其机制与p21表达有关。有必要深入研究miR-17在VSMCs衰老调控中作用及其在动脉粥样硬化防治中的潜在作用。

