胰岛β细胞铁过载模型的建立及铁过载对胰岛β细胞损伤的研究*
张丽娜, 侯乐乐, 刘祖霖, 李平甘, 黄思琪, 孟 哲, 欧 辉, 江转南, 梁立阳
(中山大学孙逸仙纪念医院儿科, 广东 广州 510260)
自1865年发现遗传性血色病患者的2型糖尿病患病风险增加以来,铁过载与2型糖尿病之间的联系开始受到广泛重视。随后越来越多的研究发现,无论是1型或2型糖尿病还是妊娠期糖尿病,绝大部分患者都存在铁代谢指标的增高[1-2]。甚至在正常人群中,每日膳食中每增加1 mg血红素铁的摄入可使2型糖尿病患病风险增加1.16倍[3]。因此,过量的微量元素铁是促进糖尿病的一个危险因素[4],其机制可能与胰岛β细胞受损或者胰岛素抵抗有关,但确切的发病机制尚不清楚。既往研究多集中在铁过载与胰岛素抵抗的关系[5-7],然而过量铁导致胰岛β细胞损伤甚至死亡的机制尚不明确。因此,为探究慢性铁过载对胰岛β细胞的直接影响及铁毒性机理,我们拟通过体外培养具有大鼠胰岛β细胞生理特性的胰岛素瘤细胞株INS-1细胞,用枸橼酸铁铵(ferric ammonium citrate,FAC)建立慢性铁过载模型,以观察铁过载对INS-1细胞活力、胰岛素分泌功能及线粒体的影响。
材 料 和 方 法
1 材料
1.1细胞 INS-1细胞购自上海歌凡生物科技有限公司,传代培养。
1.2试剂 RPMI-1640培养基和DMEM培养基(HyClone);胎牛血清(Gibco);β-巯基乙醇和FAC(Sigma);Calcein-AM(上海翊圣生物科技有限公司);CCK8试剂和活性氧簇(reactive oxygen species,ROS)检测试剂盒(碧云天);大鼠胰岛素酶联免疫分析试剂盒(武汉纯度生物科技);JC-1(联科生物)。
1.3仪器 SW-CJ-2F型净化工作台(苏州净化有限公司);水套式CO2培养箱、多功能酶标仪和离心机(Thermo);流式细胞仪(BD,FACSCalibur);全波长酶标仪(Multiskan GO);5200凝胶成像系统(Tanon);透射电子显微镜(JEM-1400/JEM-1400 PLUS)。
2 方法
2.1INS-1细胞培养 用含10%胎牛血清和50 μmol/L β-巯基乙醇的RPMI-1640培养液悬浮细胞,以每孔200 μL接种在96孔培养板中,于37 ℃、5% CO2饱和湿度培养箱中培养。
2.2INS-1细胞铁过载模型建立
2.2.1实验分组 对照(control)组:INS-1细胞的培养液中不加枸橼酸铁铵(FAC),常规培养24 h、48 h和72 h。铁过载组:培养液中分别含5、10、20、40、80、160和320 μmol/L的FAC在37 ℃、5% CO2饱和湿度培养箱中孵育24 h、48 h和72 h后,弃液,Hanks液洗3次,分别加入无血清培养液,37 ℃、5% CO2饱和湿度培养箱中孵育20 min。
2.2.2细胞不稳定变铁池(labile iron loop,LIP)的检测 为验证FAC能进入细胞成为LIP,通过calcein-AM标记不同的处理组细胞,用流式细胞术检测各组calcein-AM的荧光强度。具体操作如下:在细胞培养过程中,收集不同浓度FAC处理的细胞,以相同培养时间不加FAC进行常规培养的细胞为对照组,磷酸缓冲盐溶液(PBS)洗2次,重悬细胞于PBS中,调细胞浓度为1×109/L,加入calcein-AM,终浓度为0.125 mol/L,37 ℃、5% CO2饱和湿度培养箱中孵育15 min,洗去过多的calcein-AM,重悬于PBS中,流式细胞术检测荧光强度。LIP水平与荧光强度呈反比,荧光淬灭率越高,表明进入细胞内的铁越高。
2.2.3CCK8法检测细胞活力 将生长状态良好的细胞消化下来,根据计数情况及接种量(每孔8 000个)制备细胞悬液(每孔200 μL);将制备好的细胞悬液接种到96孔板中,将培养板放在培养箱中(37 ℃,5% CO2)预培养过夜,换液加入对应浓度的FAC,在培养箱中分别培养24 h、48 h和72 h,向每孔加入20 μL CCK8溶液,将培养板在培养箱内孵育2 h;用酶标仪测定在450 nm处的吸光度(A值)。
2.3胰岛素测定 取细胞的培养基上清,3 000 r/min离心10 min去除颗粒和聚合物后作为待测样品。设置标准品孔和样本孔,标准品孔各加不同浓度的标准品50 μL;分别设空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)、待测样品孔。在酶标包被板上待测样品孔中先加样品稀释液40 μL,然后再加待测样品10 μL(样品最终稀释度为5倍)。加样将样品加于酶标板孔底部,尽量不触及孔壁,轻轻晃动混匀;每孔加入酶标试剂100 μL,空白孔除外;用封板膜封板后置37 ℃温育60 min,将20倍浓缩洗涤液用蒸馏水20倍稀释后备用,小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30 s后弃去,重复5次。每孔先加入显色剂A 50 μL,再加入显色剂B 50 μL,轻轻振荡混匀,37 ℃避光显色15 min,每孔加终止液50 μL,终止反应;以空白孔调零,450 nm波长依序测量各孔的吸光度(A)值。
2.4ROS的检测 荧光探针CM-H2DCFDA体积比为1 000 ∶1的比例配制ROS探针染色液。取对数生长期的细胞接种于6孔培养板上,待细胞融合率达70%~80%后每孔加入1.5 mL染色液,37 ℃避光孵育30 min,PBS清洗2遍,消化细胞形成细胞悬液,用流式细胞术检测各组荧光强度。
2.5细胞线粒体膜电位的检测 胰酶消化细胞后重悬于PBS中清洗2次,弃去PBS上清,向每管加入1 000 μL 温热缓冲液;每孔在加入5 μmol/L JC-1,轻轻混匀后将培养板在培养箱内孵育(避光)5 min。PBS清洗2次,1 500 r/min离心5 min。每管细胞500 μL PBS重悬后过滤到流式管,流式细胞术分析检测。
2.6透射电子显微镜观察线粒体形态 生长在培养皿或培养板上细胞取材,离心成团,去上清。沿壁缓慢加入电镜固定液(1.5%~2.5%中性戊二醛),4 ℃下固定2 h或以上,漂洗6次,每次30 min。1% 锇酸固定30~60 min后再漂洗3次,每次5 min。梯度脱水后树脂渗透,利用包埋模具、Epon812纯树脂包埋,固化后超薄切片,厚度50~70 nm。铀铅双染色后冲洗切片,烤灯下烤15 min使切片彻底干燥后,透射电子显微镜下观察。
3 统计学处理
采用SPSS 22.0 软件进行分析。所有实验重复3次,数据以均数±标准差(mean±SD)表示,多组间均数比较采用单因素方差分析及Dunnett’s检验。以P<0.05为差异有统计学意义。
结 果
1 INS-1细胞内calcein水平的变化
24 h、48 h和72 h 3组的对照组间INS-1细胞内calicein-AM荧光强度无显著差异。加入不同浓度的FAC后,INS-1细胞内calcein-AM的平均荧光强度均低于同培养时间的对照组,各浓度FAC组与同培养时间的对照组相比差异均有统计学意义(P<0.05),见图1。
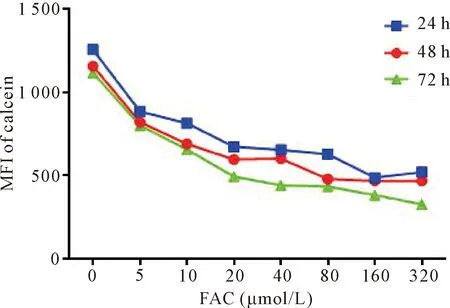
Figure 1.The changes of mean fluorescence intensity of calcein in the INS-1 cells treated with different concentrations of FAC for different time.
2 INS-1细胞活力的变化
24 h组:加入不同浓度的FAC后,细胞活力较对照组降低,其中20和320 μmol/L组与对照组相比差异有统计学意义(P<0.05);48 h组:加入不同浓度的FAC后,细胞活力较对照组降低,其中5、10、20、80、160和320 μmol/L组与对照组相比差异有统计学意义(P<0.05);72 h组:各浓度FAC组均与对照组相比,细胞活力下降,差异均有统计学意义(P<0.05),见图2。
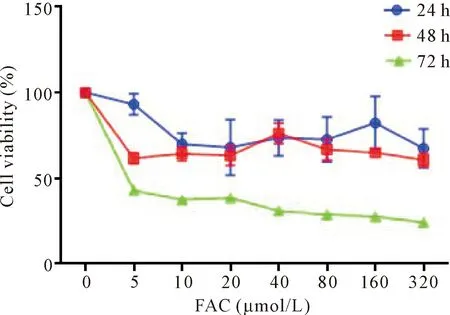
Figure 2.The viability of INS-1 cells exposed to FAC at different concentrations for different time. Mean±SD. n=3.
以LIP相对水平最高、细胞相对活力大于50%为原则,选取48 h组FAC浓度为80、160和320 μmol/L为后续实验的铁过载组,细胞活力分别是对照组的66%、64%和60%。
3 INS-1细胞内胰岛素分泌的变化
ELISA法检测INS-1细胞中胰岛素水平,与对照组相比,80和160 μmol/L FAC组的胰岛素分泌逐渐增多,但仅160 μmol/L组的差异有统计学意义(P<0.05);320 μmol/L组与对照组相比胰岛素分泌减少(P<0.05),见图3。
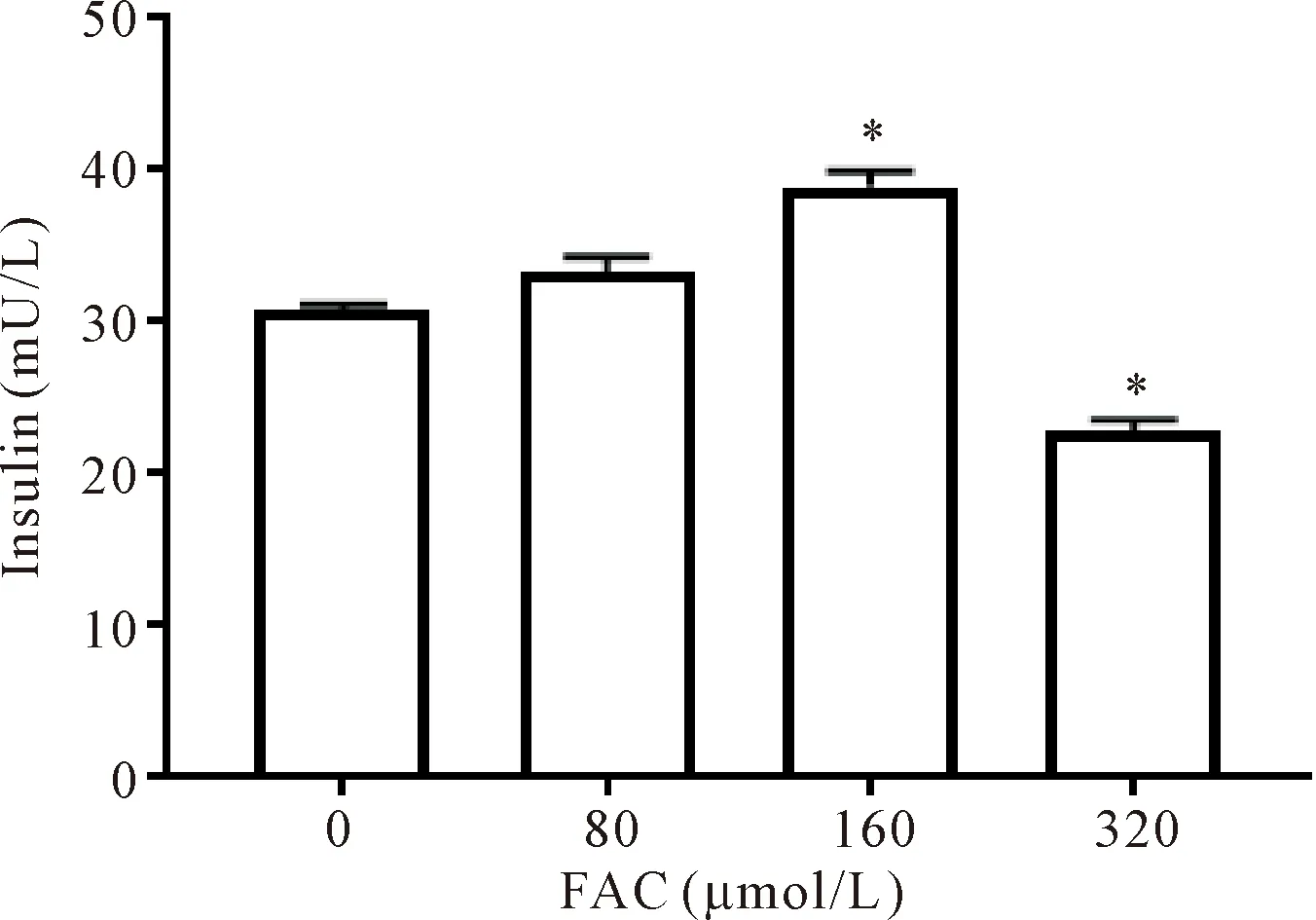
Figure 3.Insulin changes in the INS-1 cells exposed to FAC at different concentrations. Mean±SD. n=3.*P<0.05 vs 0 μmol/L group.
4 INS-1细胞内ROS水平的变化
与对照组相比,铁过载组细胞内ROS水平均增加(P<0.05),见图4。
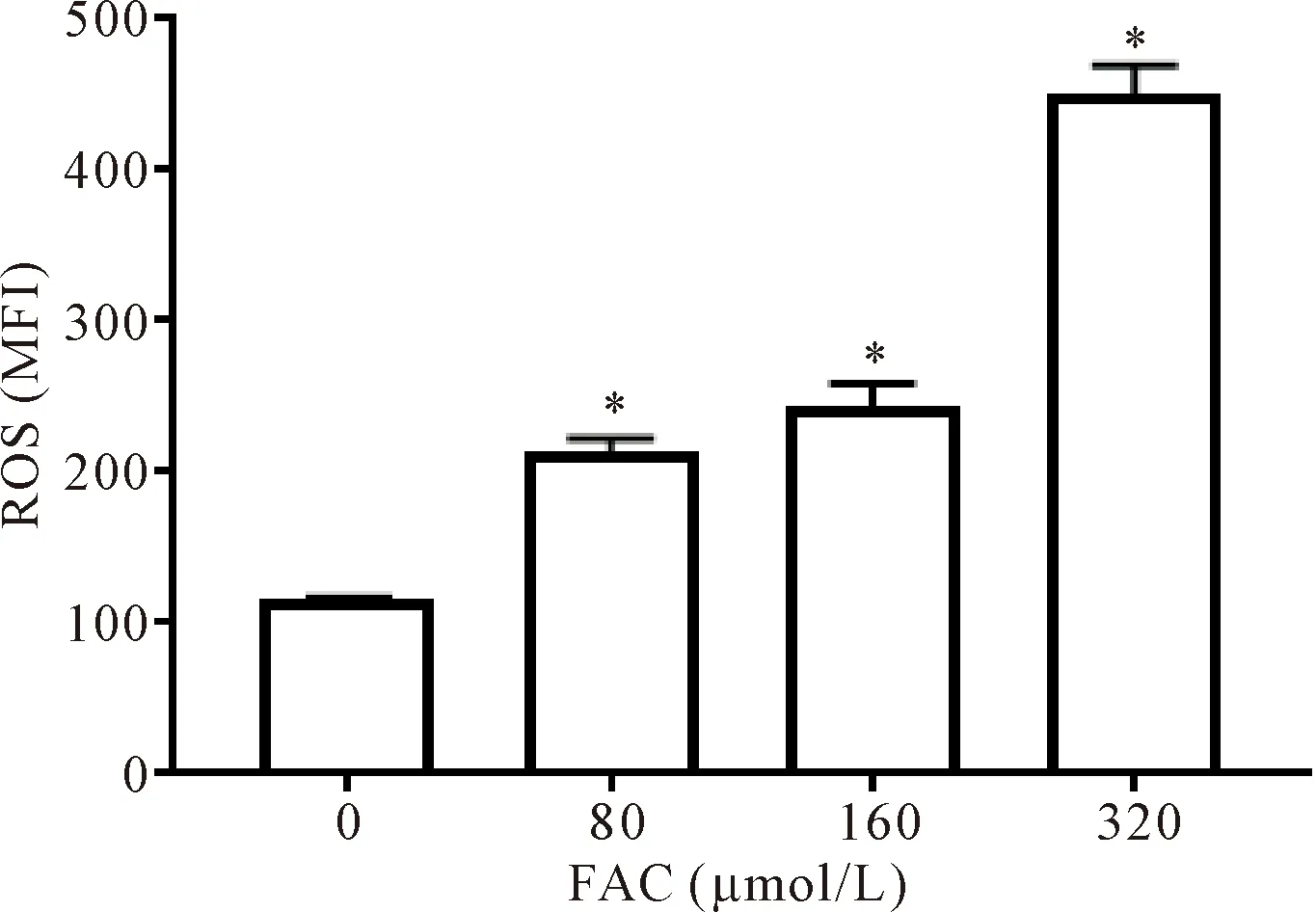
Figure 4.ROS level was significantly increased in the INS-1 cell iron overload model. Mean±SD. n=3.*P<0.05 vs 0 μmol/L group.
5 INS-1细胞线粒体膜电位的变化
铁过载组与对照组相比,线粒体膜电位逐渐降低(P<0.05),见图5。
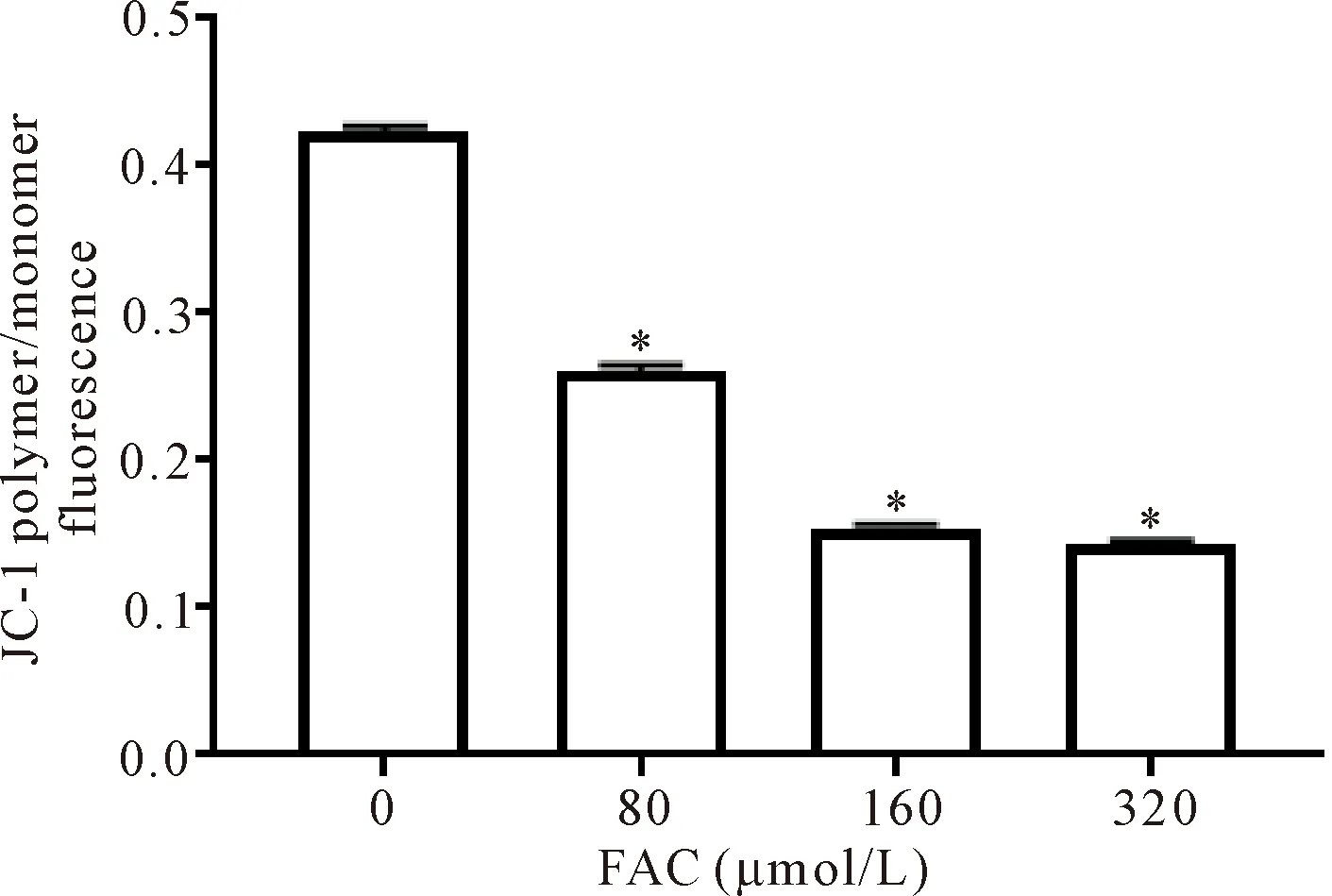
Figure 5.Mitochondrial membrane potential was decreased in the INS-1 cell iron overload model. Mean±SD. n=3.*P<0.05 vs 0 μmol/L group.
6 INS-1细胞线粒体形态的变化
铁过载组随着FAC浓度增加,线粒体形态破坏逐渐加重,表现为内嵴肿胀,排列松散,部分呈空泡样,与对照组相比,可见致密铁分子颗粒,见图6。
讨 论
适量铁是机体代谢过程中必不可少的组件,然而机体内铁水平增高可导致包括糖尿病在内的多种疾病。构建慢性铁过载诱导胰岛β细胞损伤和死亡的模型是深入了解其病理生理机制的首要环节。人体游离铁存在于不稳定池中,包括了血浆中的非转铁蛋白结合铁(non-transferrin-bound iron,NTBI)和红细胞中的LIP。FAC是一种生理形式上的NTBI,主要用于慢性铁过载实验当中。LIP的定量检测被认为是衡量细胞内铁过载的瞬时参数,可以反映细胞内铁的沉积程度[8];calcein平均荧光强度越低,细胞内LIP水平越高。卢文艺等[9]等在骨髓间充质干细胞培养的过程中添加FAC(100、200和400 μmol/L)培养12、24和48 h,发现较对照组LIP明显增高;Park等[10]用150 μmol/L的FAC培养海马HT-22神经元48 h,发现铁过载导致细胞活力的下降,细胞死亡。但目前国内外尚缺乏公认的可用于慢性铁过载损伤机制研究的胰岛β细胞模型。本研究亦选择FAC构建胰岛β细胞(INS-1细胞)的慢性铁过载模型,用INS-1细胞体外添加不同浓度(5、10、20、40、80、160和320 μmol/L)的FAC,分别培养24 h、48 h和72 h,以探索建立胰岛细胞铁过载模型的条件。
我们的实验结果发现,FAC能够诱导INS-1细胞内慢性铁过载,进一步观察发现INS-1细胞随着FAC浓度增加及时间的延长,calcein的平均荧光强度逐渐降低,提示共培养的时间越长、浓度越高,其细胞内铁沉积越明显,而INS-1细胞活力逐渐下降。这说明胰岛β细胞对FAC较为敏感,FAC可引起胰岛β细胞数目减少。既往研究发现,不论1型糖尿病还是2型糖尿病,胰岛β细胞的衰竭被认为是糖尿病发病的先决条件[11-12],即使是很严重的肥胖或者胰岛素抵抗的患者,如果胰岛β细胞数目不下降,也不一定会发展为糖尿病。不仅如此,我们在实验中同时发现,在一定的FAC浓度范围,INS-1细胞分泌胰岛素并不会减少,甚至出现短暂升高的趋势,只有当细胞数量降低到大约60%以下,才会出现胰岛素分泌的减少。也就是说,随着铁的沉积,胰岛β细胞数目减少的初期,胰岛素代偿性分泌增多。这种现象可能与胰岛素的分泌机制有关:胰岛素的分泌与电子传递链中产生的ATP有关,而细胞内的铁参与了电子传递链中大部分复合物的组成。有研究提出,减少细胞内铁的排出对于胰岛素的分泌是一个正向的促进作用[13]。但由胰岛素代偿性增多转为分泌减少过程中的关键节点及分子机制目前尚不明确,除了细胞数目的进一步减少外,是否有其他的信号通路仍需要进一步的研究。该过程也有可能成为早期有效干预糖尿病发生的关键环节。

Figure 6.The morphologic changes of mitochondrial structure under TEM. A: the mitochondrial electron density was high in control group, and the mitochondrial cristae were arranged neatly; B: in FAC 80 μmol/L group, the mitochondria as well as their cristae were slightly swollen and a small amount of iron molecular particles appeared in the cytoplasm; C and D: in high FAC concentration groups, the mitochondria and their cristae were obviously swollen, the arrangement of the cristae was disoriented, some mitochondria were vacuolated, and iron molecular particles appeared in the cytoplasm.
在体内,铁可以通过Fenton反应催化ROS的生成,当产生的ROS超过了细胞抗氧化系统清除能力时,过量的ROS可以导致脂质过氧化、DNA损伤及线粒体损伤等[14]。胰岛β细胞表面抗氧化酶的含量低,使其对氧自由基的攻击更加敏感,容易导致细胞和线粒体损伤[15]。Fenton反应所需要的铁主要来源于LIP,而线粒体是利用铁的主要细胞器,用于酶和ATP的合成,线粒体LIP是最大的胞内LIP之一,因此线粒体与铁依赖的ROS产生有着非常密切的关系。本研究显示随着铁浓度的增高,细胞内ROS水平明显升高,线粒体膜电位下降,线粒体结构明显受损,甚至失去完整的结构,而损坏的线粒体又释放更多的ROS,最终导致胰岛β细胞死亡,形成恶性循坏。线粒体既是氧化应激的主要来源又是氧化应激的靶向细胞器,能够敏感地感受到机体内氧化应激的水平变化,即使在相对低水平的铁浓度所产生的ROS,也会导致线粒体结构的破坏,进而出现胰岛β细胞死亡。线粒体损伤后,线粒体LIP大量释放,继而催化Fenton反应生成更多的ROS。新近研究显示ROS也对胰岛β细胞的分泌功能有重要影响[16]。因此铁过载导致胰岛β细胞衰竭中,线粒体损伤可能起着关键作用。
综上所述,本研究通过探索同FAC浓度下LIP水平及细胞生长情况,成功建立胰岛β细胞慢性铁过载模型,为今后进一步研究铁过载对胰岛细胞的直接损伤机制奠定基础。在胰岛β细胞数目衰竭和分泌功能障碍的过程中,伴随大量ROS产生及线粒体损伤。未来需要深入研究铁过载导致胰岛β细胞死亡的确切机制及对其进行干预,协助胰岛β细胞应对过量的ROS,减少线粒体损伤。这有可能成为缓解胰岛β细胞衰减的重要环节,也为解决铁过载所致的胰岛β细胞损伤提供了一个新的切入点。

