心脏磁共振特征追踪技术评价女性肥胖人群右心室心肌应变的初步研究
李昕 马双春 陈辉 宋清伟 刘爱连 李智勇
大连医科大学附属第一医院放射科(辽宁大连116011)
在心血管系统疾病的研究中,男女之间的性别差异往往被忽视和低估,近年来,有关心血管的解剖、功能、细胞信号和病理生理学方面的基本性别差异已经得到了越来越多的共识[1]。而且,最近研究表明,除了传统的危险因素如血脂异常、高血压、糖尿病和吸烟,女性也成为一个心血管疾病的风险因素[2]。同时,肥胖也是公认的心血管疾病危险因子之一[3]。因此,有关女性肥胖人群的心脏结构、功能的变化与监测已成为一个当前的热门话题。
心脏磁共振(cardiac magnetic resonance,CMR)特征追踪技术是一种能够客观反应心肌形变的新方法[4],已经广泛应用于多种疾病的左心室评估[5],有关CMR 右心室(right ventricle,RV)心肌应变(myocardial strain,MS)的研究仍处于起步阶段,近年来正逐步增多,CHAHAL 等[6]的研究显示肥胖人群会发生右心重塑,表现为RV 质量和容积增加,RV 收缩、舒张功能受损。JING 等[7]发现儿童肥胖组RV 整体纵向应变(global longitudinal peak strain,GLS)明显低于正常对照组。但是,TRUONG 等[8]对正常成年志愿者研究后却发现GLS 与体质量指数(body mass idex,BMI)之间无显著相关性。由此可见,肥胖对RV MS 的影响还存在一定争议,目前还没有专门针对女性肥胖人群RV MS的研究报道,因此本文旨在探讨女性肥胖人群CMR RV MS 随着BMI 的变化情况。
1 资料与方法
1.1 一般资料入选标准:纳入2015年5月至2018年11月期间在我院采用3.0T MR 行心脏常规成像的女性正常志愿者57例,年龄21 ~74岁,平均(46.23 ± 15.47)岁。按照不同BMI 分为3 组:正常组17 kg/m2≤BMI <24 kg/m2,超 重 组24 kg/m2≤BMI <28 kg/m2及肥胖组28 kg/m2≥BMI。
排除标准:心脏瓣膜疾病、原发性心肌病、先心病、冠心病等病史;肝、肾等影响心脏功能疾病;CMR 禁忌证(起搏器、植入型心律转复除颤器,幽闭恐怖症和耳蜗植入器);图像质量差影响分析者。本研究通过本中心伦理委员会审批,检查前所有人均签署知情同意书。
1.2 仪器与方法所有志愿者的CMR 检查均于3.0T MR 上(HDxt;General Electric Medical Systems,Waukesha,WI,USA)完成,使用心脏专用8 通道相控阵接收线圈,在心电和呼吸门控下完成扫描。常规扫描层面主要包括:左心室长轴、流入流出道、四腔心、左心室短轴(从心尖到基底部)电影图像,使用稳态进动快速(fast imaging employing steady-state acquisition,FIESTA)电影序列成像进行扫描,扫描参数如下:TR 3.6 ms;TE 1.6 ms;翻转角50°;带宽125 kHz;FOV 350 mm × 350 mm;矩阵192×224;层厚10 mm;层间距0。
1.3 图像分析在GE ADW4.4 工作站通过Reportcard 4.0 软件完成LV(left ventricle)和RV 结构功能参数测量,方法如下:在左心室短轴层面于收缩末期及舒张末期勾画心内膜界线,得到左心室射血分数(left ventricular ejection fraction,LVEF),在四腔心测量RV 舒张末期直径(right ventricular end diastolic diameter,RVEDD)。应变分析采用CVI 42 软件(cvi42 v5.9.0,Circle Cardiovascular Imaging,Alberta,Canada),在左心室短轴电影序列和四腔心图像上勾画RV 心内膜及心外膜(乳头肌及肉柱包括在心腔内),通过软件自动计算出RV 应变参数:整体径向应变(global radial peak strain,GRS)、整体圆周应变(global circumferential peak strain,GCS)、GLS(图1)。
所有数据由同一个医师进行两次测量,中间间隔时间1 个月。两个不同的医师对所有数据进行测量。
1.4 统计学方法采用SPSS 22.0 统计分析软件。计量资料以均数±标准差表示。RV MS 参数均完成组内、组间ICC(intraclass correlation coefficient,ICC)检验一致性分析。RV MS 参数与BMI之间进行Pearson 相关性分析。正常组、超重组、肥胖组之间分别就一般资料、LV 及RV 结构功能参数、MS 参数进行单因素ANOVA 方差分析。P<0.05 为差异有统计学意义。
2 结果
2.1 女性人群3 组间一般资料状况差异性分析女性人群总体平均年龄(46.23 ± 15.47)岁,3 组间年龄差异无统计学意义。平均心率(72.40±9.05)次/min,3 组间心率差异无统计学意义。体质量与BMI 三组之间均存在差异性,呈逐步增高趋势。见表1。
表1 研究人群一般资料Tab.1 Basic characteristics of study population ±s
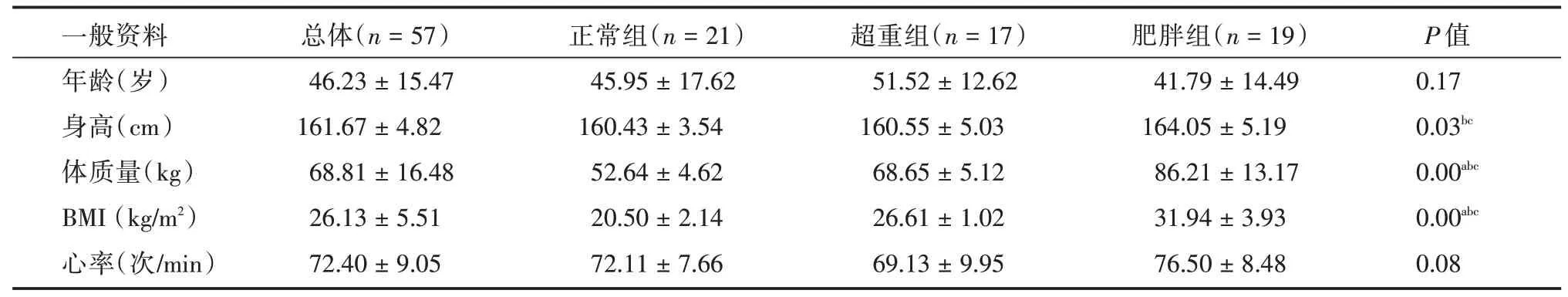
表1 研究人群一般资料Tab.1 Basic characteristics of study population ±s
注:a,正常组与超重组间有统计学差异;b,正常组与肥胖组间有统计学差异;c,超重组与肥胖组间有统计学差异
一般资料年龄(岁)身高(cm)体质量(kg)BMI(kg/m2)心率(次/min)总体(n=57)46.23±15.47 161.67±4.82 68.81±16.48 26.13±5.51 72.40±9.05正常组(n=21)45.95±17.62 160.43±3.54 52.64±4.62 20.50±2.14 72.11±7.66超重组(n=17)51.52±12.62 160.55±5.03 68.65±5.12 26.61±1.02 69.13±9.95肥胖组(n=19)41.79±14.49 164.05±5.19 86.21±13.17 31.94±3.93 76.50±8.48 P 值0.17 0.03bc 0.00abc 0.00abc 0.08
2.2 RV MS 参数测量组内、组间一致性比较就所有女性人群而言,GRS、GCS、GLS 无论是组内还是组间,其ICC 检验均具有较好的一致性,ICC 值均在0.76 以上。其中GLS 的一致性最高,组内ICC值达到0.90。
2.3 3 组间LVEF、RVEDD、MS 比较肥胖组GLS(-12.95 ± 3.67)%显著低于正常组(-15.57 ±2.61)%,差异有统计学意义(P= 0.04)。LVEF、RVEDD、GRS 及GCS 在3 组间差异均无统计学意义。见表2。
表2 3 组间LVEF、RVEDD、MS 比较情况Tab.2 Comparison of LVEF,RVEDD and MS among three groups ±s
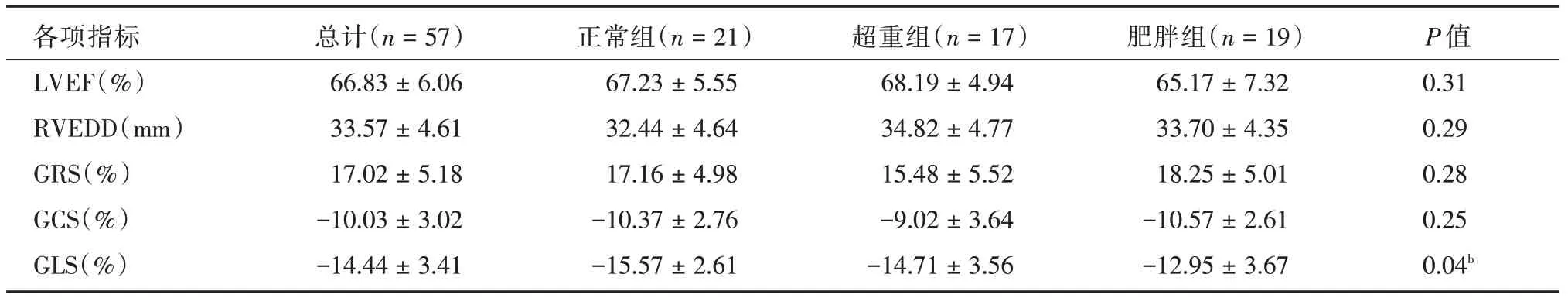
表2 3 组间LVEF、RVEDD、MS 比较情况Tab.2 Comparison of LVEF,RVEDD and MS among three groups ±s
注:LVEF:左心室射血分数;RVEDD:右心室舒张末期直径;GRS:整体径向应变;GCS:整体圆周应变;GLS:整体纵向应变。b:正常组与肥胖组间有统计学差异
各项指标LVEF(%)RVEDD(mm)GRS(%)GCS(%)GLS(%)总计(n=57)66.83±6.06 33.57±4.61 17.02±5.18-10.03±3.02-14.44±3.41正常组(n=21)67.23±5.55 32.44±4.64 17.16±4.98-10.37±2.76-15.57±2.61超重组(n=17)68.19±4.94 34.82±4.77 15.48±5.52-9.02±3.64-14.71±3.56肥胖组(n=19)65.17±7.32 33.70±4.35 18.25±5.01-10.57±2.61-12.95±3.67 P 值0.31 0.29 0.28 0.25 0.04b
2.4 RV MS参数与BMI相关性情况GLS 与BMI 呈负相关(r=-0.33,P= 0.01),GRS、GCS 与BMI 无相关性(r= 0.07,r= 0.04,均P>0.05),见图2。
图1 正常及肥胖女性应变测量图Fig.1 Strain measurements of nomal and obese female
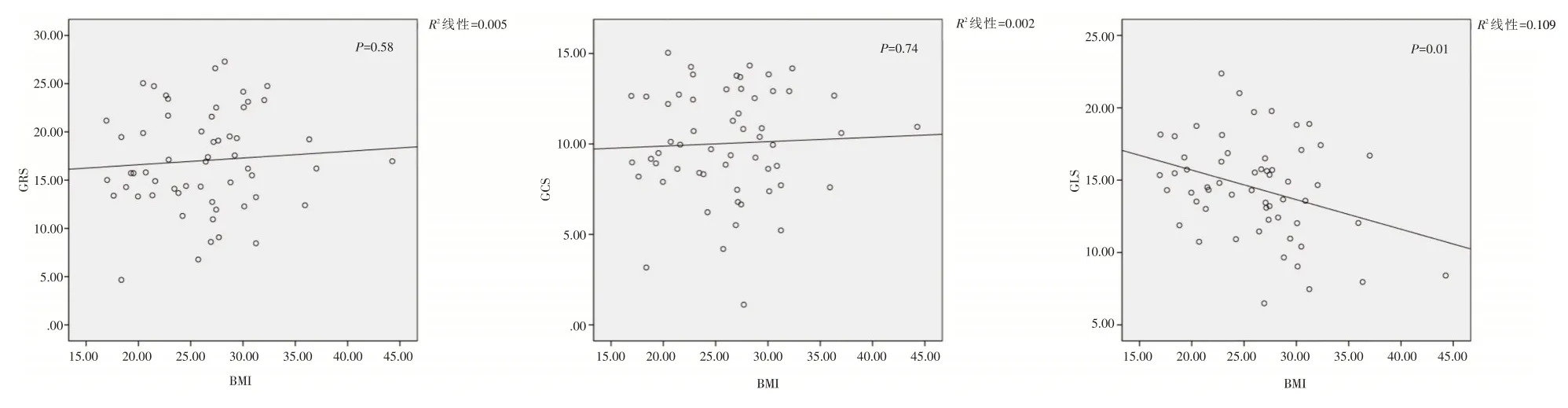
图2 RV MS 参数与BMI 相关性Fig.2 Correlation between RV MS parameters and BMI
3 讨论
2011年,美国国立卫生组织发表的文章数据显示,因心血管事件导致的死亡已成为女性致死的首位原因[9]。肥胖作为公认的心血管疾病危险因子,不仅可以导致左心室(left ventride,LV)结构和功能障碍[10-11],也可导致RV 收缩、舒张功能受损。但是,相较于LV,RV 长期以来关注程度偏低,本研究主要关注中国女性人群肥胖程度与RV结构、心肌形变等的关联情况。
本研究对RV MS 参数测量一致性分析结果显示:GRS、GCS、GLS 无论是组内还是组间,其ICC 检验均具有较好的一致性(组内0.76~0.90,组间0.79~0.85),这与HWANG 等[12]对129例健康志愿者测量结果大致相符(GRS、GCS、GLS 的组内、组间ICC 范围分别为0.67~0.83、0.89~0.98),此外本研究中GLS 测量一致性最高,组内ICC 值达0.90,与LIU 等[13]对100例健康志愿者研究基本相符,说明目前RV MS 测量的稳定性尚好,且GLS 测量稳定性最高。
本研究采用最新版本的CVI 42 v5.9.0 软件对57例成年女性志愿者[平均BMI(26.13 ± 5.51)kg/m2]进行RV MS分析,结果显示GRS值为(17.02±5.18)%,GCS值为(-10.03±3.02)%,GLS值为(-14.44 ± 3.41)%,与HWANG 等[12]用CVI v5.0软件对129例亚洲健康成年志愿者[平均BMI(24.83 ± 2.64)kg/m2]的研究结果相比,GRS 值(18.63±6.52)%和GCS 值(-10.60±3.33)%基本相当,但是GLS 值(-25.06 ± 3.01)%较本研究明显增高。TRUONG 等[8]用CVI 42 软件测量28 名正常女性[平均BMI(28.6 ± 7.92)kg/m2)],GLS 值(-22.11± 3.51)%也较本研究结果显著增高。由此可见,本研究的GLS 值与文献存在偏低情况,即使是正常组GLS(-15.57 ± 2.61)%也偏低,这可能是与CVI 软件不同版本、样本种族地域不同、本研究样本量略少存在偏移、年龄因素等情况有关,当然,这还需要更大样本的分析以及不同软件版本的分析。
本研究结果显示正常组、超重组和肥胖组间LVEF、RVEDD 均无明显统计学差异,这可能说明BMI 的增加尚没有引起LV 功能及RV 结构的变化。
本研究结果中:女性人群GRS、GCS 与BMI无显著相关性,但GLS 与BMI 呈明显负相关(r= -0.33,P= 0.01),也就是说,随着女性BMI 不断增加,GLS 呈显著降低,这一结论与JING 等[7]发现在儿童肥胖中GLS 与指数化的BMI 呈负相关的结论一致。本研究在3 组间RV MS 比较中也发现:肥胖组GLS(-12.95 ± 3.67)%显著低于正常组(-15.57±2.61)%,而三组间GRS、GCS 均无明显差异性,这也与JING 等[7]的研究结论一致,其发现儿童肥胖组RV GLS 明显低于正常对照组[(-14 ± 2)%vs(-15 ± 2)%,P= 0.02]。这些结果均说明:肥胖能够一定程度损害GLS,无论是儿童肥胖还是女性肥胖。并且,本研究还提示,RVEDD 没有出现异常的情况下,女性肥胖就可能引起GLS 的降低。
现有研究已经证明,RV GLS 是许多疾病预后不良的预测因子。如MOON 等[14]及ORWAT 等[15]对法洛四联症患者随访后发现GLS 是预后不良的预测因子,DE SIQUEIRA 等[16]对110例肺动脉高压人群的RV MS 分析结果表明纵向应变及应变率均与预后终点独立相关。PARK 等[17]对57例缺血性心肌病患者采用超声速度矢量成像技术研究发现,RV 纵向应变及应变率下降的患者在1年后随访的生存率也下降。本研究中,女性人群GLS 随BMI 的增加显著减低,肥胖导致的右心室功能障碍及预后情况值得我们关注。
本研究的局限性主要包括:其一,入组病例数量偏少,可能会产生数据偏差;其二,由于样本量不足,没有对年龄因素进行细致分析;其三,入组成年女性,肥胖组不可避免存在糖尿病及高血压者(尽管心脏结构没有变化,但是可能存在微结构改变),本文选择血糖血压情况控制好者尽量减少对结果的影响;其四,并没有完善的随诊观察。综上所述,本研究结果提示GLS 测量稳定性最佳,可以作为一个相对理想的RV MS 监测指标;其次,随着女性BMI 的不断增加,GLS 呈显著降低,女性肥胖可导致GLS 的受损。

