MiR-30a-5p通过泛素水解酶22抑制人宫颈癌细胞上皮-间质转化功能
王丽萍,何 婧,许晓燕,陈小梅,李红芳
(兰州市第一人民医院妇产科,甘肃兰州730050)
复发、转移是影响宫颈癌患者治疗效果、生存预后的重要问题[1]。深入研究宫颈癌细胞侵袭转移的机制,寻找对应的宫颈癌复发转移发生过程中的关键分子靶点进而加以干预,是提高宫颈癌疗效和改善其预后的希望[2]。在宫颈癌及其他恶性肿瘤中,上皮-间质转化(epithelial-mesenchymaltransition,EMT)占有重要地位,多种microRNA(miR)被证明是调控EMT的重要靶点[3]。目前已证实,miR-30a-5p在多种恶性肿瘤中产生治疗作用[4-6]。然而,miR-30a-5p在对宫颈癌中的作用及机制尚不明确。前期发现miR-30a-5p可能与本团队前期证实的,与宫颈癌细胞增殖、转移[7]、干性[1]密切相关的治疗靶点泛素水解酶22(ubiquitin-specific protease 22,USP22)存在直接靶向调控关系。本研究采用miR-30a-5p模拟物,对人宫颈癌细胞系Hela细胞进行转染及慢病毒感染,通过EMT功能实验及标志物检测,明确其在体外及体内实验中,对EMT相关功能蛋白及靶蛋白细胞内含量的影响,以明确其具体的抗癌作用及深入的分子生物学机制。
1 材料与方法
1.1 材料
宫颈癌细胞株Hela购自美国模式培养物集存库(ATCC)。DMEM高糖培养基,胎牛血清(fatal bovine serun,FBS)购自美国GIBCO公司。脂质体转染试剂Lipofectamine 3000、荧光定量PCR试剂盒、PCR引物、兔抗人α-Catenin(货号alpha-CAT-7A4)购自Thermofisher公司。Transwell小室购自Corning公司。miR-30a-5p模拟物(mimics)及其阴性对照negative control mimic购自广州安邦生物技术有限公司。双荧光素酶检验试剂盒、USP22过表达质粒载体购自购买于北京百奥莱特有限公司。兔抗人USP22(货号ab195289)、兔抗人N-cadherin(货号ab202030)、兔抗人GAPDH(货号ab181602)抗体购自美国Abcam公司。本研究所有体外实验及动物体内实验方案均获得本院伦理委员会审核。
1.2 方法
1.2.1 microRNA mimic的转染和miR-30a-5p含量的RT-PCR检测 复苏宫颈癌Hela细胞株。以含有体积分数为5%FBS的DMEM高糖培养基培养细胞。按照核酸转染试剂说明书进行转染步骤。对于转染miR-30a-5p mimics和negative control mimic的Hela细胞,分别在转染2 d后,分别作为30a-5p组、NC组用于后续检测。以未转染Hela细胞作为对照Control组。分组提取细胞总RNA用于合成cDNA,分别进行RT-PCR实验。PCR反应条件及分析计算按照课题组既往报道方法进行[8]。RT-PCR引物序列:miR-30a-5p Foward-GGTTGGCGCTCTGAGAGGTA,miR-30a-5p Reverse-GGGCCACCAGTGTGAGGT;U6 Foward-CGGCCAGCAGCTTCTCA,U6 Reverse-AAATTGCGTTTACGCT。所有实验重复3次。
1.2.2 Matrigel胶处理的Transwell法检测宫颈癌细胞的侵袭能力 取液化Matrigel胶50 μL每孔处理Transwell小室上室底部,模拟基底膜环境。取分组转染后各组细胞,加入Transwell小室上室。Transwell下室加入500 μL含体积分数为5%FBS的培养基。常规培养48 h后取出上室。擦除小室内侧底部细胞。固定外侧底部细胞。结晶紫染色小室底部。冲洗后显微镜下,白光观察Transwell小室底膜,并计数染色阳性细胞。所有实验重复3次。
1.2.3 miR-30a-5p起效的靶基因预测 同本课题前期报道[3],在 miRtarget数据库中对hsa-miR-30a-5p基因的靶蛋白进行预测。明确miR-30a-5p序列对USP22 mRNA的靶向位点,进而进行后续生物信息学验证。
1.2.4 蛋白质免疫印迹法检测细胞内蛋白含量前述处理的宫颈癌细胞,按照既往本课题组报道方法,分不同治疗组收集细胞[7]。提取各组宫颈癌细胞中的总蛋白。分析USP22蛋白,神经-钙粘素(N-cadherin),α-连环蛋白(α-Catenin),内参甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)蛋白的表达量,将胶片条带扫描并转换成灰度模式,应用Image J图像分析软件进行灰度分析,所有实验重复3次。
1.2.5 USP22过表达对miR-30a-5p抑制EMT的拮抗作用 同课题组前期报道方法[3],采用USP22过表达质粒,与30a-5p mimic共转染。蛋白质免疫印迹法检测USP22过表达后,30a-5p组共转染Hela细胞中的USP22含量。
1.2.6 Luciferase实验检测miR-30a-5p与USP22的靶向关系 采用野生型wild type(WT)的PsicheckTM-USP22-wild type-WT载体及定点突变mutation(MUT)后的PsicheckTM-USP22-mutation-MUT载体,分别分组脂质体共转染。按照试剂盒说明书,进行双荧光素酶检验[8]。
1.2.7 建立宫颈癌皮下移植瘤模型观察miR-30a-5p对体内宫颈癌细胞的抑制作用 同本课题组前期研究报道的方法[3,8],采用将经过慢病毒包装的miR-30a-5p质粒和经过慢病毒包装的NC对照mimic质粒感染宫颈癌Hela细胞。经嘌呤霉素筛选,建立稳定转染细胞系。无免疫力的BALB/c裸鼠饲养于兰州大学实验动物中心SPF环境下。分别收集3组对数生长期Hela细胞1×107个,于裸鼠右腰部建立皮下移植瘤模型,于30 d观察终点时取出移植瘤进行观察。同前方法RT-PCR法检测miR-30a-5p水平,蛋白质免疫印迹法检测USP22、N-cadherin、α-Catenin、GAPDH 蛋白的表达量。
1.3 统计学方法
采用SPSS 16.0软件进行分析。本研究实验数据用以中位数(下四分位数~上四分位数)和均数±标准差(mean±SD)表示。两组计量资料比较,符合正态分布及方差齐性的数据采用独立样本t检验,若以上条件不满足则采用二样本Wilcoxon秩和检验(Wilcoxon rank-sum test)。3组计量资料比较,符合正态分布及方差齐性的数据采用单因素方差分析(one-way ANOVA);若3组数据非正态或方差不齐时,3组组间比较采用Kruskal-Wallis H检验,当组间比较有统计学差异时,进一步比较采用Bonferroni法进行多重比较。
2 结果
2.1 miRNA-30a-5p对Hela细胞MiR-30a-5p水平的影响
同前述分组转染Hela细胞48 h后,RT-PCR法检测各组细胞中miR-30a-5p的表达水平。结果显示,30a-5p组miR-30a-5p的细胞内相对含量明显升高,其细胞内相对含量为Control组的853.82(862.26~843.11)倍左右(P<0.01,图1),而NC组的细胞内相对含量1.08(1.06~1.09)与空白对照组1.00(1.00~1.01),统计学差别无意义(P>0.01)。
2.2 miR-30a-5p转染对Hela细胞侵袭能力影响的检测
经过48 h转染处理后,观察Transwell实验检测到的穿膜细胞数量。发现30a-5p组侵袭细胞数量8.17(8.32~8.03)个/视野明显低于空白对照组(Control组)的 62.33(63.52~60.19)视野(P<0.01)。而NC组的穿膜细胞统计值66.23(69.55~62.71)个/视野与空白对照组的差别没有统计学意义(P=0.23;图2)。

图1 3组分别转染的Hela细胞miR-30a-5p含量的比较Fig.1 Comparison of miR-30a-5p quantities in 3 groups of Hela cells
2.3 miR-30a-5p转染对EMT相关功能蛋白的细胞内含量的影响
免疫印迹实验显示,与对照组相比,30a-5p组N-cadherin蛋白的细胞内含量降低,α-Catenin蛋白的细胞内含量升高;而两种对照组细胞的EMT相关功能蛋白的细胞内含量无明显差异(图3)。
2.4 miR-30a-5p靶基因的预测
miRBASE生物信息学预测结果表明,miR-30a-5p与USP22的3′UTR区部分互补。USP22可能是miR-30a-5p的靶基因(图4)。
2.5 miR-30a-5p对Hela细胞USP22蛋白细胞内含量的影响
免疫印迹实验显示,与Control组相比,30a-5p组USP22蛋白细胞内含量下调,而2个对照组之间的USP22蛋白细胞内含量无明显差别(图3)。

图2 miR-30a-5p对Hela细胞侵袭能力的影响Fig.2 Effect of miR-30a-5p on the invasion ability of Hela cells
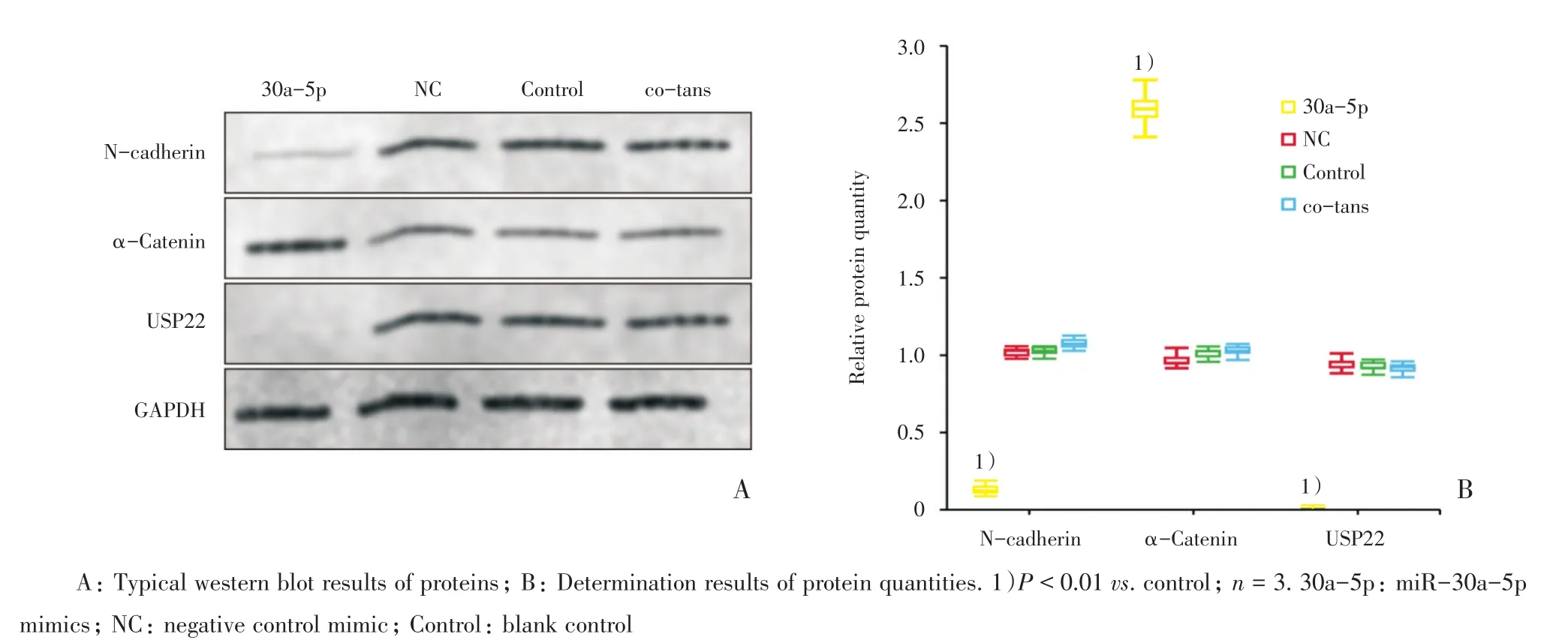
图3 miR-30a-5p对Hela细胞EMT相关功能蛋白的细胞内含量的影响Fig.3 Effect of miR-30a-5p on the intracellular quantity of EMT markers in Hela cells

图4 miR-30a-5p的靶基因USP22及其结合位点Fig.4 The target gene USP22 of microRNA-30a-5p and its binding sites
2.6 USP22质粒与miR-30a-5p模拟物共转染后,对宫颈癌细胞EMT的影响
免疫印迹实验发现,采用USP22过表达质粒转染30a-5p组细胞,伴随USP22表达量的升高,30a-5p组宫颈癌细胞中N-cadherin蛋白表达量明显升高,α-Catenin蛋白表达量明显降低(图3)。
2.7 Luciferase实验检测miR-30a-5p与USP22 3'UTR靶向关系
Luciferase实验荧光强度结果显示,30a-5p组细胞野生型USP22-WT载体的荧光强度降低(P<0.01),而同一组细胞3'UTR定点突变型USP22-MUT载体的荧光强度与对照组相比统计学差别无意义(P=0.22),说明USP22 mRNA通过预测的3′UTR靶向位点与miR-30a-5p结合,作为其靶基因收到调控(图5)。

图5 USP22的荧光素酶活性比较Fig.5 The luciferase activity of USP22
2.8 miR-30a-5p对Hela细胞体内皮下移植瘤生长能力的影响
第30天时切取皮下移植瘤进行观察,可见30a-5p组皮下移植瘤明显小于Control组(P<0.01),而NC组与对照组之间的肿瘤大小无明显差异(P>0.01)。表明升高miR-30a-5p表达水平可以抑制Hela细胞皮下成瘤的生长(图6)。
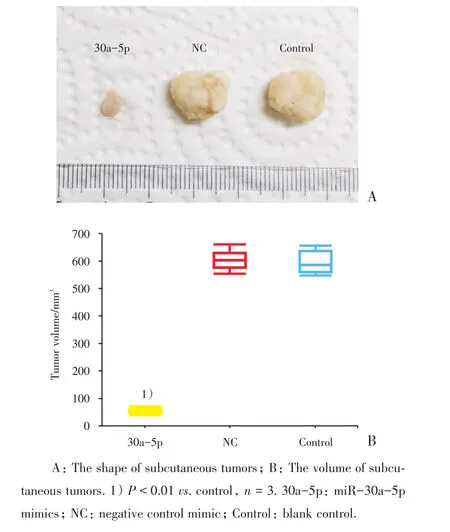
图6 miR-30a-5p对Hela细胞皮下移植瘤生长能力的影响及肿瘤大小比较Fig.6 Effect of miR-30a-5p on the growth ability of subcutaneously transplanted Hela tumors
2.9 3组肿瘤组织中MiR-30a-5p含量和相关蛋白含量的检测

图7 3组Hela细胞系肿瘤组织中miR-30a-5p和蛋白含量的比较Fig.7 Comparison of the quantity of microRNA-30a-5p and proteins in tumor tissue generated by three Hela cell lines in vivo
RT-PCR法检测各组肿瘤组织中miR-30a-5p的表达水平,免疫印迹实验检测USP22、N-cadherin、α-Catenin蛋白表达含量。结果显示,与Control组肿瘤组织相比,30a-5p组肿瘤组织miR-30a-5p的相对含量升高,USP22蛋白含量降低,N-cadherin蛋白的含量降低,α-Catenin蛋白含量升高(图7)。两种对照组细胞的miR-30a-5p和相关功能蛋白的细胞内含量无明显差异。
3 讨论
miR-30a-5p定位于人类6号染色体的q13位置,来源于部分内含子的转录单元。其所属的miR-30家族包括5个高度保守的同源性成员miR-30a,miR-30b,miR-30c,miR-30d和miR-30e。miR-30a-5p被发现在卵巢癌[6]、鼻咽癌[9]、乳腺癌[10]、前列腺癌[11]等多种恶性肿瘤中下调,并可能成为多种恶性肿瘤有效的治疗靶点[12-14]。同时,有报道提示miR-30a-5p通过不同的靶蛋白,对卵巢癌[5,15]、乳腺癌[16]、膀胱癌[4]、子宫内膜癌[17]的EMT过程产生抑制作用。这些结果提示,miR-30a-5p可能在宫颈癌的EMT中发挥作用。然而,目前miR-30a-5p在宫颈癌细胞中的作用尚未见报道。仅有的相关研究显示,其同源异构体miR-30a可能对宫颈癌细胞的增殖和侵袭[18]、细胞自噬[19]等功能起效。所以,本研究尝试采用miR-30a-5p模拟物mimics,进行脂质体转染,提高人宫颈癌Hela细胞的胞内含量。在升高胞内miR-30a-5p含量后,检测该治疗手段对宫颈癌细胞的侵袭能力产生明显下调。说明miR-30a-5p高表达具有对人宫颈癌Hela细胞具有侵袭能力的抑制效果。因此,有必要进一步研究miR-30a-5p抑制宫颈癌细胞侵袭的深入分子生物学机制。
EMT是恶性肿瘤侵袭转移的重要机制,可能是miR-30a-5p治疗宫颈癌的机制。所以,作者测定了不同处理后,各组细胞EMT相关功能蛋白的细胞内表达量。免疫印迹法检测显示,30a-5p组的N-cadherin蛋白含量下调,α-Catenin蛋白含量上调,说明30a-5p组卵巢癌细胞的EMT过程被逆转。这可能是肿瘤细胞侵袭能力下降的机制。
microRNA对EMT的调控往往通过对特定靶蛋白的影响实现。microRNA在细胞中作用的常见途径是,互补配对靶蛋白mRNA的非编码区(3′Untranslated Regions,3′UTR)。进而形成互补配对后,使靶蛋白的mRNA降解,抑制靶蛋白的表达[20]。对miR-30a-5p的靶基因正确进行准确的预测与鉴定,是研究其分子生物学机制的关键。对miR-30a-5p进行生物信息学分析,能够迅速预测出可能的靶基因作用位点。经过Mirtarget预测,USP22的3′UTR区存在与miR-30a-5p特异性结合位点,可能是其进行蛋白表达调控的靶向位点。
USP22是去泛素化酶(deubiquitinating enzymes,DUBs)基因家族的成员之一[21]。该家族在DNA转录以及细胞有丝分裂进程中均扮演者重要角色。研究表明,USP22与神经退行性病变、肿瘤恶性肿瘤发生发展等多种病理变化过程相关。且目前USP22常被作为肿瘤干细胞标记物,生物学功能与多种恶性肿瘤的侵袭转移密切相关[1]。本团队前期对USP22在宫颈癌中的作用和机制进行了大量研究,已初步证实,其过表达与宫颈癌的增殖、转移密切相关,且对其进行靶向抑制,可以实现对宫颈癌肿瘤干细胞的有效抑制[1,7]。在前期研究中,本团队已初步揭示USP22在宫颈癌中可能的癌基因地位,并证明如果实现对USP22表达的有效抑制,即可能实现对宫颈癌的有效基因治疗。所以生物信息学软件预测USP22为miR-30a-5p靶基因后,可以进一步采用生物学实验方法进行验证其靶向效果。如果能够通过进一步的研究证实两者的直接靶向关系,将有助深入了解miR-30a-5p在宫颈癌细胞的EMT中的调控机制。本研究发现,对miR-30a-5p作用于宫颈癌细胞后,细胞中的USP22蛋白在细胞内的含量显著下调。
进一步地,作者构建了USP22过表达质粒,希望其实现USP22细胞内异位真核表达的作用。在研究中,该质粒的表达成功诱导USP22蛋白在宫颈癌细胞的高表达。进一步的观察发现,细胞中N-cadherin蛋白含量随之上调,α-Catenin蛋白含量下调。说明USP22异位表达,可以导致对miR-30a-5p抑制EMT的回补效果。作者进而根据预测结果,设计USP22 mRNA 3′UTR野生型和突变型载体,进行Luciferase实验直接验证靶向抑制关系。发现miR-30a-5p只能对野生型载体的荧光强度产生下调,对根据预测结果,进行3′UTR定点突变设计的突变型载体的荧光强度没有明显影响。这些结果证明了,预测的靶向结合位点是合理的,USP22 mRNA确实通过预测位点,与miR-30a-5p结合,进而受到对其的直接表达量调控。与本研究结果相似,Jiang等[2]在结肠癌细胞的体外研究中证实了miR-30a-5p对USP22的靶向调控作用,且发现miR-30a-5p/USP22轴可能通过对Wnt/β-catenin通路的调控影响结肠癌细胞的耐药和干性。
综上所述,miR-30a-5p在宫颈癌细胞中,可能通过本研究证明的mRNA 3′UTR结合位点,结合USP22 mRNA,进而影响其胞内表达量;进而通过抑制USP22的活性,调控EMT相关蛋白的含量,进而产生对EMT的抑制作用。miR-30a-5p/USP22轴有可能成为宫颈癌侵袭转移治疗的药物设计靶点。
——一道江苏高考题的奥秘解读和拓展

