EB病毒对胃癌细胞增殖、凋亡和脂代谢的影响
闭原桦,陈健宁,黄君庭,龚丽萍,邵春奎
(中山大学附属第三医院病理科,广东广州 510630)
胃癌是我国最常见的肿瘤之一,发病率仅次于肺癌[1]。EB病毒相关胃癌(EBV-associated gastric carcinoma,EBVaGC)是胃癌四种分子分型之一,与EB病毒(Epstein-Barr virus,EBV)密切相关,约占胃癌患病人数的10%,每年新发近8万病例[2],而且每年全世界癌症患者中有1.8%死于EBVaGC[3-4]。然而EBVaGC的发病机制尚未完全明确。已有研究表明脂代谢重编程与肿瘤进展息息相关[5-6],是肿瘤抵抗细胞死亡和无限的增殖的重要支持,当血脂不能满足肿瘤快速生长时,需要通过从头合成获得更多脂质[5],脂质合成酶表达和活性升高,细胞脂质含量升高。另外,病毒感染也能导致脂代谢的紊乱。近年来发现,肿瘤相关病毒如乙肝病毒(HBV)、丙肝病毒(HCV)、卡波西肉瘤疱疹病毒(KSHV)等导致的脂代谢重编程与肿瘤的发生发展紧密相关[7-9]。那么同为肿瘤相关病毒,EBV能否影响脂代谢呢?目前对EBV与脂代谢关系的研究只有四篇报导:单核细胞增多症中EBV感染能升高患儿血脂水平[10];EBV编码的潜伏膜蛋白(LMP1)和EBV编码的小RNA(EBV encoded RNA,EBER)通过促进鼻咽癌细胞脂质合成,提高了鼻咽癌细胞增殖能力[11-12];EBV立早蛋白(BRLF1)增强宿主细胞脂肪酸合成,从而促进EBV裂解[13]。EBV对胃癌脂代谢的影响在全世界尚未见有报道,本研究拟利用AGS和Akata细胞共培养建立EBV阳性细胞株AGSEBV,比较胃癌细胞AGS和AGS-EBV增殖、凋亡和脂代谢的差异,旨在从脂代谢的角度阐述EBV对胃癌细胞脂代谢的影响及EBVaGC发生发展的机制。
1 材料与方法
1.1 细胞株及主要试剂
AGS细胞(EBV阴性胃癌细胞株)购于中国科学院上海细胞库,Akata细胞(EBV阳性Burkitt′s淋巴瘤细胞株)由中山大学附属肿瘤医院曾木圣教授馈赠。胎牛血清、RPMI1640培养基购于Gibco公司,磷酸盐缓冲液(PBS)、0.25%胰酶购于吉诺生物,G418购于凯基生物,TRIzol、异丙醇、无水酒精、氯仿等购于广州化学试剂厂,EBER-1原位杂交试剂盒购于中杉金桥,油红O染色试剂盒购于南京建成,游离脂肪酸定量试剂盒(ab65341)、甘油三酯定量试剂盒(ab65336)、胆固醇定量试剂盒(ab65359)购于Abcam公司,cDNA逆转录试剂盒、荧光定量PCR试剂盒(SYBR®Premix Ex TaqⅡ)购于TaKaRa公司,CCK-8增殖检测试剂盒购于日本DOJINDO公司,Annexin V PE/7-AAD凋亡试剂盒购于美国BD公司。
1.2 AGS-EBV细胞株的建立
AGS与Akata细胞株共培养,Akata细胞中的重组EBV带绿色荧光蛋白(GFP)基因和新霉素抗性,通过CELL-TO-CELL方式使AGS感染EBV,800 μg/mL G418筛选14 d后获得稳定感染的AGS-EBV细胞株。
1.3 细胞培养
Akata细胞、AGS细胞和AGS-EBV细胞在含10%胎牛血清的RPMI 1640,于37℃、体积分数5%CO2培养箱中培养。Akata细胞悬浮生长,细胞每日轻轻摇晃1次,隔天传代;AGS及AGS-EBV呈单层贴壁生长,细胞汇合率达80%进行传代。
1.4 EBER原位杂交
细胞培养到对数生长期,消化离心后去上清,40 g/L多聚甲醛固定,混合琼脂糖凝胶制成蜡块,以3 mm厚度切片。玻片脱蜡后,按说明书进行试验。EBER原位杂交后,细胞核呈黄棕色为EBER阳性。
1.5 CCK-8细胞增殖检测
将2 000细胞/孔铺到96孔板,每组设6个副孔。分别于0、24、48、72、96、120 h向每孔加入10 μL CCK-8溶液,于37 ℃、体积分数5%CO2培养箱孵育2 h,用酶标仪在450 nm检测吸光度。
1.6 细胞凋亡检测
以2×105细胞铺入6孔板,8 h后换液,培养48 h收集细胞。收集培养液,细胞消化离心并进行计数,将约5×105细胞与100 μL 1×binding buffer制成细胞悬液,加入5 μL PE溶液和5 μL 7-AAD溶液轻轻混匀,避光染色15 min,然后加入400 μL 1×binding buffer进行稀释,用BD公司的流式细胞仪检测AGS和AGS-EBV的凋亡比例。
1.7 油红O染色
将试剂盒中试剂一的储备液和稀释液按5∶2混合,慢速滤纸过滤,待细胞爬片自然干燥,置入试剂一染缸中10 min,37℃蒸馏水洗20 s,再试剂二复染3 min,自来水洗60 s。用加热至60℃的甘油明胶进行封片,镜下观察。脂滴被染成红色,细胞核被染成蓝色,其余组织为淡蓝色。
1.8 脂质含量检测
分别按游离脂肪酸定量试剂盒、甘油三酯定量试剂盒和胆固醇定量试剂盒说明书进行操作。同一试验在相同条件下重复3次,每次试验设2复孔,取平均值。
1.9 细胞RNA提取及实时定量荧光PCR
收集培养到对数期的AGS、AGS-EBV细胞并加入TRIzol试剂,按照RNA提取说明书的步骤提取总RNA,检测RNA的含量及纯度,再按照逆转录试剂盒说明书进行逆转录。实时定量荧光PCR(qRT-PCR)步骤参照说明书。使用仪器为Applied Biosystems 7500。引物(表1)由Invitrogen公司合成,PAGE纯化。PCR反应条件:95℃30 s,95℃3 s,60℃30 s,设置40个循环。同一试验在相同条件下重复3次,每次试验设3复孔,取平均值,使用 2-ΔΔCt法计算基因相对表达量。

表1 脂代谢合成相关酶的引物序列Table 1 Primers sequences of real time PCR
1.10 统计学方法
采用SPSS 20.0和GraphPad Prism 6软件进行统计分析和制图,计量资料以均数±标准差(x±s)进行描述。比较各组间的差异,符合正态分布且方差齐性的数据,采用t检验(方差不齐时用校正t检验),不符合正态分布或方差不齐的数据,采用秩和检验。比较重复测量数据采用MANOVA检验。双侧检验,检验水准定为α=0.05。
2 结果
2.1 EBV胃癌阳性细胞株AGS-EBV的建立
AGS与Akata细胞共培养,Akata细胞中带绿色荧光蛋白(GFP)基因和新霉素抗性的重组EBV通过CELL-TO-CELL方式感染AGS,感染了EBV的细胞能在蓝光激发下发出绿色荧光,另外,该细胞还表达EBER。因此荧光显微镜下绿色荧光和EBER原位杂交阳性均证明AGS-EBV中EBV感染成功(图1)。
2.2 EBV促进胃癌细胞株AGS增殖
绘制AGS和AGS-EBV体外增殖能力的生长曲线(图2)。AGS-EBV细胞增殖速度更快(F=23.214,P=0.001),从24 h开始AGS-EBV组细胞数(O.D value)多于AGS,两组差值在24~120 h的P值分别为0.007、0.004、<0.001、<0.001和<0.001,差异有统计学意义。EBV促进胃癌细胞增殖能力增强。

图1 EBV成功感染AGS细胞Fig.1 AGS successfully infected by EBV

图2 EBV促进胃癌细胞AGS增殖Fig.2 EBV increased proliferation of AGS
2.3 EBV抑制胃癌细胞株AGS凋亡
AGS的早期凋亡率为2.79%±1.24%,晚期凋亡率为5.70%±1.65%,总凋亡率为8.48%±0.85%。AGS-EBV的早期凋亡率为1.50%±0.48%,晚期凋亡率为3.53%±1.35%,总凋亡率为5.03%±1.01%。两组细胞早期凋亡率(P=0.052)无统计学差异,AGS-EBV的晚期凋亡(P=0.032)和总凋亡率(P< 0.001)都低于AGS(表2,图3),提示EBV抑制胃癌细胞株AGS凋亡。
2.4 EBV促使胃癌细胞内的脂滴蓄积
脂滴被油红O着色呈红色点状小颗粒,均匀分布于细胞质。AGS-EBV组脂滴含量高于AGS组,提示AGS-EBV组细胞内脂质蓄积增多(图4)。AGS细胞内的游离脂肪酸含量(1.75±0.74)nmol/106cells,AGS-EBV细胞内的游离脂肪酸含量(3.38±0.59)nmol/106cells,AGS-EBV组含量高于对照组(P<0.001)。AGS细胞内的甘油三酯含量(4.58±0.39)nmol/106cells,AGS-EBV的甘油三酯含量为(7.72±1.57)nmol/106cells,AGS-EBV组含量高于AGS组(P=0.004)。AGS细胞内总胆固醇含量为(7.49±0.50)μg/106cells,而 AGSEBV 为(13.13±0.64)μg/106cells,细胞内总胆固醇含量AGS组低于AGS-EBV组(P<0.001;表3)。

表2 EBV抑制胃癌细胞株AGS凋亡Table 2 EBV suppressed apoptosis of AGS (n=3,%)
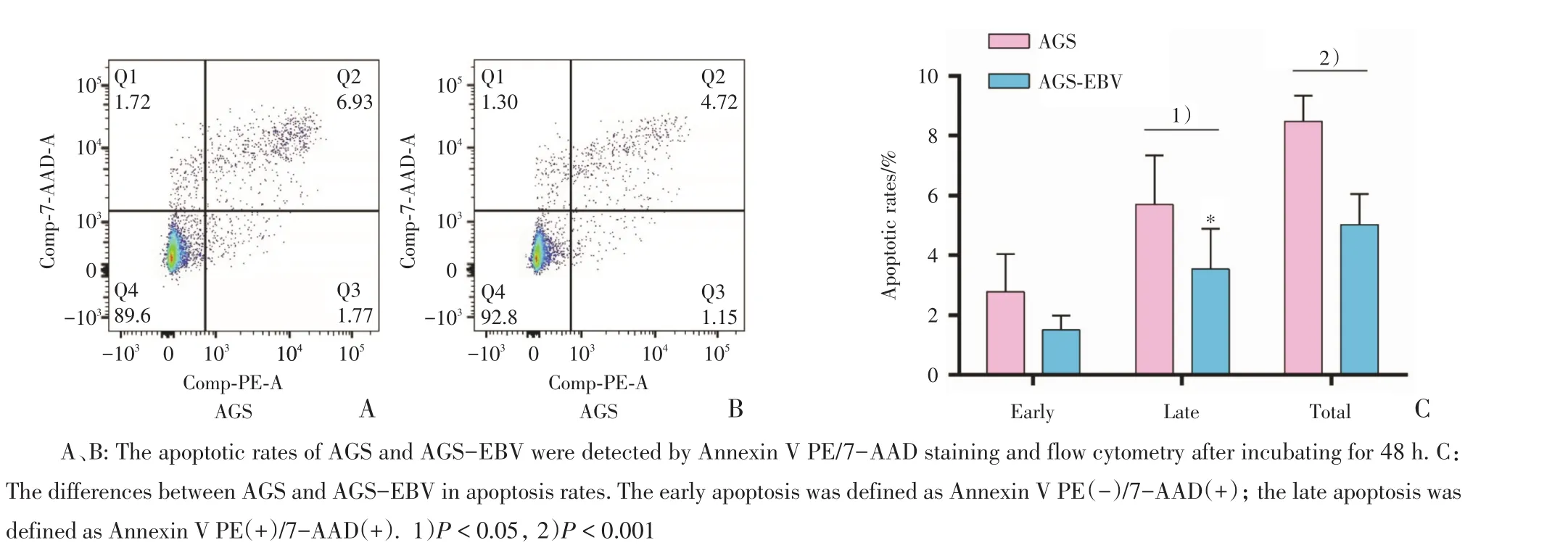
图3 EBV抑制胃癌细胞株AGS凋亡Fig.3 EBV decreased apoptosis of AGS
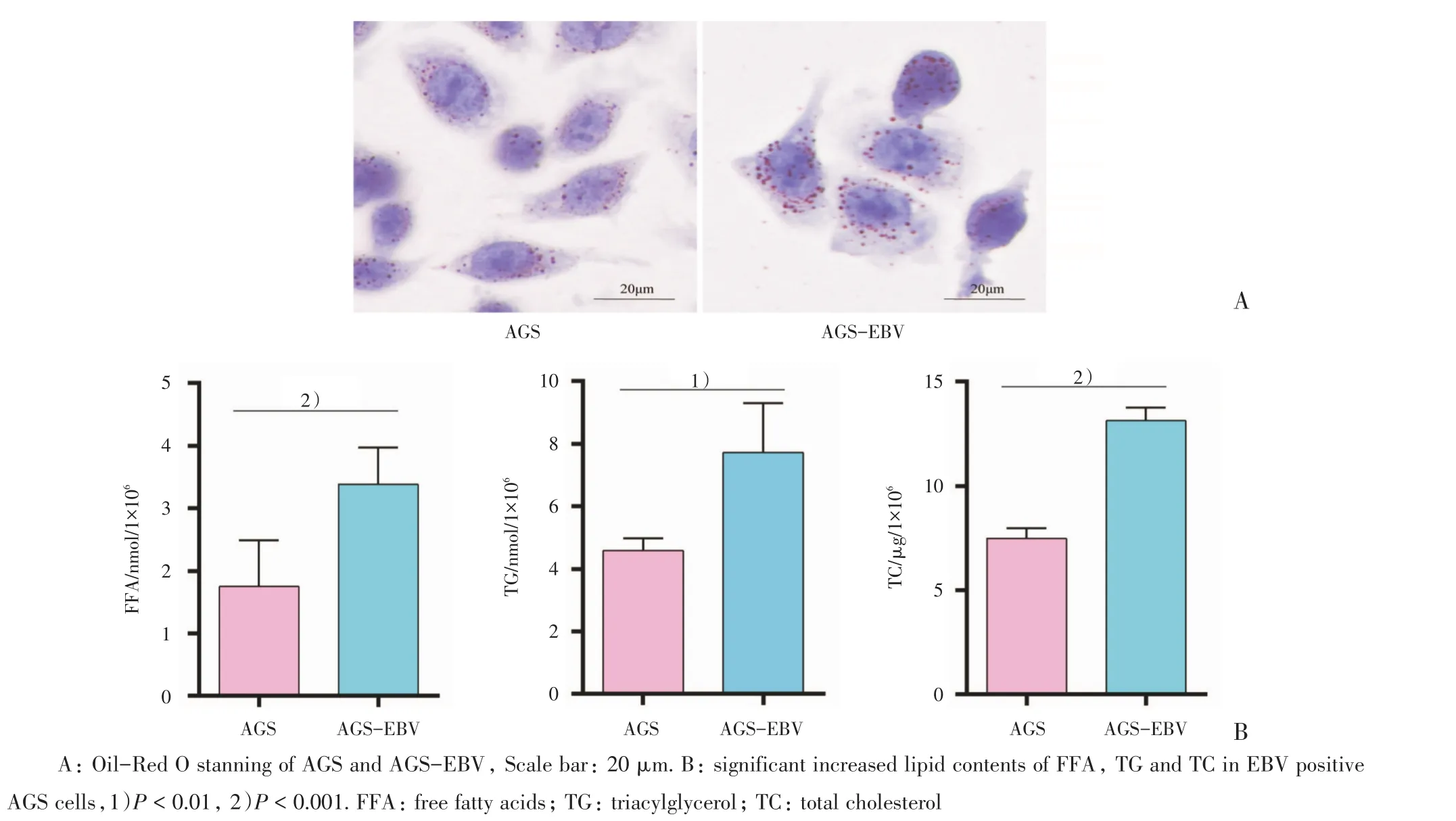
图4 EBV促进胃癌细胞脂质积聚Fig.4 EBV promoted lipid accumulating
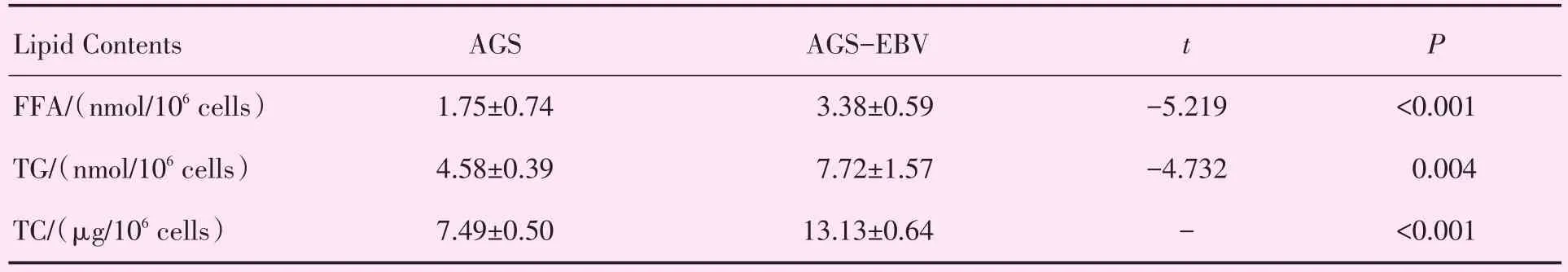
表3 细胞内游离脂肪酸、甘油三酯和总胆固醇含量Table 3 Detection of free fatty acid,triacylglycerol and total cholesterol(n=3)
2.5 EBV上调脂质合成酶mRNA表达
脂肪酸合成途径中,AGS-EBV组FASN、ACC1和ACC2的相对表达量分别为(1.18±0.22,t=-1.413,P=0.231),(1.54±0.32,t=-2.979,P=0.041)和(2.35±0.49,t=-5.225,P=0.014),FASN没有统计学差异,ACC1和ACC2表达均高于AGS组。在甘油三酯合成中,AGS-EBV组中相对表达量MOGAT1未测出,MOGAT2(4.25±1.32,t=-4.275,P=0.013)、MOGAT3(2.38±0.07,t=-36.560,P=0.001)、DGAT1(0.84±0.21,t=1.324,P=0.316)、DGAT2(0.82±0.12,t=2.590,P=0.122),MOGAT2、MOGAT3表达量高于对照组,DGAT1、DGAT2没有明显差异。在胆固醇酯合成过程中HMGCS1(1.83±0.17,t=-8.321,P=0.001)、HMGCR(1.67±0.21,t=-5.522,P=0.031)、ACAT1(2.07±0.36,t=-5.218,P=0.035)的相对表达量,均明显比AGS组表达量高。脂代谢的调节因子SREBP1(5.19±0.78,t=-10.253,P=0.002)、SREBP2(2.37±0.53,t=-4.476,P=0.046)在AGS-EBV组的相对表达量均高于对照组(图5)。
3 讨论
EBV是EBVaGC的致病因子,但EBV在EBVaGC发生发展的作用机制目前仍未得到完全阐明。本研究用CELL-TO-CELL接触感染的方法建立了EBV阳性的AGS-EBV细胞株,并检测了AGS和AGS-EBV的增殖和凋亡水平。结果发现,EBV能促进胃癌细胞增殖,抑制胃癌细胞凋亡。

图5 脂质合成酶的mRNA表达Fig.5 Relative mRNA level of lipogenesis enzymes
肿瘤细胞生长失调,是其无限增殖和凋亡失衡的共同结果,本研究提示EBV能促进胃癌细胞增殖。但别的学者有不同的意见,Jeong等[14]对AGS和AGS-EBV进行细胞计数,结果提示种板后5 d内两组没有差异,而第6、7天AGS的细胞数明显多于AGS-EBV组。Ishii等[15]对比EBVaGC与EBVnGC组织样本的Ki-67表达发现两组差别没有统计学意义。Jeong的实验中相同的细胞必须同时接种多个培养板,多次操作无法保证细胞量的恒定,而且细胞计数操作中消化和计数的过程步骤繁琐,也容易产生误差。Ishii对Ki-67百分率的判定依靠肉眼,过于主观。在我们的研究中,CCK-8实验只需接种一次细胞,而且检测过程简单,结果由电脑精确读数,因此我们更相信EBV促进了胃癌细胞增殖水平。
此外,过表达EBV编码潜伏膜蛋白LMP2A的胃癌细胞生长速度明显加快[16];BARF1上调NF-kappaB/cyclin D1和细胞周期抑制剂p21以促进胃癌细胞增殖[17]。以上证据均支持EBV能促进胃癌细胞增殖。
同时凋亡检测发现相比对照组,AGS-EBV凋亡减少(图3)。Wang等和本课题组之前对胃癌组织样本的研究中,较EBVnGC而言,EBVaGC肿瘤细胞凋亡更少[18-20]。这些结果均说明,EBV的存在改变了胃癌细胞AGS的生长特性,使其对抗凋亡。总而言之,EBV通过促进细胞增殖和抑制凋亡以促进胃癌的发展。
在肿瘤细胞中,细胞增殖和凋亡抑制与代谢重编程息息相关。细胞内脂质尤其是脂肪酸和胆固醇,影响肿瘤的发生发展,包括肿瘤分级、分化程度,以及细胞增殖、凋亡、干性、侵袭性和上皮细胞-间充质转化等生物学行为[21]。病毒也能够通过调节细胞脂代谢来影响肿瘤进展,卡波西肉瘤疱疹病毒的蛋白K1、vGPCR激活PI3K/AKT/mTOR途径介导的FASN上调来维持原发性渗出性淋巴瘤的存活[22]。鼻咽癌中,EBV编码的LMP1、EBER提高宿主细胞的脂代谢水平,由此促进细胞增殖[11-12]。同是来源于上皮的EBV相关肿瘤——EBVaGC与脂代谢重编程之间的联系至今国内未见研究报道。于是我们通过检测AGS和AGSEBV的脂质含量和脂质合成酶表达,来探讨EBV对胃癌细胞脂代谢重编程的影响。
我们发现EBV使胃癌细胞内脂质含量升高。脂滴的基本组成为磷脂单分子层包裹着中心混合脂肪酸的中性脂质,主要成分包括甘油三酯、胆固醇酯和脂肪酸[23]。本研究的油红O染色提示AGS-EBV比AGS中有更多的脂质沉积,脂质定量试剂盒检测结果也显示游离脂肪酸、甘油三酯和总胆固醇都有更高的含量,说明EBV使胃癌细胞的脂质含量升高。
肿瘤中脂质积累最可能是由于合成增多[24],因此我们还检测了游离脂肪酸、甘油三酯和总胆固醇这三种脂质重要的合成酶。脂肪酸合成有两个关键酶ACC和FASN,ACC将乙酰辅酶A转化为丙二酰辅酶A,再由FASN将这两种物质逐步合成不同长度的脂肪酸(图6),我们发现ACC1、ACC2表达上调,说明EBV促进脂肪酸合成来获得更多脂肪酸。甘油三酯合成中,包含甘油一酯途径和甘油二酯途径,甘油一酯途径仅有一个代表性的酶MOGAT,经两个途径最终合成甘油三酯的最后一步都由DGAT催化(图6),我们发现MOGAT2、MOGAT3表达上调,说明EBV激活甘油一酯途径来合成更多甘油三酯。胆固醇合成和酯化有三个重要酶,乙酰辅酶A在HMGCR、HMGCS等酶催化下经30多步反应合成胆固醇,再被ACAT酯化成无细胞毒性的胆固醇酯(图6),我们发现HMGCS1、HMGCR、ACAT1表达上调,说明 EBV通过上调合成酶和酯化酶来促进胆固醇酯的合成。
哺乳动物细胞中还存在调节脂代谢的酶SREBP,通过与脂代谢酶基因的启动子区结合激活其转录。SREBP-1调控下游SCD1、FASN、ACC、ACSS2、ACLY等脂代谢基因的表达,参与脂肪酸合成、胆固醇的合成和摄取;SREBP-2促进下游脂代谢基因HMGCS、HMGCR、LDLR等表达,调控胆固醇合成和摄取[25]。实验发现AGS-EBV组SREBP1和SREBP2的mRNA表达水平分别约为对照组的5倍和2倍,说明EBV通过促进上游因子SREBPs表达来上调脂质合成酶。EBV感染是个复杂的过程,FASN、DGAT等没有发生变化,提示还可能存在其他途径调控脂质合成。
综上所述,本研究首次研究了EBVaGC的脂质代谢水平,发现EBV可能通过上调SREBPs来促进脂质合成,而且这极有可能是造成EBV促进胃癌细胞增殖加快、凋亡减少的原因。我们下一步将通过抑制实验进行验证,进一步阐明EBV通过脂代谢调节胃癌细胞增殖、凋亡的分子机制,并在胃癌组织标本上进行验证。脂质合成在正常体细胞中并不活跃,所以靶向抑制脂质合成对预防、诊断和治疗EBV相关的早期胃癌有很大潜力,值得在临床试验中做进一步研究。

图6 脂肪酸、甘油三酯和胆固醇酯合成示意图Fig.6 The schematic diagram of lipogenesis including fatty acid,triacylglycerol and cholesterol ester

