溶剂法提取微拟球藻脂质的工艺优化及其脂质组学分析
张美兰,赵康宇,张立伟,2,何东平,2,郑竟成,2
(1.武汉轻工大学 食品科学与工程学院,武汉 430023; 2.大宗粮油精深加工教育部重点实验室,武汉 430023)
二十碳五烯酸(EPA)是ω-3多不饱和脂肪酸(PUFA),对人体健康有着重要的作用,其不仅具有良好的调节人体免疫作用[1],还具有抑制肿瘤细胞生长与转移[2]、降低人体甘油三酯水平从而降低动脉粥样硬化风险的功能[3]。
人体内EPA的来源主要有两种,一种是由人体摄入的α-亚麻酸经过碳链延长酶和去饱和酶的作用得到[4]。但根据Hussein等[5]的研究,人体内仅有0.3%的EPA可以由α-亚麻酸转化而来,并不能满足人体日常所需摄入量。另一种来源是通过日常的膳食进行补充。目前,市场上EPA的主要来源是深海鱼油和磷虾油,也是EPA的传统来源,但由于其可持续性较差,供应量无法满足人们日益增长的营养需求[6]。近年来,人们在寻找各种不同的EPA来源,如转基因植物以及海洋微藻[7-9]。
近年来,微藻由于具有单位面积内培育量大,对环境适应能力强的特点[10],被广泛应用于水产养殖业[11]、生物柴油的制备[12]以及高附加值的人体营养膳食补充剂的生产[13]。在众多的微藻中,微拟球藻由于具有生长速率快、脂质积累量高、EPA含量较高的特点,成为近年来制备功能性脂质方向的研究热点[14]。从微拟球藻中提取的脂质含有8%~10%的磷脂、30%~40%的糖脂和30%~40%的中性脂[15]。不同脂类中脂肪酸组成差别较大,EPA在糖脂中含量较高,而在中性脂和磷脂中分布较少,3种脂类中EPA含量之和占微拟球藻总脂质的30%~40%。在正常生长条件下,微拟球藻合成脂肪酸主要用于合成膜脂,膜脂上含有大量的PUFA,在外部条件发生变化时,微藻合成的脂肪酸会转而积累在中性脂上[16]。因此,在提取微拟球藻脂质时,所选方法不仅能提取中性脂,还应能提取极性脂,此外还需要考虑提取的脂质中EPA含量的高低。
近年来,已有多位学者对微拟球藻脂质的提取方法进行了研究,如:Crampon 等[17]研究了气流干燥和冷冻干燥对超临界CO2萃取Nannochloropsisoculata脂质的影响;Ryckebosch等[18]研究了8种溶剂对Nannochloropsisgaditana中脂质提取的影响,发现乙醇提取率较低,且存在纯度较低的情况。采用乙醇提取微拟球藻脂质时,可以得到溶血酰基甘油三甲基高丝氨酸(LDGTS)[19],该物质具有抗动脉粥样硬化的能力,能通过改善高密度脂蛋白(HDL)的质量和功能来促进心血管健康。
本文对比氯仿-甲醇(体积比1∶1)、氯仿、异丙醇、石油醚、正己烷-乙醇(体积比1∶1)、正己烷、乙醇7种溶剂提取微拟球藻脂质对脂质得率及EPA含量的影响,并对乙醇提取微拟球藻脂质工艺条件进行优化,最后对所得脂质进行脂质组学分析,以期为乙醇法提取微拟球藻脂质提供理论基础。
1 材料与方法
1.1 试验材料
微拟球藻藻粉,由山东烟台海融微藻养殖有限公司提供。
氯仿、甲醇、石油醚、正己烷、无水乙醇、无水硫酸钠、丙酮、氯化钠、50%三氟化硼甲醇溶液,分析纯;正己烷、异丙醇、甲醇、乙腈,色谱纯,德国默克集团;EPA甘三酯标品,上海源叶生物有限公司;氘化脂质内标混合物,美国Avanti Polar Lipids公司;HyperSep Silica 固相萃取柱,赛默飞公司。
UPLC LC-10A超高效液相色谱,日本岛津公司;AB ScieX Triple TOF 6600质谱仪;GZX-9070MBE电热鼓风干燥箱;AR423DCN精密电子天平;SHA-B数显恒温水浴振荡器;Agilent 7890A-5975C GC-MS;TDZ5-WS低速离心机。
1.2 试验方法
1.2.1 微拟球藻脂质的提取
取10 g微拟球藻藻粉于锥形瓶中,以一定的料液比加入溶剂,在一定温度下提取一定时间后,将混浊液转移至离心管中,并用相同溶剂洗涤锥形瓶3次,将洗涤液转移至离心管中,在4 000 r/min下离心15 min,收集上清液,经旋转蒸发浓缩后,收集浓缩液于平板中,在60℃下真空干燥至恒重,获得微拟球藻粗脂质。
将微拟球藻粗脂质溶于8 mL氯仿-甲醇(体积比1∶1)中,用2 mL水洗涤,在8 000 r/min下离心15 min,去除上层含有多糖和蛋白质等非脂质物质的水层,取下层氮吹去除溶剂,即为微拟球藻脂质。
微拟球藻脂质得率(Y)按下式计算。
Y=m1/m0×100%
(1)
式中:m1和m0分别为微拟球藻脂质的质量和微拟球藻藻粉的质量。
1.2.2 微拟球藻脂质中EPA含量的测定
甲酯化方法:参照俞喜娜等[20]的方法,取200 mg微拟球藻脂质于10 mL试管中,加入2 mL 0.5 mol/L的KOH-CH3OH溶液,在60℃水浴中振荡30 min;小心加入2 mL 50%的BF3-CH3OH,继续在60℃水浴振荡3 min;加入2 mL饱和NaCl溶液,再加入2 mL色谱级正己烷并振荡,静置后取上清液,过0.25 μm有机滤膜后待GC-MS分析。
GC条件:Agilent HP-88毛细管色谱柱(100 m×25 μm, 0.25 μm);进样口温度260℃;升温程序为140℃保持2 min,以3℃/min升温至185℃,保持5 min,再以3℃/min升温到200℃,保持3 min,再以2.5℃/min升到225℃,保持5 min;进样量1.0 μL;分流比1∶40。
MS条件:EI离子源,电离能量70 eV,离子源温度230℃,四极杆温度150℃,接口温度250℃,全扫描模式,质量扫描范围(m/z)50~550,溶剂延时5 min。
EPA含量按照GB 5009.168—2016《食品安全国家标准 食品中脂肪酸的测定》第二法外标法中公式进行计算。
1.2.3 微拟球藻脂质的脂质组学分析
样品前处理:称取10.0 mg微拟球藻脂质于1 mL 异丙醇中,涡旋30 min使其充分溶解,加入异丙醇稀释至100倍后,加入10 μL 100 μg/mL的氘化脂质内标混合物,涡旋30 s后于12 000 r/min离心5 min,取上层清液过0.22 μm有机滤膜后,待UPLC-Q-TOF-MS测定。
UPLC条件:Phenomenex Kinete C18色谱柱(100 mm×2.1 mm,2.6 μm);柱温60℃;进样量1 μL;流动相中A相为H2O-甲醇-乙腈(体积比1∶1∶1,含5 mmol/L NH4Ac),B相为异丙醇-乙腈(体积比5∶1 ,含5 mmol/L NH4Ac);流速0.4 mL/min;流动相梯度洗脱程序按表1进行。

表1 流动相梯度洗脱程序
MS条件:ESI离子源,正模式,质量扫描范围(m/z)100~1 200,干燥气压力0.24 MPa,离子源气体1压力0.35 MPa,离子源气体2压力0.35 MPa,离子喷射电压5 500 V,温度600℃。
1.2.4 数据统计

2 结果与分析
2.1 不同提取溶剂对微拟球藻脂质得率及EPA含量的影响
在料液比1∶10、提取温度25℃、提取时间3 h的条件下,考察不同提取溶剂对微拟球藻脂质得率和EPA含量的影响,结果如图1所示。

注:CM.氯仿-甲醇(体积比1∶1);C.氯仿;I.异丙醇;Pe.石油醚;HE.正己烷-乙醇(体积比1∶1);H.正己烷;E.乙醇。同一指标不同字母表示存在显著差异(p<0.05)。下同
由图1可知,与氯仿-甲醇(体积比1∶1)和正己烷-乙醇(体积比1∶1)混合溶剂相比,采用单一溶剂进行微拟球藻脂质提取时脂质得率普遍较低,而EPA含量却因溶剂不同呈现出一定的差异。这是由于微拟球藻脂质中含有中性脂与极性脂两类脂质,且微拟球藻中EPA主要分布于细胞膜脂等极性脂上,故当提取出的脂质中极性脂含量较高时,提取物中的EPA含量较高。如采用正己烷-乙醇(体积比1∶1)混合溶剂提取时,正己烷多用于提取中性脂,乙醇用于提取极性脂。采用单一溶剂提取时,乙醇提取的脂质EPA含量最高。考虑到脂质的提取过程需要绿色、安全、无毒,以及较高含量的EPA,因此选择乙醇作为提取溶剂。
2.2 乙醇提取微拟球藻脂质的工艺优化
2.2.1 单因素试验
2.2.1.1 乙醇体积分数对微拟球藻脂质提取的影响
在料液比1∶10、提取温度65℃、提取时间3 h的条件下,考察乙醇体积分数对微拟球藻脂质得率和EPA含量的影响,结果见图2。

图2 乙醇体积分数对微拟球藻脂质提取的影响
由图2可知,微拟球藻脂质得率随着乙醇体积分数的增大先升高后减少,脂质中EPA含量变化与脂质得率的趋势相同,脂质得率与EPA含量都在乙醇体积分数为90%时达到最高。综合考虑,选择最佳乙醇体积分数为90%。
2.2.1.2 料液比对微拟球藻脂质提取的影响
在乙醇体积分数90%、提取温度65℃、提取时间3 h的条件下,考察料液比对微拟球藻脂质得率和EPA含量的影响,结果见图3。
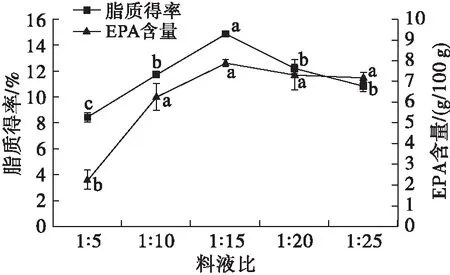
图3 料液比对微拟球藻脂质提取的影响
由图3可知,微拟球藻脂质得率与EPA含量均随着料液比的增加先增加后降低,当料液比为1∶15时,脂质得率与EPA含量均最大。综合考虑,选择最佳料液比为1∶15。
2.2.1.3 提取温度对微拟球藻脂质提取的影响
在提取时间3 h、乙醇体积分数90%、料液比1∶15 条件下,考察提取温度对微拟球藻脂质得率和EPA含量的影响,结果见图4。

图4 提取温度对微拟球藻脂质提取的影响
由图4可知,随着提取温度的升高,脂质得率和EPA含量均先升高后降低,在提取温度为65℃时,脂质得率和EPA含量最高。这是因为在提取温度低于65℃时,提取温度的上升使溶剂分子运动增强,有利于溶剂分子扩散进入微拟球藻细胞中对脂质进行提取,因此提取温度的上升有利于脂质的提取;而当提取温度高于65℃时,温度过高会导致料液间出现汽化层,渐渐阻碍了溶剂分子的扩散,不利于微拟球藻脂质的提取。同时,EPA不饱和度较高,高温时易发生氧化。综合考虑,选择最佳提取温度为65℃。
2.2.1.4 提取时间对微拟球藻脂质提取的影响
在提取温度65℃、乙醇体积分数90%、料液比1∶15条件下,考察提取时间对微拟球藻脂质得率和EPA含量的影响,结果见图5。

图5 提取时间对微拟球藻脂质提取的影响
由图5可知,微拟球藻脂质得率随着提取时间的延长先上升后趋于稳定,在提取时间2 h时微拟球藻脂质的提取达到平衡。随着提取时间的延长,EPA含量呈波动变化趋势。综合考虑,选择最佳提取时间为2 h。
2.2.2 正交试验
在单因素试验基础上,以乙醇体积分数、料液比、提取温度和提取时间为因素,分别以微拟球藻脂质得率和EPA含量为指标,采用四因素三水平正交试验L9(34)优化微拟球藻脂质的提取工艺条件。正交试验因素水平见表2,正交试验设计与结果见表3。

表2 正交试验因素水平

表3 正交试验设计与结果
由表3可知,各因素对微拟球藻脂质得率影响的主次顺序为B(料液比)>C(提取温度)>A(乙醇体积分数)>D(提取时间)。最佳工艺参数组合为A1B3C2D2,即乙醇体积分数80%、料液比1∶17.5、提取温度65℃、提取时间2 h。
各因素对微拟球藻脂质中EPA含量影响的主次顺序为D(提取时间)>C(提取温度)>B(料液比)>A(乙醇体积分数)。最佳工艺参数组合为A1B3C1D2,即乙醇体积分数80%、料液比1∶17.5、提取温度60℃、提取时间2 h。
由于两个指标的最佳工艺参数组合中,乙醇体积分数、料液比和提取时间相同,仅提取温度存在差异,故分别对两个指标的工艺参数组合进行试验。
当工艺参数组合为A1B3C2D2时,微拟球藻脂质得率为(15.87±0.21)%,EPA含量为(14.49±0.14) g/100 g。当工艺参数组合为A1B3C1D2时,微拟球藻脂质得率为(15.73±0.17)%,EPA含量为(12.49±0.31)g/100 g,该条件下EPA含量低于A1B3C2D2组合条件下的,可能是因为没有考虑到各因素的交互作用。两种条件下脂质得率相差不大,而EPA含量相差较大,故选择工艺参数组合A1B3C2D2作为微拟球藻脂质提取的最佳工艺条件。
2.3 微拟球藻脂质的脂质组学分析
对最佳条件下提取的微拟球藻脂质进行脂质组学分析,结果见表4。微拟球藻脂质中含有EPA的脂质种类及含量见表5。
由表4可知,乙醇提取的微拟球藻脂质中含有17种脂质。其中,糖脂(SQDG、LDGTS、DGDG、MGDG、DGTS和DGGA)的含量最高,占总脂质的62.2%,其次为磷脂(Cer、LPC、LPE、LPG、PC、PE、PG和PI),占总脂的25.2%,中性脂(DG和TG)含量占总脂的5.1%。

表4 微拟球藻脂质中脂质组成及含量 mg/g

表5 微拟球藻脂质中含EPA的脂质种类及含量 mg/g
由表5可知,含有EPA的脂质有12种,含有EPA的脂质含量按照由高到低依次为DGDG>LDGTS>PG>PC>MGDG>TG>DG>DGTS>PE>LPC>LPE=LPG。微拟球藻中的EPA主要是在内质网中合成,并进一步输出到质体中与半乳糖脂结合,因此含EPA较多的是DGDG和LDGTS。在DGDG中,含EPA的物质占总DGDG的80.3%; 在LDGTS中,含EPA的物质占总LDGTS的70.7%;在微拟球藻17种脂质中,含EPA的脂质占总脂质的45.24%。
3 结 论
乙醇提取微拟球藻脂质的最佳工艺条件为乙醇体积分数80%、料液比1∶17.5、提取温度65℃、提取时间2 h,在最佳条件下微拟球藻脂质得率为(15.87±0.21)%,EPA含量为(14.49±0.14)g/100 g。
采用 UPLC-Q-TOF-MS对微拟球藻脂质进行脂质组学分析,共检出17种脂质,分别是神经酰胺(Cer)、游离脂肪酸(FA)、溶血磷脂酰胆碱(LPC)、溶血磷脂酰乙醇胺(LPE)、溶血磷脂酰甘油酯(LPG)、单半乳糖酰甘油二酯(MGDG)、磷脂酰胆碱(PC)、磷脂酰乙醇胺(PE)、磷脂酰甘油(PG)、磷脂酰肌醇(PI)、甘油二酯(DG)、双半乳糖甘油二酯(DGDG)、二酰基甘油葡糖醛酸(DGGA)、二酰甘油-N-三甲基高丝氨酸(DGTS)、溶血酰基甘油三甲基高丝氨酸(LDGTS)、硫代异鼠李糖甘油二酯(SQDG)和甘油三酯(TG),其中12种脂质含有EPA,含EPA最多的脂质是DGDG,其次是LDGTS,在微拟球藻17种脂质中,含EPA的脂质占总脂质的45.24%。

