植物甾醇对脂多糖诱导小鼠炎症的抑制作用
赵云博, 王宁静, 胡永员, 牛永洁, 孟永宏
(1.陕西海斯夫生物工程有限公司,陕西 杨凌 712199; 2.陕西师范大学 食品工程与营养科学学院,西安 710119)
随着我国居民对肉制品日益增长的需求,我国的养殖规模也在不断扩大,但是如果养殖环境差、技术水平低,易引发饲养的动物炎症。饲养动物发生炎症,不仅造成其能量损失[1],而且会引发大规模传染,增加饲养动物病死率,养殖场经济效益受影响。同时,患病动物也会对国民健康造成危害。因此,筛选有效抗炎的天然成分以抑制饲养动物炎症已成为养殖行业的重要课题[2-4]。
植物甾醇(Phytosterol,PS)是天然类固醇化合物,主要来源于植物油、植物种子和豆类产品[5-6]。《饲料添加剂品种目录(2013)》中植物甾醇可作为饲料添加剂使用。近年来国内外对天然成分植物甾醇的体外抗炎功效做了大量研究,如:Caroprese等[2]研究揭示了植物甾醇对体外免疫调节和抗炎活性的有益作用;Vilahur[3]、Fraile[7]等分别在绵羊和猪的体外研究中发现,植物甾醇可以增加外周血单个核细胞(PBMC)的数量,从而提升动物抗炎活性;于学珍等[8]研究发现,植物甾醇凝胶对小鼠烧伤部位有抗炎作用,可减小溃疡面积,减少炎症细胞渗出。但上述研究主要在细胞水平上证实植物甾醇的抗炎作用,并且侧重于研究植物甾醇的治疗作用,而植物甾醇在生物体水平的预防炎症效果和作用机制依然缺乏。
本研究利用脂多糖诱导小鼠发生炎症,研究植物甾醇对小鼠血清炎症因子,肝脏、脾脏组织病理学损伤,免疫组化,促炎症细胞因子转录及通路蛋白表达的影响,揭示植物甾醇抗炎作用机制,为以植物甾醇为原料开发新型抗炎产品提供科学依据,并以期通过天然抗炎成分植物甾醇的推广使用,提高养殖业利润,保障国民健康。
1 材料与方法
1.1 实验材料
雄性SPF级KM小鼠,西安交通大学动物实验中心(许可证号SYXK(陕)2020-005);小鼠颗粒型日粮维持饲料,河南天驰实验动物饲料厂;植物甾醇(纯度≥95%),陕西海斯夫生物工程有限公司;脂多糖(LPS)、地塞米松(DXMS)、RIPA裂解液、苯甲基磺酰氟(PMSF)以及白介素1β(IL-1β)、白介素6(IL-6)和肿瘤坏死因子α(TNF-α)的ELISA试剂盒,北京索莱宝公司;苏木精-伊红(HE)染液,武汉赛维尔生物科技有限公司;Trizol,Invitrogen公司;HiScript II Q RT SuperMix for qPCR (+gDNA wiper)试剂盒、ChamQ Universal SYBR qPCR Master Mix试剂盒,南京诺唯赞生物科技有限公司;一氧化氮合酶(iNOS)抗体,Bioss公司;β-肌动蛋白(β-actin)、NF-κB p65蛋白、NF-κB 磷酸化p65(Pp65)蛋白、辣根过氧化物酶(HRP)标记的二抗,Abcam公司;BCA蛋白定量试剂盒、Tunel染色试剂盒,碧云天生物技术有限公司;聚偏氟乙烯(PVDF)膜,Merck Millipore公司。
Thermo1500全波长酶标仪,Sigma高速离心机,BioRad ELITE300电泳仪,Light Cycler Nano 荧光定量PCR仪,TANON 5200MULTI显影仪,DMi8AUTOL MATED倒置显微镜,Veriti 96 Well 梯度PCR仪。
1.2 实验方法
1.2.1 实验动物分组及处理
将50只体重为(22±2)g的雄性SPF级KM小鼠平均分成5组,分别记为空白对照组、脂多糖对照组、植物甾醇低剂量组、植物甾醇高剂量组、地塞米松组。实验期间小鼠自由摄食及饮水,3~4只/笼分笼饲养于SPF级饲养环境,室温(20±2)℃,相对湿度40%~70%,每日明暗比12 h/12 h。适应性饲喂5 d,然后进行灌胃给药,其中:空白对照组与脂多糖对照组灌胃0.5 mL 4%吐温80溶液;植物甾醇低、高剂量组分别灌胃0.5 mL植物甾醇4%吐温80溶液,使最终的植物甾醇灌胃剂量分别达到20、200 mg/kg;地塞米松组灌胃0.5 mL地塞米松4%吐温80溶液,对应地塞米松灌胃剂量为5 mg/kg。每日灌胃1次,连续7 d,最后1 d断水断粮,于最后一次灌胃1 h后,空白对照组腹腔注射生理盐水0.5 mL,其余4组注射0.5 mL质量浓度为0.2 mg/mL的脂多糖。脂多糖处理6 h后,观察小鼠状态,待确认小鼠建模成功后,采血后处死小鼠并进行解剖,采集脾脏、肝脏,称重,计算肝脏指数;5组各选1例制作石蜡切片,用于组织病理学和免疫组化分析;剩余保存于-80℃,用于目的基因mRNA转录和目的蛋白表达分析。
1.2.2 ELISA试剂盒检测血清中相关炎症因子
将血浆离心后得到血清,按照ELISA试剂盒说明书进行炎症因子IL-1β、IL-6、TNF-α检测。
1.2.3 HE染色法观察肝脏、脾脏组织病理学
将肝脏和脾脏部分制作石蜡切片后进行HE染色,在显微镜下观察肝脏和脾脏组织的病理学变化。
1.2.4 免疫组化法检测肝脏及脾脏的iNOS表达
参考缪福俊等[9]的方法对石蜡切片进行染色和处理,采用Olym-pusDP-71图像分析系统进行观察、拍照,其中阳性表达呈棕黄色,每张切片从(400×)的视野中随机取样5次,采用Image-ProPlus软件计算分析每个视野中iNOS阳性细胞表达的平均光密度值。
1.2.5 实时荧光定量PCR(RT-qPCR)检测肝脏及脾脏中iNOS和SHP-1的mRNA转录
参考Rizzi等[10]的方法,iNOS、SHP-1和β-actin引物用Primer Premier 5.0软件进行设计,由生工生物工程(上海)股份有限公司合成,其中iNOS引物序列(参考基因序列号NC_000077.7)、SHP-1引物序列(参考基因序列号NM_013545.3)见表1。以β-actin作为内参基因,采用2-ΔΔCt法计算目的基因的mRNA转录水平。

表1 iNOS、SHP-1和β-actin基因引物序列
1.2.6 蛋白质免疫印迹法(Western Blot)检测肝脏中NF-κB p65蛋白和磷酸化p65蛋白的表达
参考丁程程等[11]的方法,将孵育至PVDF膜上的蛋白显色后,使用成像设备扫描蛋白条带并用Image lab软件对条带灰度进行分析,目的蛋白以β-actin为内参进行校正。
1.2.7 数据统计
实验数据表示为“平均值±标准差”,使用SPSS 17.0中的单因素方差分析进行数据分析,组间比较采用LSD法检验,P<0.05为差异显著,P<0.01为差异极显著,用Graphpad Prism5软件作图。
2 结果与分析
2.1 植物甾醇对小鼠体重与肝脏指数的影响(见表2)

表2 植物甾醇对小鼠体重与肝脏指数的影响
脂多糖是研究由细菌感染引起炎症反应的理想模型[12],常用作甾体药物抗炎实验的致炎因子。地塞米松是常用的抗炎类甾体药物,与植物甾醇结构类似[13]。经脂多糖造模6 h后,可观察到脂多糖对照组小鼠精神状态变弱,聚堆抱团,而空白对照组与其他各处理组小鼠精神状态良好,具有良好活力,说明造模成功。由表2可知,脂多糖对照组小鼠肝脏指数相较空白对照组增加了4.66%,与脂多糖对照组相比,经过预饲喂植物甾醇小鼠肝脏指数降低(差异不显著,P>0.05),且相比于植物甾醇低剂量组,植物甾醇高剂量组肝脏指数降低更多,证明炎症有所减轻,而地塞米松组小鼠肝脏指数相比其他组显著升高,可能与饲喂地塞米松显著降低了小鼠的体重有关。
2.2 植物甾醇对小鼠血清中IL-1β、IL-6、TNF-α的影响(见表3)
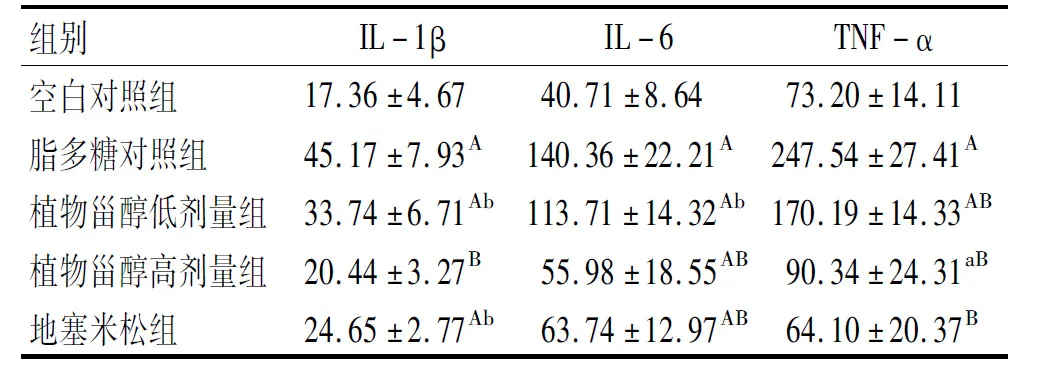
表3 植物甾醇对小鼠血清中IL-1β、IL-6和TNF-α含量的影响 ng/L
炎症的发生和促进主要由免疫细胞驱动[14],所以由免疫细胞产生的相关炎症因子可以反映炎症的严重程度。IL-1β、IL-6、TNF-α参与了炎症相关疾病的发病机制,是炎症反应的关键靶点和抗炎指标[15]。由表3可以看出:与空白对照组比较,脂多糖对照组小鼠血清中的炎症因子含量极显著升高(P<0.01);与脂多糖对照组相比,植物甾醇低、高剂量组小鼠炎症因子IL-1β、IL-6和TNF-α含量显著(P<0.05)或极显著(P<0.01)降低,且高剂量组降低更多,相比于脂多糖对照组分别降低了54.75%、60.12%、63.50%,说明植物甾醇可有效降低炎症的损害程度。
2.3 植物甾醇对小鼠肝脏、脾脏组织形态的影响
图1为小鼠肝脏、脾脏组织病理学观察结果。

注:A.空白对照组;B.脂多糖对照组;C.植物甾醇低剂量组;D.植物甾醇高剂量组;E.地塞米松组。下同
由图1可知:空白对照组小鼠的肝脏组织、肝血窦及中央静脉细胞无明显形态改变,肝细胞轮廓清晰;经脂多糖诱导,小鼠肝细胞肿胀且部分细胞核染色加深;植物甾醇低、高剂量组与地塞米松组小鼠的肿胀肝细胞数目明显减少,肝细胞细胞核边界明显。脾脏组织病理学观察显示,空白对照组小鼠脾脏组织无明显病理学变化,脂多糖诱导后小鼠脾脏白髓异常增生,生发中心出现,植物甾醇低剂量组小鼠依然可见白髓和生发中心,但相比脂多糖对照组有所改善,植物甾醇高剂量组和地塞米松组小鼠白髓增生明显减轻,接近空白对照组。病理学观察结果显示饲喂植物甾醇后可以有效抑制炎症导致的小鼠内脏损伤。
2.4 植物甾醇对小鼠肝脏、脾脏中iNOS表达的影响(见表4、图2)
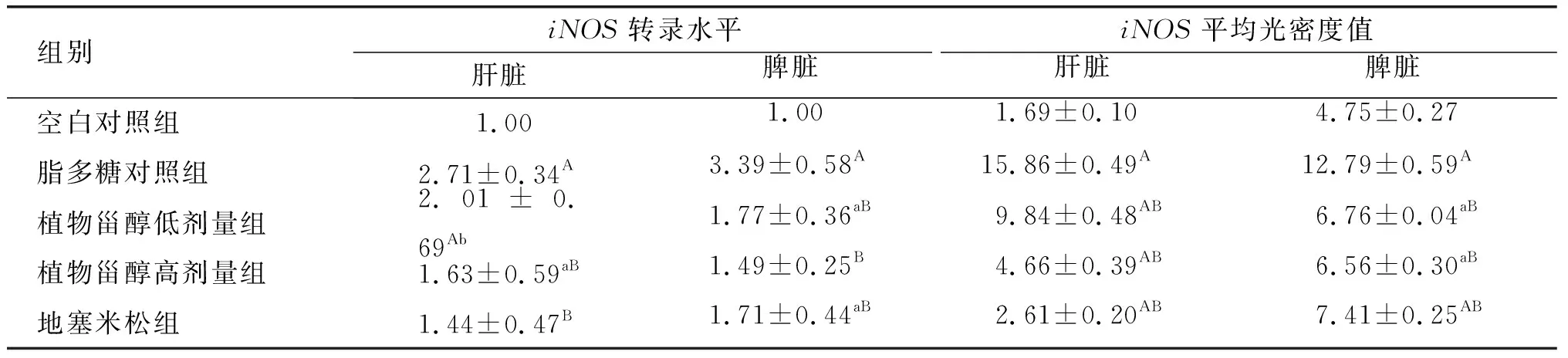
表4 植物甾醇对小鼠肝脏、脾脏中iNOS 基因mRNA转录水平、平均光密度值的影响

图2 小鼠肝脏、脾脏iNOS基因分布(400×)
在正常生理条件下,iNOS一般不表达或低表达,但是发生炎症后会在巨噬细胞和白细胞中分泌[16]。郑海崇等[17]研究发现,大鼠肺部发生炎症感染时,可以通过抑制iNOS表达来抑制炎症因子的分泌。因此,组织内的iNOS可以反映炎症的发生情况。
由表4可知:植物甾醇对经脂多糖诱导的小鼠的肝脏和脾脏中iNOS基因的mRNA转录水平有一定的抑制作用,且植物甾醇高剂量组的抑制效果更好;相较于脂多糖对照组,植物甾醇高剂量组小鼠的肝脏和脾脏中iNOS转录水平极显著降低(P<0.01),分别降低了39.85%、56.05%。由图2可以看出,5组小鼠肝脏细胞中出现了不同程度的iNOS阳性染色,主要出现在肝血窦,破裂的细胞周边区域也有少量。脾脏组织的白髓区有较为明显的阳性信号出现,脾脏血管中也有部分阳性信号,植物甾醇高剂量组与地塞米松组iNOS阳性信号相对降低。相比于脂多糖对照组,植物甾醇低、高剂量组小鼠肝脏和脾脏iNOS平均光密度值极显著降低(P<0.01),且高剂量组降低更多,较脂多糖对照组分别降低了70.62%、48.70%,镜下可明显观察到植物甾醇处理对炎症的减轻有明显效果。
2.5 植物甾醇对小鼠NF-κB p65蛋白和磷酸化p65蛋白水平的影响(见表5、图3)

表5 小鼠肝脏中NF-κB p65蛋白和Pp65蛋白水平 ng/L

图3 小鼠肝脏中NF-κB p65蛋白和Pp65蛋白的表达
NF-κB几乎存在于所有动物中,当受到外界刺激时NF-κB与其抑制蛋白IκB分离并磷酸化产生活性,是体内免疫应答的关键一环[18]。iNOS是NF-κB信号转导中的转导分子[19]。因此,NF-κB p65蛋白和磷酸化p65(Pp65)蛋白的表达情况可以反映小鼠炎症的程度。由表5可知,与空白对照组相比,脂多糖对照组小鼠的p65蛋白及Pp65蛋白水平极显著升高(P<0.01),分别升高180.6%和94.6%。与脂多糖对照组相比,植物甾醇低、高剂量组小鼠肝脏组织中p65蛋白及Pp65蛋白水平显著(P<0.05)或极显著(P<0.01)降低,证明炎症发展程度更低,图3也直观地证明了该结论。
2.6 植物甾醇对小鼠肝脏、脾脏SHP-1基因mRNA转录水平的影响(见表6)
SHP-1是许多信号通路中必不可少的调节分子,免疫反应过程中其功能涉及先天免疫和适应性免疫,可以抑制NF-κB等因子的活化,在抗炎症方面发挥了重要作用[20-21]。由表6可以看出,与脂多糖对照组相比,植物甾醇低、高剂量组小鼠肝脏、脾脏SHP-1基因转录水平极显著升高(P<0.01),且高剂量组与空白对照组相比无显著差异,表明植物甾醇可以显著提高小鼠的抗炎能力,控制炎症发展。
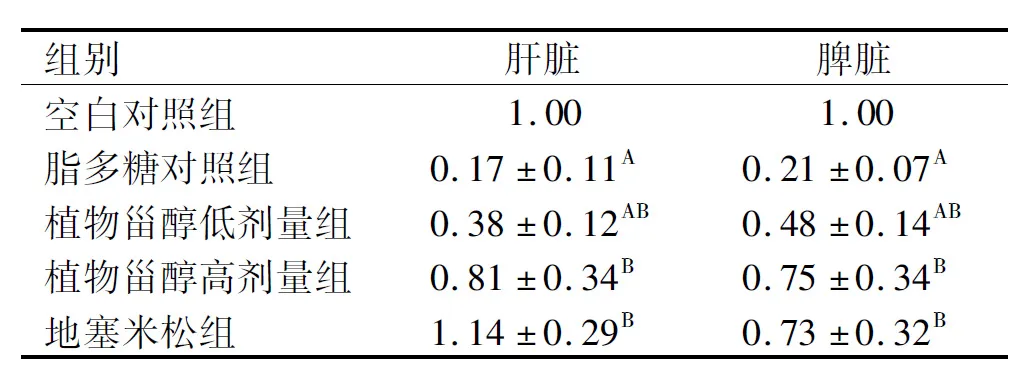
表6 在小鼠肝脏、脾脏中SHP-1基因的转录水平
2.7 讨论
Gupta等[22]首次发现天然活性物质植物甾醇的抗炎能力后,其他科研人员在细胞水平上做了很多验证。通过分析已有文献发现,植物甾醇的生物活性都是基于植物甾醇与胆固醇竞争抑制进入机体后发生的,其主要抗炎机制在于抑制NF-κB p65蛋白及其磷酸化,其原因是摄入植物甾醇后,提升了法尼醇X受体(FXR)/SHP-1合成胆汁酸通路的表达水平[23],其中SHP-1又可作为NF-κB的上游负调控因子,因此结合本文研究结果推测,SHP-1的升高抑制NF-κB激活,进而降低iNOS表达水平,抑制下游炎症因子IL-1β、IL-6和TNF-α的生成,从而降低炎症对机体器官的损害,对炎症发生起到预防作用。
相比于白藜芦醇、大蒜素、牛磺酸和百里香酚等具有抑制炎症作用的天然活性物质,植物甾醇具有更加全面的生理功能。白藜芦醇通过抑制MAPK蛋白激酶减轻炎症对肝脏的损伤[24]。大蒜素通过提高巨噬细胞的吞噬功能,抑制 IL-6的分泌发挥抗炎作用[25]。牛磺酸主要通过内皮依赖性和非依赖性机制诱导血管扩张,减少炎症对内皮损伤[26]。百里香酚的主要作用器官多为乳腺、子宫等雌性特有器官[27-28]。本研究发现植物甾醇不仅抗炎效果显著,前期实验发现其还具有良好的促进生长效果,机制明确,有更广泛的应用范围。
3 结 论
研究了植物甾醇对脂多糖诱导小鼠炎症的抑制作用。结果表明,植物甾醇可提高饲养小鼠的抗炎能力,通过抑制炎症发展降低炎症导致的器官损伤,可在我国养殖行业全面替代抗生素方面发挥重要作用。

