N-cadherin对视网膜色素上皮细胞增殖及迁移侵袭的影响
李艳梅,方珍珍,杨 霞,高国全,周 倜
(中山大学中山医学院生化教研室,广东广州510080)
糖尿病视网膜病变(diabetic retinopathy,DR)是全球最常见的致盲疾病之一[1],纤维增生膜的产生是增生性糖尿病视网膜病变的基本病理表现之一,涉及视网膜色素上皮细胞(retinal pigment epithelial,RPE)、胶质细胞的增殖迁移[1-3]。研究发现,高糖可引起RPE细胞增殖迁移、分化和功能方面的改变[4],糖尿病视网膜存在以N-cadherin升高为主要特征的上皮-间质细胞转化(epithelialmesenchymal transition,EMT)现象[5-6],而 N-cadherin在DR中的作用及机制还需要进一步探索。N-cadherin属于跨膜糖蛋白Cadherins超家族的成员,不同于其他上皮细胞,人RPE细胞主要表达N-cadherin而不是E-cadherin,在正常视网膜中,N-cadherin作为粘着连接主要的组成部分,介导细胞与细胞间和细胞与基质的连接,参与一系列生理和病理过程[7]。正常情况下N-cadherin参与邻近的RPE细胞连接和上皮细胞表型的维护,而在增生性玻璃体视网膜病变等疾病情况下,N-cadherin从细胞骨架中释放出来参与细胞重排和侵袭[8]。在人鳞状上皮癌和黑色素瘤中,肿瘤细胞倾向于与N-cadherin阳性的基质细胞粘附,N-cadherin可促进肿瘤细胞的侵袭性[9-11],但N-cadherin在糖尿病视网膜中的表达及其功能目前还没有报道。本研究的目的在于研究N-cadherin对RPE细胞增殖、迁移、侵袭的影响,并探讨下调N-cadherin对高糖诱导的RPE细胞的影响及其作用机制,从而为糖尿病视网膜病变的治疗提供新的角度。
1 材料与方法
1.1 实验资料
人视网膜色素上皮细胞ARPE65来源于美国ATCC细胞库;腺病毒Ad-N-cadherin(Ad-N-cad)、Ad-si N-cadherin(si N-cad)及对照腺病毒由赛业生物科技有限公司构建。DMEM培养基、胎牛血清、胰酶Trypsin-EDTA(1X)、青/链霉素购自美国Gibco公司;Transwell小室购自Millipore公司;基质胶Matrigel购自BD公司;D-glucose、L-glucose、结晶紫购自Sigma公司;CCK8试剂盒购自上海碧云天公司。
1.2 实验方法
1.2.1 ARPE19细胞培养 配制含10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的DMEM培养基,于37℃、体积分数5%CO2培养箱中培养细胞,培养箱充分保持湿度。待贴壁生长至约90%的汇合率时,胰酶消化、传代,所有实验用细胞均处于对数生长期,Ad-GFP、Ad-N-cad、si Con及si N-cad分别感染细胞。高糖刺激前先用无血清DMEM培养基饥饿24 h,然后加入终浓度为30 mmol/L的D-glucose(HG)和对照L-glucose(LG)对ARPE19细胞进行处理。
1.2.2 CCK8测定细胞增殖 用0.5 g/L胰酶消化对数生长期细胞,于48孔板内接种细胞悬液(每孔2×104个细胞),设置5~6个复孔,细胞贴壁后,Ad-GFP、Ad-N-cad、si Con及si N-cad感染细胞,把细胞置于37℃,体积分数5%CO2饱和湿度培养箱内培养。培养12、24、48 h后分别添加20 μL的CCK8试剂到每个孔内,再继续培养2 h,酶标仪波长设置为450 nm,测定每孔吸光度。实验重复3次。
1.2.3 Transwell小室检测细胞迁移能力 迁移在transwell小室中进行。使用胰酶消化腺病毒感染后的ARPE19细胞,加培养基终止消化后离心去除培养液,用PBS清洗1~2遍,用无血清的培养基重悬。调整细胞密度至1~5×105。取细胞悬液100~200 μL加入Transwell小室(预先用无血清DMEM培养液水化小室),24孔板下室一般加入600 μL含20%FBS的培养基,每组设3个复孔。常规培养14 h后用PBS洗2次,使用40 g/L多聚甲醛固定10 min,0.1%结晶紫染色5 min。用棉签轻轻擦去上室细胞,显微镜下随机选取若干个视野观察拍照。后使用200 μL 33%醋酸来洗脱结晶紫,检测洗脱液595 nm处的吸光度。
1.2.4 Transwell小室检测细胞侵袭能力 预先用4℃预冷的无血清培养基稀释Matrigel,加入100 μL稀释后的Matrigel包被Transwell小室底部膜,37℃温育4~5 h。将50 μL含10 g/L BSA的无血清培养液加到每个孔内,于37℃放置30 min以水化基底膜,后续实验步骤同迁移实验。
1.2.5 重组腺病毒的扩增 用人胚肾细胞293A扩增N-cadherin、si N-cadherin和对照重组腺病毒。含10%FBS的高糖DMEM培养液培养293A细胞,置于37℃体积分数5%CO2的细胞培养箱中培养,每3 d以1∶3传代扩增。待细胞长至90%后,在培养液中加入10 μL病毒保存液,混匀后置于37℃体积分数5%CO2的细胞培养箱。培养72 h观察,待超过90%细胞变圆后,将培养液和细胞收集至15 mL离心管中,置于-80℃冰箱和室温反复冰融5次,4 ℃ 5 000 r/min(r=8.5 cm)离心30 min,收集上清,用孔径0.22 μm的滤膜过滤,用0.5 mL EP管分装冻于-80℃冰箱。
1.3 统计学方法
所有实验均独立重复3次或以上,使用SPSS 20.0软件对数据进行统计学分析,统计结果均以均数±标准差(Mean±SD)表示,多组比较,数据符合正态分布且方差齐时采用单因素方差分析,差异有统计学意义时使用Bonferroni法进行多重比较;两组间比较时数据呈正态分布且方差齐采用t检验,方差不齐时采用校正的t检验;P<0.05认为差异有统计学意义。
2 结果
2.1 过表达N-cadherin对ARPE19细胞迁移的影响
为了研究N-cadherin在ARPE19细胞增殖、迁移、侵袭中的作用和机制,构建了干扰N-cadherin的 siRNA(si N-cad)和过表达 N-cadherin cDNA(Ad-N-cad)的腺病毒,采用si Con和Ad-GFP分别作为干扰N-cadherin基因和过表达N-cadherin基因的阴性对照。Transwell实验结果显示,采用Ad-N-cadherin感染细胞后,与对照组相比,Ad-N-cadherin组的视网膜色素上皮细胞迁移至小室的细胞数明显增多(Ad-N-cad:0.390.03 vs.Ad-GFP:0.350.03,t=2.346,P=0.042;图1)。表明N-cadhein促进RPE细胞迁移。

图1 过表达N-cadherin对ARPE19细胞迁移的影响Fig.1 Effect of N-cadherin overexpression in ARPE19 cells on its migration capability
2.2 调控N-cadherin表达对ARPE19细胞增殖的作用
高糖处理ARPE19细胞48、72、96 h细胞增殖能力明显增强(P<0.001),同时,相比于对照组,Ad-si N-cadherin组显著抑制高糖所增强的细胞增殖能力(图2,表1)。
2.3 沉默N-cadherin表达对ARPE19细胞迁移的作用
Transwell实验结果显示,高糖处理后ARPE19细胞迁移至小室的细胞数明显增多,表明垂直迁移能力明显增强,与高糖处理并转染si Con组相比,干扰N-cadherin的表达可以显著抑制由HG诱导视网膜色素上皮细胞的迁移作用(图3)。
2.4 调控N-cadherin表达对ARPE19细胞侵袭的作用
Matrigel Transwell小室侵袭实验表明:与以往研究相一致,高糖可以增强细胞的侵袭力。虽然对照腺病毒si Con一定程度上影响了细胞的侵袭能力,但是干扰N-cadherin仍然十分显著的减少了细胞侵袭。提示降低N-cadherin表达可以明显抑制高糖所促进的细胞侵袭(F=71.593,P<0.001;图4)。

图2 沉默N-cadherin表达影响高糖处理的RPE细胞的增殖能力Fig.2 Effect of N-cadherin knockdown on the RPE cells viability treated with high glucose
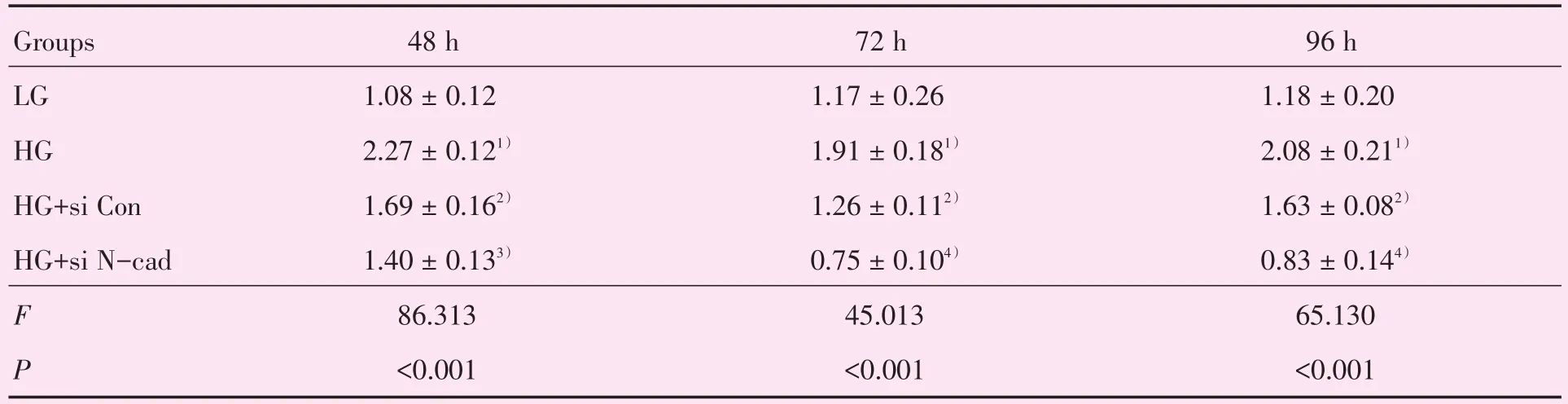
表1 沉默N-cadherin表达对高糖处理的RPE细胞的增殖能力的影响Table 1 Effect of N-cadherin knockdown on the RPE cells viability treated with high glucose (x ± s,unit)
3 讨论
糖尿病视网膜病变是糖尿病患者常见的并发症,与视网膜长期处于高糖环境有关,其发病率高达 90%,是全球致盲的重要疾病[1,12-13]。RPE细胞、胶质细胞在玻璃体视网膜表面增生、迁移,分泌多种细胞外基质成分并异常沉积,从而在视网膜前膜或下膜之间形成可收缩牵拉的纤维增生膜,这是增生性糖尿病视网膜病变的重要病理变化[13]。纤维增生膜的形成会导致新生血管破裂,甚至发生牵拉性视网膜脱离,严重危害患者视功能,及时抑制RPE细胞增殖迁移及纤维增生膜的形成对于DR患者视功能恢复至关重要。

图3 干扰N-cadherin抑制ARPE19细胞迁移能力Fig.3 N-cadherin knockdown inhibited the migration of ARPE19 cells

图4 干扰N-cadherin抑制视网膜色素上皮细胞侵袭能力Fig.4 N-cadherin knockdown suppressed the invasion of RPE cells
糖尿病视网膜病变存在EMT改变,包括转录因子snail/twist以及间质标记物N-cadherin蛋白表达显著升高,提示糖尿病视网膜病变中EMT的发生参与纤维化过程[6]。N-cadherin在维持RPE细胞的细胞间粘附和上皮细胞表型上起着重要作用,在肿瘤细胞中N-cadherin的表达与细胞重排和侵袭有关[14]。本研究以视网膜色素上皮细胞为研究对象,通过腺病毒有效调控N-cadherin的表达水平,从体外实验探讨N-cadherin在RPE细胞的增殖、迁移、侵袭中的作用及机制。本研究发现上调N-cadherin表达能促进人视网膜色素上皮细胞的迁移,而下调N-cadherin的表达可显著抑制视网膜色素上皮细胞的体外迁移及侵袭能力,提示N-cadherin可促进RPE细胞的增殖迁移及侵袭。
在糖尿病视网膜病变中Wnt/β-catenin异常激活,文献报道Wnt/β-catenin、TGFβ/smad和PI3K/Akt/GSK3β等多条信号通路通过转录因子Snail影响EMT的发生[15-19],普遍认为Snail抑制E-cadherin表达,增加fibronectin和vimentin等间质细胞/成纤维细胞分子标记的表达,减少claudins和cytokeratin等各种上皮细胞标记的表达。那么,N-cadhein是否直接通过对snail的转录调控而影响RPE细胞增殖、迁移及侵袭,或者通过调控Wnt/β-catenin通路或其他信号通路进而发挥作用,我们后续将对N-cadherin调控细胞增殖、迁移及侵袭的可能机制进行深入研究。本文目前仅在体外实验ARPE19细胞中证实沉默N-cadherin对糖尿病视网膜病变的可能保护作用,需进一步做体内试验,在小鼠等动物模型上进一步进行验证。本研究仅用CCK8法测定细胞数量,没有进行凋亡实验,故在证明N-cadherin对增殖的影响的依据方面尚有欠缺;TGFβ[18-19]、TNFα等是诱导EMT发生的重要因子,我们仅进行了高糖刺激,在TGFβ等刺激因素作用下N-cadherin对RPE细胞增殖迁移、侵袭的作用未知,故本研究有一定的局限性,我们在后续研究会进一步完善并探讨N-cadherin对RPE细胞增殖、迁移、侵袭的确切机制。另外,N-cadherin在糖尿病视网膜EMT中表达增加的机制尚不清楚;并且糖尿病视网膜病变可能存在多种病因及发病机制,高糖在视网膜病变的发生发展过程中所起的作用错综复杂,确切病理机制仍然需要更深层次的探讨。
综上所述,在视网膜色素上皮细胞中干扰N-cadherin可以抑制高糖引起的细胞增殖、迁移和侵袭,提示N-cadherin参与高糖环境下细胞功能的变化,推测N-cadherin可能是治疗糖尿病视网膜病变的潜在靶点。明确N-cadherin在糖尿病视网膜病变EMT中的重要作用和调控机制对于理解糖网纤维化的发生及寻找靶向治疗药物具有重要意义。

