视黄酸-AP-1信号通路对视网膜色素上皮细胞分泌TGF-β2的调控机制
陈子成,吴君舒,余颖鑫,李凯婧
(1.广州医科大学附属第二医院眼科,广东广州510260;2.中山大学中山眼科中心//眼科学国家重点实验室,广东 广州510060)
近视是世界范围内最常见的眼部异常之一,He[1-2]的研究表明80%到90%的青少年患有近视,其发生率之高和危害性之大已被人们高度关注,而目前近视的发病机制尚不明确。研究表明,在使眼球生长加快的视觉条件下(遮盖或戴负镜),视网膜中视黄酸(retinoic acid,RA)水平升高[3],而RA与视黄酸受体(retinoic acid receptor,RAR)结合后能诱导视网膜色素上皮细胞(retinal pigment epithelium,RPE)分泌转化生长因子β2(transfer growth factor-β2,TGF-β2)。RA和TGF-β2是目前研究较多、与近视密切相关的活性因子[4],而活化蛋白-1(activator protein-1,AP-1)是诸多细胞信号传导途径在细胞核内的交汇点,在近视发生中亦发挥重要作用[5],作为与视觉依赖性眼球生长密切相关的信号分子,RA、AP-1和TGF-β2上下游调控关系未明。本研究采用RA的异构体——全反式视黄酸(All-trans retinoic acid,ATRA)、RAR抑制剂LE540和AP-1抑制剂T-5224干预人RPE细胞,观察药物干预对RPE细胞分泌TGF-β2的影响,探究RA参与调控RPE分泌TGF-β2的相关途径,此外,RA受体、AP-1及相关信号元件也可能成为研发近视防治药物的靶点,为近视的防治提出新思路。
1 材料与方法
1.1 材料
人RPE细胞(ARPE-19细胞系)由中山大学中山眼科中心李万程教授课题组惠赠,DMEM/F12培养基、胎牛血清购自美国Gibco公司,LE540购自日本Wako公司,T-5224购自美国APExBIO公司,全反式视黄酸(All-trans retinoic acid,ATRA)购自美国Sigma公司,Anti-Retinoic Acid Receptor beta抗体、Anti-c-Fos抗体、Anti-TGF-β2抗体、Anti-GAPDH抗体及山羊抗兔IgG H&L(HRP)购自美国Abcam公司,BCA蛋白定量试剂盒购自上海碧云天生物技术有限公司,人TGF-β2 Elisa试剂盒购自武汉云克隆公司,EMSA试剂盒LightShift®Chemiluminescent EMSA Kit购自Thermo公司。
1.2 细胞培养及干预
于37℃、体积分数为5%的CO2恒温培养箱中,用含10%FBS及1%青霉素和链霉素的DMEM/F12培养基培养ARPE-19细胞,按1∶3或1∶4传代,取对数生长期的细胞用于后续实验。将ATRA、LE540和T-5224溶于DMSO后按预实验结果用DMEM/F12分别稀释成10-6mol/L ATRA、10-6mol/L LE540和10-6mol/L T-5224,避光保存。本实验有6个实验组:ATRA组、LE540组、T-5224组、ATRA+LE540组、ATRA+T-5224组,DMEM/F12组作为空白对照。
1.3 Western Blot免疫印迹
先用 ATRA 分别干预 6、12、24、48 h,再用ATRA、LE540和ATRA+LE540干预48 h,DMEM/F12作为对照,收集各组RPE细胞,用RIPA裂解液提取蛋白质,并用BCA法进行蛋白定量,行10%SDS一聚丙烯酰胺凝胶电泳(SDS-PAGE),然后电转至PVDF膜上,5%脱脂奶粉室温摇床封闭1 h,分别加入兔抗人RARβ(1∶1 000)、兔抗人c-Fos(1∶2 000),兔抗人 TGF-β2(1∶1 000),GAPDH(1∶10 000),4℃过夜,洗膜后加入对应种属的二抗(1∶5 000),室温孵育1 h,最后用HRP底物试剂盒检测信号,显影。
1.4 Real-Time PCR
将细胞接种于6孔板,培养细胞待接近90%融合时,更换无血清DMEM/F12培养基饥饿培养24 h,按western blot实验分组对细胞进行干预,收集细胞用Trizol提取试剂提取各组总RNA,根据所测RNA浓度及纯度,按照逆转录试剂盒要求依次加入各试剂,将总RNA逆转录成cDNA,引物如下RARβ:Forward,CGTGGAGTTTGCTAAACGTCT;Reverse,TGGTGTCTTGTTCTGGGGTAT。c-Fos:Forward,AGAATCCGAAGGGAAAGGAA;Reverse,CTTCTCCTTCAGCAGGTTGG。GAPDH:Forward,ATGGCCACGGCTGCTTCCAGC;Reverse,CATGGTGGTGCCGCCAGACAG。按Takara的PrimeScriptRT reagent Kit试剂盒说明操作,同时扩增目的基因和GAPDH,按仪器给出的CT值计算目的基因的相对表达量,样本中目的基因相对表达量按照2-ΔΔCt进行计算。
1.5 免疫荧光
将细胞接种于多聚赖氨酸包被的小圆片上,实验组用ATRA处理48 h,对照组用DMEM/F12处理相同时间后,用40 g/L多聚甲醛室温固定15 min,山羊血清封闭30 min,分别加入一抗RARβ(浓度1∶100),c-Fos(浓度1∶100),4 ℃过夜,洗去未特异结合的一抗,避光分别加入荧光二抗(浓度1∶500),室温孵育1 h,洗去未特异结合的二抗,室温10 min孵育DAPI,清水洗去多余DAPI,加入抗荧光淬灭剂封片,在荧光显微镜下观察。
1.6 电泳迁移率变动分析法
将细胞接种于大皿,用T-5224分别干预12 h、24 h、48 h,DMEM/F12作为对照组,按照LightShift Chemiluminescent EMSA Kit说明书进行。合成生物素标记的探针,探针序列为 AP-1:Forward,5′-CGCTTGATGACTCAGCCGGAA-3′;Reverse,5′-TTCCGGCTGAGTCATCAAGCG-3′。用0.5×TBE配制6~8%聚丙烯酰胺凝胶,100 V预电泳30~60 min,配制反应体系,结合反应体系在室温孵育20 min,加入5 μL 5×上样缓冲液,轻轻混匀,上样后,于100 V电压电泳至凝胶全长3/4处,将尼龙膜在0.5×TBE中浸泡10 min,380 mA湿转30 min,室温晾干,紫外交联125 mJ/cm290 s,显色,封闭液封闭15 min,按1∶300浓度稀释,加入链霉卵白素-辣根过氧化物酶偶联物,室温作用15 min,用1×洗液作用5 min,共4次,再加入底物平衡缓冲液作用5 min,按1∶1比例加入鲁米诺增强液和稳定的过氧化物溶液,暗室显色。
1.7 酶联免疫吸附试验
将细胞接种于6孔板,用无血清培养基饥饿24 h,将细胞分别用ATRA、ATRA+LE540、ATRA+T-5224干预48 h,DMEM/F12作对照组,收集各孔细胞上清,样本检测前在-80℃储存,按照ELISA检测试剂盒的说明书操作。
1.8 统计学分析
采用SPSS 23.0统计软件做统计处理。计量资料以均数±标准差表示,数据处理:两样本间比较,数据呈正态分布且方差齐时采用t检验,数据方差不齐时采用校正的t检验;多组间比较,数据呈正态分布方差齐性时采用单因素方差分析(One-way ANOVA);不同时间点的实验组和对照组数据采用Dunnett′s t检验进行比较,进一步采用Bonferroni法作其他组间两两比较,方差不齐时采用Kruskal Wallis检验比较;重复测量资料采用重复测量的方差分析法。P<0.05为差异有统计学意义。
2 结果
2.1 ATRA对ARPE细胞中RARβ、c-Fos基因表达的影响
用qPCR检测各时间段细胞中RARβ和c-Fos mRNA的表达。结果显示,处理组与对照组间、不同时间及组别与时间的交互作用均有统计学意义(P <0.05;表1、3)。组间比较:与对照组相比,细胞中RARβ mRNA的表达水平在24和48 h分别增加56.14%和89.17%,差异具有统计学意义(P<0.05;表2、图1A);c-Fos mRNA的表达在12 h和24 h分别增加89.51%和23.15%,差异具有统计学意义(P<0.05;表4、图1B);在48 h时,干预组和对照组的c-Fos mRNA表达无明显差别,差异无统计学意义(P>0.05;表4、图1B)。不同时间点比较:与6 h干预组相比,细胞中RARβ mRNA的表达水平在干预24和48 h后分别增加54.18%和85.58%,差异具有统计学意义(P<0.05;表2、图1A);与12 h干预组相比,干预48 h后c-Fos mRNA的表达减少44.15%,差异具有统计学意义(P<0.05;表4、图1B)。
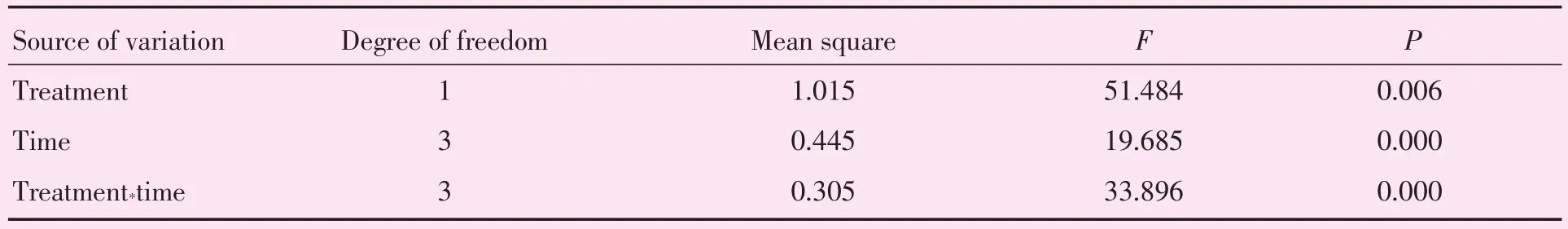
表1 应用重复测量方差分析探讨ATRA对ARPE-19中RARβ表达的影响Table 1 Analysis of the effect of ATRA on RARβ expression in ARPE-19 by using repeated measurement analysis of variance (n=4)

表2 qPCR分析ATRA对ARPE-19细胞中RARβ mRNA的表达水平Table 2 The mRNA expression of RARβ in ARPE-19 after being treated with ATRA detected by qPCR (x±s)
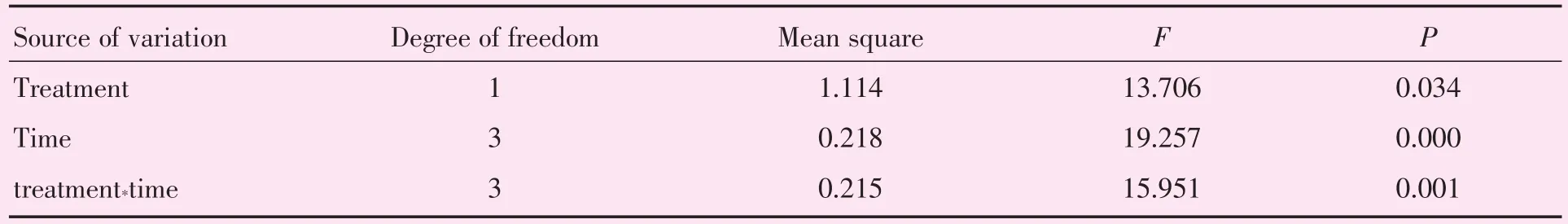
表3 应用重复测量方差分析探讨ATRA对ARPE-19中c-Fos表达的影响Table 3 Analysis of the effect of ATRA on c-Fos expression in ARPE-19 by using repeated measurement analysis of variance (n=4)

表4 qPCR分析ATRA对ARPE-19细胞中c-Fos mRNA的表达水平Table 4 The mRNA expression of c-Fos in ARPE-19 after being treated with ATRA detected by qPCR (x±s)
2.2 ATRA对ARPE细胞中RARβ和c-Fos蛋白表达的影响
采用western blot观察ATRA诱导0~48 h后RARβ和c-Fos蛋白的表达。结果显示,细胞中RARβ蛋白的表达水平随着干预时间的增加而上升,组间差异有统计学意义(F=72.173,P<0.01,图2A),在24和48 h时,RARβ的表达与对照组相比分别增加45.19%和84.07%,差异具有统计学意义(P<0.05,图2A)。c-Fos蛋白的表达水平随着干预时间的延长表现为先上升后下降,组间差异有统计学意义(F=20.377,P <0.001,图2B)。c-Fos表达在12 h组时较对照组增加94.34%,48 h组与对照组相比差异无统计学差异(P>0.05,图2B),而48 h组较12 h组表达减少35.64%,差异具有统计学意义(P<0.01,图2B)。
2.3 免疫荧光检测ATRA干预后RARβ和c-Fos蛋白在细胞中的表达
免疫荧光结果显示,ARPE-19细胞在ATRA干预48 h后,RARβ在细胞核和细胞质的表达较对照组升高,而c-Fos在细胞核的表达较对照组无明显变化,与Western Blot结果相符(图3)。

图1 ATRA对ARPE-19细胞RARβ和c-Fos基因表达的影响Fig.1 RARβ and c-Fos expression in ARPE-19 after being treated with ATRA
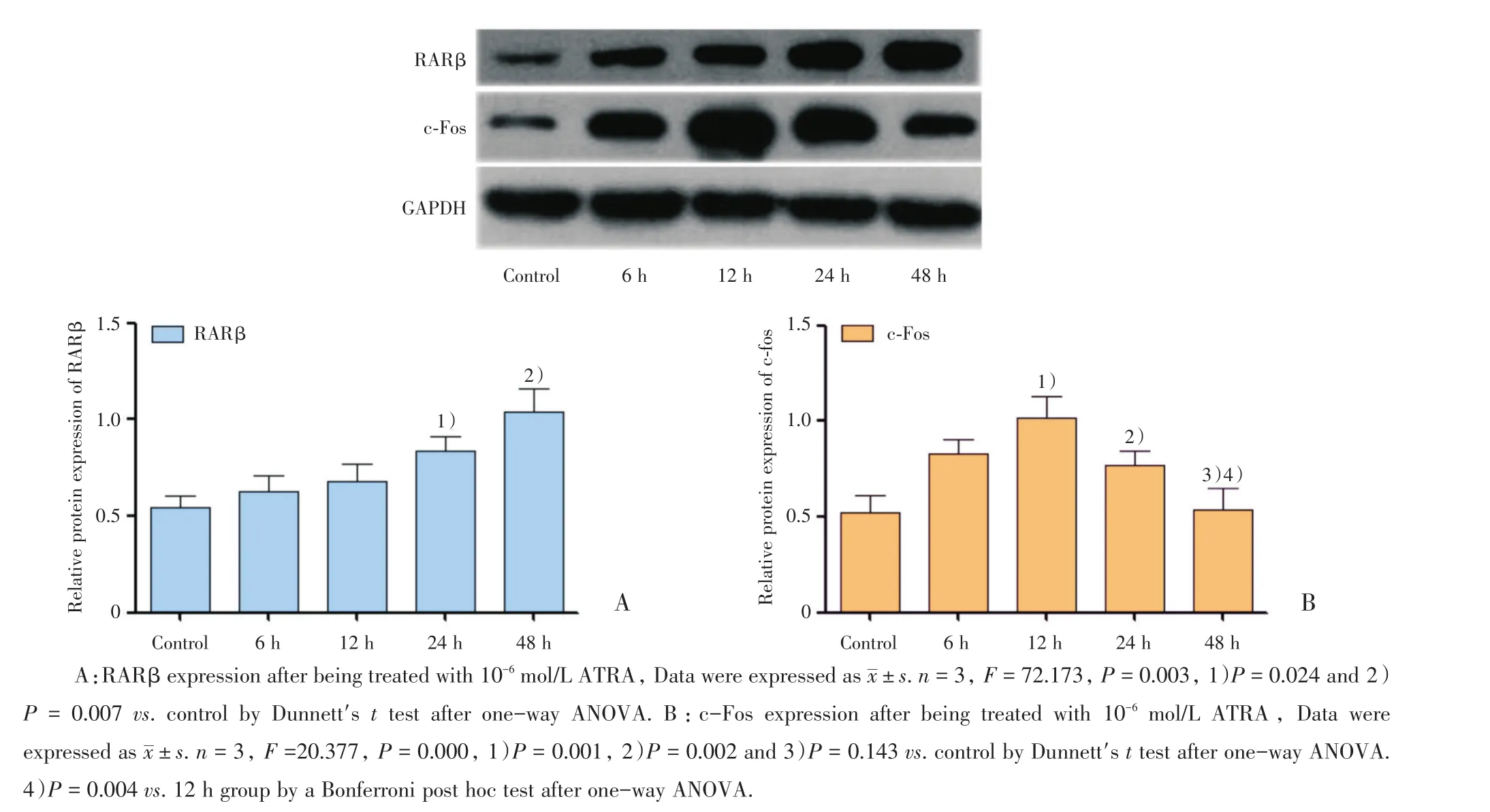
图2 ATRA对ARPE-19细胞RARβ和c-Fos蛋白表达的影响Fig.2 RARβ and c-Fos expression in ARPE-19 after being treated with ATRA

图3 免疫荧光检测ATRA干预后RARβ和c-Fos在ARPE-19细胞中的表达Fig.3 Detection of RARβ and c-Fos expression in ARPE-19 after being treated with ATRA by immunofluorescence
2.4 LE540对ARPE细胞中RARβ及c-Fos基因表达的影响
qPCR结果显示:与对照组相比,ATRA组RARβ基因表达增加105.41%(P<0.01),与ATRA组相比,ATRA+LE540组RARβ基因表达减少22.83%(P<0.05),组间差异具有统计学意义(F=96.210,P <0.001,图4A,表5)。与对照组相比,ATRA组c-Fos基因表达无统计学差异(P>0.05),而LE540组c-Fos表达增加75.66%(P<0.01)。与ATRA组相比,ATRA+LE540组细胞c-Fos基因表达增加75.53%(P<0.01),组间差异具有统计学意义(F=36.884,P < 0.001;图4B,表5)
2.5 LE540对ARPE细胞中RARβ及c-Fos蛋白表达的影响
Western blot结果显示:与对照组相比,ATRA组 RARβ蛋白表达增加 93.96%(P<0.01);与ATRA组相比,ATRA+LE540组RARβ蛋白表达减少25.84%(P<0.05),组间差异具有统计学意义

表5 qPCR分析LE540干预后ARPE-19细胞中RARβ和c-Fos mRNA的表达水平Table 5 The mRNA expression of RARβ and c-Fos in ARPE-19 after being treated with LE540 detected by qPCR (x±s)
RARβ:n=4,1)P<0.05vs.control by Dunnett′sttest after ANOVA.2)P<0.05vs.ATRA group by a Bonferroni post hoc test after one-way ANOVA.c-Fos:n=4,1)P> 0.05 and 2)P< 0.01vs.control by Dunnett′s t test after ANOVA.3)P<0.01vs.ATRA group by a Bonferroni post hoc test after one-way ANOVA(F=32.299,P<0.001,图5A)。与对照组相比,LE540组c-Fos蛋白表达增加62.76%(P<0.01),而ATRA组c-Fos蛋白表达无统计学差异(P>0.05);与ATRA组相比,ATRA+LE540组c-Fos蛋白表达增加55.9%(P<0.01),组间差异具有统计学意义(F=26.492,P<0.001,图5B)。

图4 LE540对ATRA干预48 h后ARPE-19细胞中RARβ和c-Fos基因表达的影响Fig.4 Effects of LE540 on RARβ and c-Fos expression in ARPE-19 cells after being treated with ATRA at 48 h

图5 LE540对ATRA干预48 h后ARPE-19细胞中RARβ和c-Fos蛋白表达的影响Fig.5 Effects of LE540 on RARβ and c-Fos expression in ARPE-19 cells after being treated with ATRA at 48 h
2.6 T-5224对ARPE-19细胞内AP-1 DNA结合活性的影响
EMSA结果显示:T-5224干预24 h和48 h后,与对照组相比,细胞内AP-1 DNA结合活性分别减少43.28%和63.05%(P<0.01),组间差异具有统计学意义(F=58.798,P <0.001,图6)。

图6 T-5224对ARPE-19细胞内AP-1 DNA结合活性的影响Fig.6 Effect of T-5224 on AP-1 DNA Binding Activity in ARPE-19 Cells
2.7 ATRA和T-5224对ARPR-19细胞表达和分泌TGF-β2的影响
Western blot结果显示:ATRA组与对照组相比,TGF-β2表达增加64.04%(P<0.01);ATRA+LE540和ATRA+T-5224组与ATRA组相比,TGF-β2表达分别减少19.59%和19.34%(P<0.05),组间差异具有统计学意义(F=24.527,P<0.001,图7A)。ELISA结果显示:ATRA组[(1142±96)pg/mL]对照组[(894±56)pg/mL]相比,TGF-β2分泌增加27.74%(P<0.01),ATRA+LE540 组[(963±60)pg/mL]和ATRA+T-5224组[(1047±72)pg/mL]与ATRA组相比,TGF-β2分泌分别减少19.75%和18.9%(P<0.05),组间差异具有统计学意义(F=10.273,P <0.01,图7B)。
3 讨论
近视发生的“视网膜局部调控学说”[6-7]认为,视网膜感知异常视觉信号(如形觉剥夺[8])后,释放与近视有关的一级信号因子及二级信号因子,经视网膜色素上皮层-脉络膜信号转导后,作用于巩膜,引起巩膜主动塑形,最终导致轴性近视发生。RA和TGF-β2是目前研究较多的近视相关因子,RA是维生素A在体内的自然衍生物,在眼部起作用的主要是ATRA,生物活性主要由视黄酸受体β(retinoic acid receptor β,RARβ)介导。在实验性近视动物模型中(如FDM)中,RA和RARβ的表达均升高,给豚鼠喂食RA可以使眼轴加速延长,屈光状态向近视方向发展[9-10]。研究表明,RA与RARβ结合后诱导RPE分泌TGF-β2,而TGF-β2[11-12]参与调控细胞外基质的合成和分泌,而后者正是引起巩膜主动塑形、眼轴延长的重要基础。
在实验性近视动物模型中,AP-1复合物的亚单位之一的c-Fos表达下降[13],而肿瘤学领域的研究提示,RAR与AP-1有密切的联系[14]。由此可见,RA、AP-1和TGF-β2都是与近视密切相关的活性因子,而且它们之间也存在千丝万缕的联系,本研究通过体外实验探讨上述因子的上下游调控关系。
结果显示:ATRA干预24 h后RARβ的表达水平明显升高,提示RA作为上游信号因子与RPE上的RARβ结合发挥作用,RARβ是ATRA作用于ARPE-19细胞内信号通路中靶分子之一,与文献报道[15]一致。c-Fos的表达先升后降,提示随着干预时间的延长,RA促进RARβ的表达而抑制c-Fos的表达。既往报道的实验性近视动物模型中,c-Fos的表达是下降的,而本实验观察到c-Fos的表达出现先上升后下降的情况。分析其原因如下:c-Fos属于早反应基因[16],在细胞内能快速灵敏地对外界刺激(如ATRA干预)作出反应,本实验在ATRA干预6 h和12 h时检测到c-Fos表达升高,很可能是一过性的反应性升高,后随着时间延长而受到抑制。而既往报道的实验性动物模型近视造模长达12 w,很可能未捕捉到c-Fos的早期变化。
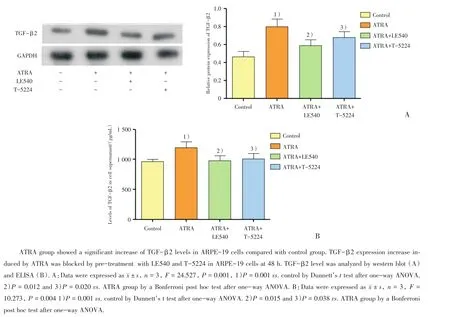
图7 T-5224对ATRA干预后ARPE-19细胞中表达和分泌TGF-β2的影响Fig.7 Effects of T-5224 on TGF-β2 expression in ARPE-19 cells after being treated with ATRA
为了探究RA、AP-1和TGF-β2之间的联系,本实验首先用RARβ阻断剂抑制RARβ的活性,结果显示RARβ的表达下调而c-Fos的表达上调,说明阻断RARβ能抑制RA诱导的RARβ上调;且RARβ被阻断后,ATRA对c-Fos表达的抑制效应减弱,提示ATRA通过RARβ来进一步影响c-Fos的表达。那么AP-1和TGF-β2之间的联系又是怎么样的呢,考虑到AP-1是由c-Fos和c-Jun两个亚单位组成,本研究采用EMSA法检测AP-1复合物DNA与蛋白的结合活性,观察AP-1阻断剂T-5224的最佳作用时间。结果显示,ATRA能促进TGF-β2的表达和分泌,而阻断RARβ和AP-1后,ATRA对TGF-β2的诱导表达作用亦受到抑制,说明ATRA通过RARβ影响AP-1的转录活性(如抑制亚单位c-Fos的表达),进而促进ARPE-19细胞分泌TGF-β2。
综上所述,本研究初步阐明了上调及下调RA信号以及改变AP-1转录活性对RPE分泌TGF-β2的影响及可能的作用途径。目前本研究只在细胞水平上对近视相关因子RA、AP-1和TGF-β2之间的联系进行研究,下一步我们将继续在近视动物模型上进行体内实验,进一步求证以上因子与近视发生发展的相关性。

