紫草素通过促进硫氧还蛋白互作蛋白的表达抑制黑素瘤细胞对葡萄糖的摄取
封琳,左艳,曲璇,李军
陕西中医药大学 基础医学院,陕西 咸阳712046
恶性黑素瘤严重危害人类健康,其高侵袭和转移特性是导致患者生存期短、死亡率高的主要原因[1]。近年来,恶性黑素瘤在我国的发病率逐年上升,在各类肿瘤增长速度中居首。因此,寻求有效的药物,对黑素瘤的治疗和预后评估均具有重要意义[2]。
紫草素来源于紫草,具有清热凉血、活血解毒、透疹消斑等功效[3]。近年来,紫草素在抗氧化、抗炎、抗血栓、增强免疫、抗增殖和促凋亡等多方面的功效也逐渐被人们所认识,尤其是其抗肿瘤功效。研究显示,紫草素及其衍生物抑制肿瘤增殖并诱导肿瘤凋亡和坏死的功能已在多种肿瘤中得到证实,如结肠癌[4]、白血病[5]和前列腺癌[6]等。在本研究中,我们探讨了紫草素对黑素瘤细胞A375 和SK-MEL-28 生存的影响,并进一步研究了其在调节肿瘤糖代谢中的作用,为深入理解紫草素抗肿瘤的功能打下了基础。
1 材料和方法
1.1 材料
A375 细 胞、SK-MEL-28 细胞和NIH-3T3 细胞购自中国科学院细胞库;紫草素购自上海田同生物技术有限公司;高糖DMEM 和无糖DMEM 购自HyClone 公 司;2-NBDG 购 自Thermo Fisher Scientific 公 司;real-time PCR试剂购自TaKaRa 公 司;小鼠抗人硫氧还蛋白互作蛋白(thioredoxin interacting protein,TXNIP)单抗为Cell Signaling Technology 公司产品;小鼠抗人β-actin 单抗及Western印迹试剂盒为Sigma 公司产品。
1.2 MTT细胞增殖实验
将A375、SK-MEL-28 细胞或NIH-3T3 细胞以104/孔的密度接种至96 孔板,待细胞过夜贴壁后加入用DMEM 稀释的浓度分别为0、1、5 μmol/L的紫草素,在处理后的0、1、2、3 d 时间点收集细胞进行MTT 实验,每组设置5 个复孔,每孔加入的MTT 溶液浓度为5 mg/mL,孵育4 h,吸弃上清液后,每孔加入100 μL DMSO 试剂溶解结晶物,用酶联免疫检测仪测定各孔的D490nm值,绘制细胞生长曲线。
1.3 2-NBDG摄取实验
将A375 或SK-MEL-28 细胞以106/孔接种至6孔板,贴壁后分别用0、1、5 μmol/L 的紫草素处理细胞4 h,加入100 μmol/L 2-NBDG 试剂作用1 h,收集细胞,用流式细胞仪检测荧光信号强度。
1.4 real-time PCR实验
将A375 或SK-MEL-28 细胞以106/孔接种至6孔板,贴壁后分别用0、0.5、1 μmol/L 的紫草素处理细胞24 h,收集细胞,用TRIzol 试剂提取mRNA,用TaKaRa公司的PrimeScript real-time PCR 反转录试剂盒进行反转录和real-time PCR。TXNIP 上游引物为5'-ATATGGGTGTGTAGACTA CTGGG-3',下游引物为5'-GACATCCACCAGATC CACTACT-3';β-actin 上游引物为5'-CATGTACG TTGCTATCCAGGC-3',下游引物为5'-CTCCTTAA TGTCACGCACGAT-3'。
1.5 Western印迹
用紫草素按上述方式处理A375 或SK-MEL-28 细 胞,24h后收集 细 胞,加入RIPA 蛋白 裂解液,超声波裂解细胞,4℃离心取上清液,收集总蛋白。经10% SDS-PAGE 分离后,电转(200 mA,2 h)至NC 膜上,用含5%脱脂奶粉的TBST 封闭NC 膜;2 h 后用1∶1000 稀释的TXNIP 抗体于4℃孵育过夜,次日加入二抗孵育1 h,通过ECL 发光检测剂显示结果。
2 结果
2.1 紫草素对黑素瘤细胞增殖能力的影响
A375、SK-MEL-28 和NIH-3T3 细胞接种至96孔板,分别用不同浓度的紫草素处理细胞,在不同时间点收集细胞进行MTT 实验,结果见图1。紫草素能够以时间依赖和剂量依赖的方式抑制A375 和SK-MEL-28 细胞的增殖能力,而对正常细胞NIH-3T3 则不具有显著的抑制效果。
2.2 紫草素对黑素瘤细胞糖摄取能力的影响
为了进一步明确紫草素是否对黑素瘤细胞糖代谢重编程的过程具有调控作用,在A375 和SK-MEL-28 细胞中检测了不同浓度的紫草素对葡萄糖类似物2-NBDG 的摄取能力,结果见图2。经紫草素处理的A375 和SK-MEL-28 细胞对2-NBDG 的摄取能力显著低于对照组(P<0.01),说明紫草素可能通过阻断黑素瘤细胞对葡萄糖摄取的过程抑制细胞的增殖。
2.3 紫草素对TXNIP表达的影响
TXNIP 是抑制细胞摄取葡萄糖的关键基因,我们因此利用real-time PCR 和Western 印迹检测了TXNIP 在紫草素处理过的A375 和SK-MEL-28细胞中的mRNA 和蛋白表达水平。为了避免高浓度紫草素对细胞活力的影响(如图1,5 μmol/L 紫草素作用24 h 会显著抑制细胞生存),选择相对低浓度(0.5 和1 μmol/L)的紫草素。结果显示,在紫草素处理后的黑素瘤细胞中,TXNIP 的mRNA 和蛋白表达水平显著提高(P<0.01)(图3、4),提示紫草素可能通过促进TXNIP 表达的方式抑制黑素瘤细胞对葡萄糖的摄取能力,并进一步导致黑素瘤细胞发生代谢重编程。
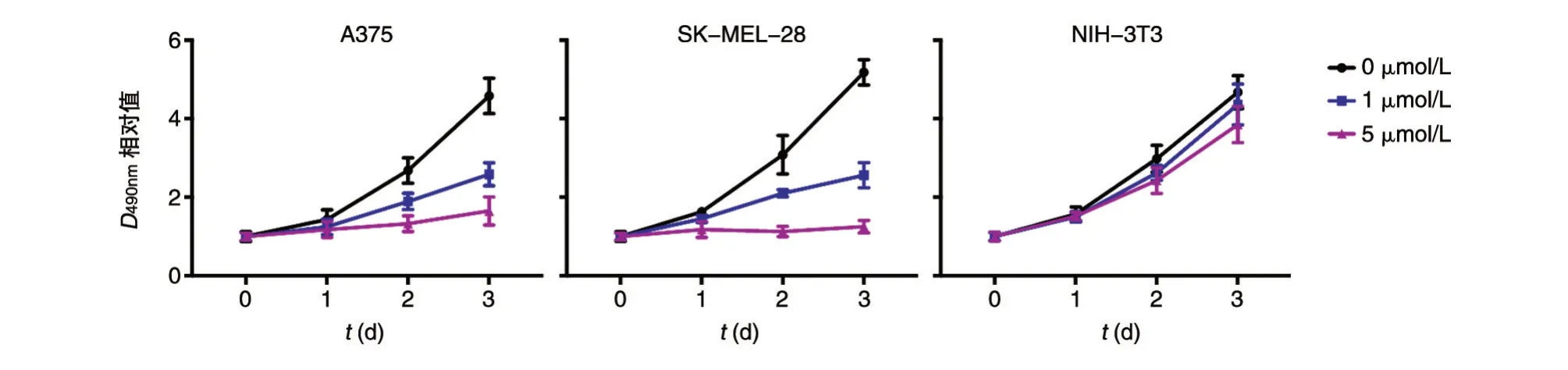
图1 紫草素抑制黑素瘤细胞A375 和SK-MEL-28 的增殖能力

图2 紫草素抑制黑素瘤细胞对葡萄糖的摄取能力
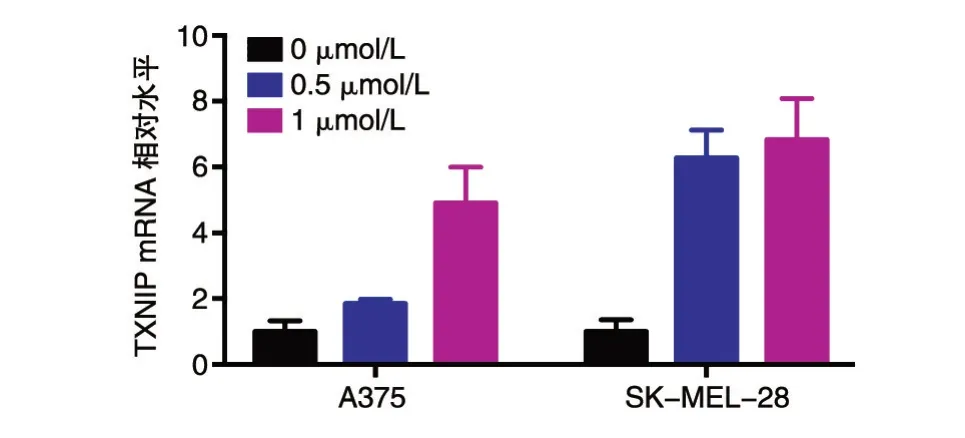
图3 紫草素诱导TXNIP mRNA 表达
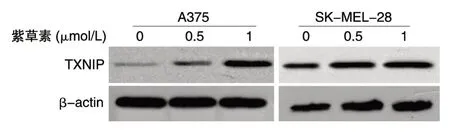
图4 紫草素诱导TXNIP 蛋白表达
3 讨论
TXNIP 是α 抑制蛋 白 家族成员,受MondoA、mTORC1 等蛋白的转录激活调控。早期研究证明,TXNIP 可与硫氧还蛋白(Trx)结合形成二聚体,抑制Trx 的氧化还原特性,并进一步影响Trx下游信号通路的活化和基因表达[7]。近年来,TXNIP 非Trx 依赖性结合途径也逐渐被人们所认识,通过调控能量代谢、炎症反应等过程,参与包括肿瘤在内的诸多疾病的发生[8]。
TXNIP 与肿瘤代谢的相关性主要体现在以下几个方面:①TXNIP 是能量感受器,受葡萄糖、谷氨酰胺和AMPK 等重要代谢通路的调控。研究显示,葡萄糖的代谢中间产物对TXNIP 具有转录激活作用[9],而谷氨酰胺可通过影响MondoA 的转录活性抑制TXNIP 的表达[10]。AMPK 通路在ATP 比例下降时活化,可通过降解TXNIP 蛋白,促进细胞对葡萄糖的摄取[9]。②TXNIP 通过调控葡萄糖转运蛋白GLUT1 的表达抑制细胞对葡萄糖的摄取。TXNIP 对葡萄糖的摄取具有负调控作用,主要是通过负调控GLUT1 来实现的:一方面,TXNIP可促进GLUT1 蛋白内化,促进其在胞内降解;另一方面,TXNIP 可 降低GLUT1 mRNA 表达,抑制其转录[9,11]。③TXNIP 促进脂类物质合成代谢。在TXNIP 敲除的小鼠血液中,甘油三酯、脂肪酸等脂类物质的含量显著增加,血糖浓度下降[8,12]。由此可见,TXNIP 作为细胞内重要的抑癌基因,可通过调控肿瘤代谢的方式抑制肿瘤的生存能力。
在本研究中,我们在恶性黑素瘤模型中证明了紫草素对细胞增殖的抑制作用,并进一步发现紫草素通过剂量依赖的方式上调TXNIP 基因mRNA 的表达,并导致TXNIP 蛋白表达增加,由此推测这可能是紫草素抑制黑素瘤细胞对葡萄糖摄取的重要原因。该研究对于拓展紫草素在肿瘤治疗中的应用价值,以及对其调控机制的解读具有重要意义。

