酿酒酵母W5核酸内切酶基因HO的克隆及生物信息学分析
尹紫良,王长丽,葛菁萍
黑龙江大学a. 农业微生物技术教育部工程研究中心,黑龙江 哈尔滨150500;b. 生命科学学院微生物省高校重点实验室,黑龙江 哈尔滨150080
随着酿酒酵母全基因组测序的完成,有关其各种组学的理论研究也已经十分透彻[1],作为世界上公认的真核模式生物[2],近年来其应用领域逐渐呈现出多元化,在能源探索[3-5]、学科研究[6-7]、环境保护[8]、食品生产[9-10]及疾病模式探索[11-13]等相关领域不断取得重大进展。
大量研究发现,酿酒酵母在传代过程中普遍存在一种特殊的现象即倍性回复,而倍性的变化会引起基因组的不稳定[14]。通常情况下,酿酒酵母为单倍体或二倍体,自然界中还存在多倍体[15],其细胞配型由MAT转座子编码的信息决定[16],研究人员根据MAT基因座遗传信息的差异,将单倍体菌株分为MATa 型(a 型)和MATα型(α型)2 种接合型,而单倍体a 型和α型会与母细胞发生同宗接合形成二倍体[17]。酿酒酵母这种单双倍体相互交替的现象[18],除了受环境等外界因素的影响外,核酸内切酶HO基因(也称为同宗接合基因)起着决定性的作用,该基因所编码的位点特异性重组酶[19-21]会在MAT交配型位点处产生特异性双链断裂,完成沉默供体位点和活化位点之间的信息转换,导致母细胞(MATa)与子细胞(MATα)之间发生MATa 与MATα的相互转化,从而产生同宗接合或异宗配合现象。异宗配合型菌株的交配型是稳定的,而同宗接合型单倍体菌株由于HO基因的表达,所以其交配型很不稳定[15]。同宗接合现象并非时刻都会发生,研究表明,在外界环境适宜的情况下,单倍体酵母细胞通过芽殖的方式沿母细胞轴向生成子细胞,子细胞则会产生一种参与DNA 修复过 程 的Ash1 蛋白[22],它 会 抑制HO基因的表达,进而使单倍体菌株不能发生同宗接合形成二倍体细胞。目前,对于酵母核酸内切酶HO基因的研究已经不仅仅局限于酵母传代领域,它还涉及了包括酵母分子水平机制探究在内的诸多方面。
由此可以看出,HO基因在酿酒酵母单倍体的研究中具有非常重要的作用。本研究中,我们以实验室前期筛选得到的一株二倍体酿酒酵母W5(MATa/α)为出发菌株,通过引物设计进行PCR,克隆其HO基因并做相应的生物信息学分析,这为今后对该酵母进行单倍体构建及二倍体回复、探讨HO基因对单倍体的稳定性具有先期的指导意义。
1 材料与方法
1.1 材料
酿酒酵母W5(用于基因组提取及目的基因克隆)、大肠杆菌DH5α(用于目的基因克隆转化)均由黑龙江大学微生物重点实验室提供;供试质粒pMD18-T,限制性内切酶SalⅠ、XbaⅠ购自大连(宝)生物工程有限公司;TaqDNA 聚合酶、PfuDNA聚合酶购自Fermentas 公 司;BioSpin Plasmid DNA Extraction Kit、BioSpinGel Extraction Kit 购自杭州博日科技有限公司;TIANamp Bacteria DNA Kit、TIANquick Midi Purification Kit购自北京天根生化科技有限公司。
LB 培养基:胰蛋白胨10 g/L,酵母提取物5 g/L,NaCl 10 g/L,pH7.0,121℃湿热灭菌15 min,用于大肠杆菌DH5α的培养。
YPD 培养基:蛋白胨2 g/L,酵母提取物1 g/L,葡萄糖2 g/L,pH 自然,108℃湿热灭菌20 min,用于酿酒酵母W5 菌株的培养。
改良YPD 培养基:蛋白胨0.3 g/L,酵母提取物0.8 g/L,葡萄糖10 g/L,ZnSO4·7H2O 25 mg/L,pH 自然,108℃湿热灭菌20 min,用于产孢前酿酒酵母W5 菌株的培养。
1.2 引物设计
根据NCBI 中序列号为NC_001136.10 的酿酒酵母S288C 染色体Ⅳ上的HO基因序列,用Primer 5.0 软件设计引物对,用来克隆和扩增酿酒酵母W5 的HO基因序列。上游引物(HO-up)为5'-AGCAGATGCGCGCACCTG-3'。
1.3 酿酒酵母W5基因组DNA的提取及HO基因的克隆与鉴定
用TIANamp Bacteria DNA Kit 提取酿酒酵母W5 基因组DNA,再以获得的基因组DNA 为模板,对HO基因进行PCR 扩增。PCR 反应程序:94℃预变性5 min;94℃变性30 s,60℃退火30 s,72℃延伸2 min,30 次循环;72℃终延伸10 min。PCR 反应体系:dNTP 混合液(2.5 mmol/L)4 μL、酿酒酵母W5 DNA(25 ng/μL)10 μL、Pfu聚合酶缓冲液(添加Mg2+)5 μL、HO-up(1 pmol/μL)5 μL、HO-down(1 pmol/μL)5 μL、PfuDNA 聚合酶(2.5 U/μL)1 μL、ddH2O 20 μL。将扩增产物用TIAN-quick Midi Purification Kit纯化后与pMD18-T 载体相连,通过热激法将连有HO基因片段的T 载体转化大肠杆菌DH5α感受态细胞,通过蓝白筛选获得阳性克隆子,菌液PCR 和限制性内切酶SalⅠ和XbaⅠ双酶切验证后送博仕生物技术有限公司测序并命名为pTSW-HO。
1.4 生物信息学分析
利用BLAST 软件对HO基因序列进行ORF Finder 分析及同源性分析;利用DNAMAN 软件对HO基因序列进行翻译,获得相应的蛋白质序列后,对该蛋白质的相对分子质量、理论等电点、氨基酸组成、原子组成、消光系数、半衰期、稳定性指数、脂肪族氨基酸指数、亲(疏)水性的平均值及磷酸化位点进行分析(http://www.cbs.dtu.dk/services/NetPhos/;https://web.expasy.org/protparam/);对该基因序列进行RPS-Blast 分析(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)、HO蛋白跨膜区及重复序列分析(http://www.cbs.dtu.dk/services/TMHMM-2.0/;http://www.ebi.ac.uk/Radar/);构建该蛋白质的二、三级结构模型(http://npsa-pbil.ibcp.fr/cgi- bin/npsa_automat.pl?page=/NPSA/npsa_hnn.html;http://swissmodel.expasy.org/workspace/index.php?func=modelling_simple1),进行亚细胞定位分析(http://www.psort.org/psortb/index.html)。
2 结果
2.1 酿酒酵母W5基因组DNA提取及目标基因克隆
1.5%琼脂糖凝胶电泳可见在大于15 000 bp处有一条清晰的条带,说明成功地提取了酿酒酵母W5 基因组DNA(图1A)。以酿酒酵母W5 基因组DNA 为模板,PCR 扩增获得的目的条带与预期相符,约为1760 bp(图1B)。BglⅡ/XhoⅠ双酶切验证(图1C)和菌液PCR 验证(图1D)结果与预期相符,说明HO基因克隆成功。

图1 酿酒酵母W5 基因组DNA(A)、HO 基因PCR 产物(B)、质粒pTSW-HO 双酶切产物(C)、菌液HO 基因PCR 产物(D)
2.2 HO基因的生物信息学分析
测序后获得的核苷酸序列长度为1760 bp,利用NCBI 的ORF Finder 程序分析,发现该基因序列拥有一个完整的开放读框,起始密码子为ATG,终止密码子为TGA,编码的蛋白由586 个氨基酸残基构成,预测相对分子质量为66 089.13,理论等电点(pI)为9.32,为碱性蛋白质。根据测序结果登录NCBI,用BLAST 数据库分析酿酒酵母W5 的HO基因序列,结果显示所测序列与酿酒酵母Y169(NCBI:CP033473.1)HO基因序列100%一致,与酿酒酵母YJM1326(NCBI:CP004710.2)HO基因序列有99.94%的一致性,与酿酒酵母Evolution Canyon#3(NCBI:GQ923584.1)HO基因完整的CDS 序列有99.60%的一致性,与克隆载体pHCT2 蛋白完整序列(NCBI:KT725395.1)100%一致,与酿酒酵母HCNKIsf G7 染色体Ⅳ蛋白序列(NCBI:CP008171.1)有99.32%的一致性。比对结果说明,测序所得的核苷酸序列为编码同源转换核酸内切酶的基因序列。
氨基酸组成预测分析表明,酿酒酵母W5HO基因所编码的HO 蛋白序列中Lys 含量较高,达8.9%,整个序列中有65 个强酸性氨基酸、93 个强碱性氨基酸;氨基酸分子式为C2917H4659N841O847S32,原子总数为9296 个,预测其在280 nm 水溶液中的消光系数为67 030;预估半衰期>20 h;预测其脂肪族氨基酸指数为78.0;亲水性分析表明HO蛋白的亲水性平均值为-0.471;蛋白质稳定性分析表明HO 蛋白不稳定指数为42.28,是一种不稳定蛋白质;在PROSITE 数据库中检索到HO基因编码的蛋白质的功能性基序和位点在215~370 之间,为内含肽DOD 归巢内切核酸酶,归巢核酸内切酶由内含肽和内含子编码的稀有切割酶组成,它们可以识别的DNA 序列比经典限制酶大得多。
如图2A 所示,HO基因编码的蛋白质的疏水性最大值为1.722。磷酸化位点分析预测可知(图2B),该基因编码的蛋白质序列中有21 个Ser、18个Thr、12 个Tyr。亚细胞定位预测分析发现,HO蛋白有7.50%的可能存在于细胞质中,有1.15%的可能存在于细胞质膜,有0.73%的可能存在于周质空间,因此将HO 蛋白定位于细胞核内。将该蛋白进行跨膜区分析(图2C),结果显示HO 蛋白不含跨膜区,该结论也支持了亚细胞定位分析的结果。
将本试验获得的HO基因片段进行RPS-Blast分析(图2D),结果显示该片段有4 个保守区域。其中,PRK14898 区域是一个信号接收区,具有DNA 指导的RNA 聚合酶亚基调节系统中激酶保守区域的功能;HintN 区域是分割结构域,以适应大量内切核酸酶的插入。
将HO 蛋白进行重复序列分析(图2E),结果表明在该蛋白质中可能存在19 个重复序列,但这些氨基酸序列并非完全相同。
利用Hopfield 神经网络(HNN)预测酿酒酵母W5 的HO 蛋白结构,发现其二级结构主要由不规则卷曲、α螺旋及延伸链构成(图2F)。其中,不规则卷曲占51.71%,α螺旋占27.82%,延伸链占20.48%(蓝色示α螺旋、红色示延伸链、紫色示不规则卷曲)。在得到该蛋白质二级结构基础信息的基础上,构建了其三级结构(图2G)。
3 讨论
近几年来,酿酒酵母配型研究已经从单纯的表观遗传控制方面[23-24]上升到对其机理及相关调控网络更加复杂的探究水平,人类探索未知的渴望和对科学严谨的追求态度,也使得酿酒酵母配型的研究更加完善和系统化。但目前对于酿酒酵母核酸内切酶HO基因的研究,主要还是围绕着人们所关心的代谢路径等方面的改造上。因此,我们对HO这一关键基因的生物信息学分析,可以在某些方面填补该基因在酿酒酵母研究领域的空白,为更好地利用这一基因,对目的菌株进行改造和重组打下坚实的基础。正如本文开头所提及的,随着科技的进步,人们在穷尽各种方法,利用现存科技手段,对酿酒酵母进行更加深入的功能发掘,这也在很大程度上导致了对于酿酒酵母的遗传稳定性[25]、代谢可控性及菌株的运行成本等的更高要求。
酿酒酵母作为研究真核细胞的“模式生物”,其某些研究成果可以转移到高等真核生物体内进行[7],因此对酿酒酵母的研究一直较为活跃,而且在大量研究过程中,人们都直接或间接地对酿酒酵母的HO基因进行了修饰,用以获得其预期研究结果[14-30]。本研究对HO基因的生物信息学分析,不仅仅局限于对基因信息的简单陈述,而且还对该基因的转录水平、空间位置及酶学信息等进行了科学的计算机模拟,得到的数据与科学实践所得到的信息高度一致,这对于该基因的生物学信息汇总及完善有重要意义,可为今后在该领域的相关研究提供更加准确、便捷的HO基因信息,也可为研究路线的进一步优化提供一定的理论参考。
综上,本研究以实验室前期筛选得到的一株二倍体酿酒酵母W5(MATa/α)为出发菌株,利用PCR 技术从其全基因组中克隆得到该菌株的核酸内切酶基因HO片段,经测序后发现该序列无碱基缺失,且通过NCBI 的ORF Finder 程序分析发现该基因序列具有完整的开放读框,与NCBI中酿酒酵母Y169 的HO基因序列100%一致,与酿酒酵母YJM1326 的HO基因序列有99.94%的一致性。同时,我们利用生物信息学技术分析得到其
编码的HO 蛋白的强酸强碱性氨基酸所占比例有明显差异,与预测等电点相符,存在蛋白激酶位点,亚细胞定位分析HO 蛋白存在于细胞核内,属于碱性胞内蛋白。
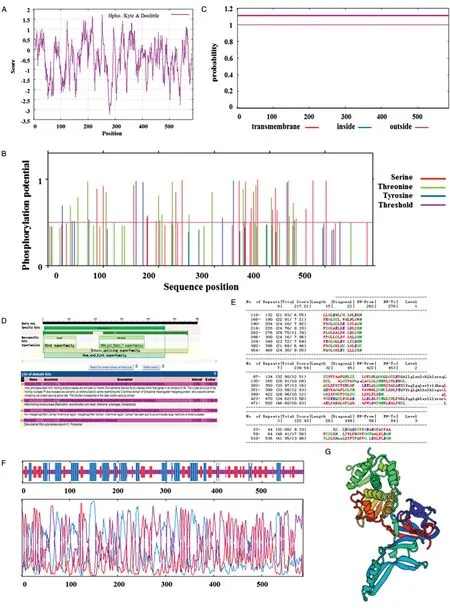
图2 HO 蛋白生物信息学分析结果

