MTERF2在人子宫颈癌细胞株中的表达及对细胞增殖、迁移和侵袭的影响
李素芬,王唯斯,孙美涛,梅雯,自加吉,张若鹏,熊伟
1. 大理大学 基础医学院,云南 大理671000;2. 杭州医学院 基础与法医学院,浙江 杭州311300;3. 大理大学 第一附属医院生殖医学科,云南 大理671000
线粒体转录终止因子2(mitochondrial transcription termination factor 2,MTERF2),又名线粒体转录终止因子样蛋白(mitochondrial transcription termination factor-like protein,MTERFL)或线粒体转录终止因子结构域3(mitochondrial transcription termination domain containing 3,MTERFD3)。该基因最早由Chen 等在比较血清培养和血清饥饿的人类成纤维细胞表达谱差异时首次克隆和鉴定,是线粒体转录终止因子基因超家族的成员[1-2]。人MTERF2 基因定位于染色体12q23.3,含有4 个外显子,存在2 个不同的转录本,其完整的转录本1(GenBank:NM_001033050.2)对应的全长cDNA 为1790 bp[3]。人MTERF2 蛋白质由385 个氨基酸残基组成,定位于线粒体,是一个血清饥饿诱导的蛋白质[4]。Pellegrini 等的研究表明,哺乳动物MTERF2 蛋白是线粒体类核的重要组成成分[5]。动物实验表明,哺乳动物MTERF2 蛋白主要在大脑、心脏、肝脏和肾脏等新陈代谢较旺盛的组织中高表达,而在其他组织中表达水平相对较低,表明它是一个典型的线粒体蛋白质[6]。国内外的不同研究均表明,MTERF2 与线粒体DNA(mitochondrial DNA,mtDNA)的结合没有序列特异性,且MTERF2 基因过表达能显著抑制mtDNA 的复制和转录水平[7-9]。我们前期研究发现,相较于正常子宫颈组织,MTERF2 基因在子宫颈癌组织中低表达[10]。然而,目前MTERF2 对体外培养的人类子宫颈癌细胞株恶性生物学行为的影响及其机制尚未明确。在前期工作基础上,本研究旨在阐明MTERF2 基因在体外培养的人类正常子宫颈上皮细胞株(End1/E6E7)和子宫颈癌细胞株(HeLa、SiHa、C-33A、C4-1、CaSki)中的表达情况,并分别构建MTERF2 过表达和MTERF2 下调表达的稳定转染HeLa 细胞株,与对照组细胞株比较观察,进一步探讨MTERF2 基因对子宫颈癌HeLa 细胞增殖、细胞周期、细胞迁移和侵袭等恶性生物学行为的影响。
1 材料与方法
1.1 材料
正常宫颈上皮细胞系End1/E6E7 购自美国典型培养物保藏中心(ATCC);子宫颈癌HeLa、Si-Ha、C-33A、C4-1、CaSki 细胞株购自中国科学院典型培养物保藏委员会细胞库(上海);p3×FLAG-CMV-14 质粒,MTERF2-pFLAG 重组表达质粒,pSi-MTERF2-1、pSi-MTERF2-2 和pSi-NK 对照质粒(含有一段与人类基因组无关的序列)由本实验室前期构建和保种[10-11]。
DMEM 高糖培养基、SFM 培养基、胰蛋白酶购自Gibco 公司;胎牛血清购自Hyclone 公司;细胞线粒体分离试剂盒、碘化丙啶(PI)、DMSO、DPBS、青链霉素溶液、BCA 蛋白浓度测定试剂盒、XTT 检测试剂盒、DAPI、TUNEL 细胞凋亡检测试剂盒购自Beyotime 公司;质粒DNA 抽提试剂盒购自Omega 公 司;X-tremeGENE HP DNA 转 染试 剂购自Roche 公司;Transwell 小室、Materigel 基质胶购自BD 公司;SDS-PAGE 凝胶快速配制试剂盒、PVDF 膜、ECL化学发光液购自Millipore 公 司;TRIzol 试 剂、逆转录酶M-MLV 购 自Invitrogen 公司;All-in-one-qPCR Mix 购 自Genecopoeia 公 司;鼠抗β-actin 单抗、鼠抗周期蛋白D1 单抗、鼠抗周期蛋白B1 单抗、HRP 标记的山羊抗小鼠IgG 二抗购自Abcam 公司;鼠抗pRb(Ser807/811)蛋白单抗购自Santa Cruz 公司;鼠抗人MTERF2 多抗购自Abnova 公司;qRT-PCR 引物由昆明硕擎生物技术有限公司合成。
2720 Thermal Cycler 型PCR 扩增仪(Applied Biosystem 公司);细胞CO2培养箱、Nanodrop ND-1000 超微量分光光度计、MK3 型酶标仪(Thermo Forma 公 司);CFX96 Real-Time PCR Detection System、蛋白质电泳仪、Trans-Blot Turbo 蛋白质转印仪、ChemiDoc XRS+凝胶成像系统(Bio-Rad 公司);FACSymphony A5 流式细胞仪(BD 公司)。
1.2 细胞培养与传代
正常宫颈上皮细胞株End1/E6E7 用SFM 培养基培养,子宫颈癌HeLa、SiHa、C-33A、C4-1 细胞株用DMEM 高糖完全培养基培养,人宫颈癌肠转移CaSki 细胞株用RPMI-1640 完全培养基培养。培养条件均为37℃、5% CO2、饱和湿度。当细胞汇合度达80%时,用PBS 洗涤1 次,加入0.25%胰酶、0.02% EDTA 消化细胞1 min,按1∶2 分别转移至新的培养瓶中,每2 d 换液一次,3 d 进行传代,取对数生长期细胞进行试验。
1.3 稳定转染HeLa细胞株的构建
用6 孔板培养HeLa 细胞,待细胞汇合度达到80%时进行细胞转染。实验分组包括空白对照组[未转染的HeLa 细胞(wild-type,WT)]、阴性对照组[转染p3×FLAG-CMV-14 或pSi-NK 的HeLa 细胞(non-target,NT)]、过表达组[转染MTERF2-pFLAG(overexpression,OE)]、干扰组1[转染pSi-MTERF2-1 的HeLa 细胞(knock down-1,KD-1)]、干 扰 组2[转 染pSi-MTERF2-2 的HeLa 细 胞(knock down-2,KD-2)]。采 用X-tremeGENE HP DNA 试剂进行细胞转染,取X-tremeGENE HP DNA 转染试剂5 μL,每孔转染2.5 μg 质粒。继续培养4~6 h 后补充10%胎牛血清,培养48 h后,MTERF2 过表达细胞株用1 μg/mL G418 筛选14 d 得到阳性克隆,MTERF2 干扰表达细胞株用嘌呤霉素筛选14 d 得到阳性克隆,分别挑选阳性克隆继续培养获得稳定转染细胞株。
1.4 qRT-PCR检测稳定转染HeLa细胞株的MTERF2 mRNA表达水平
收集各组细胞沉淀,加入1 mL TRIzol 试剂,一步法提取细胞总RNA 并测定RNA 浓度。用逆转录酶M-MLV 将mRNA 逆转录成cDNA。内参照GAPDH 基因和MTERF2 基因扩增的引物序列见表1。用All-in-one qPCR Mix 试剂盒进行qRTPCR。参照文献方法[12],用公式2-ΔΔCt检测MTERF2基因mRNA 的相对表达量。实验重复3 次。
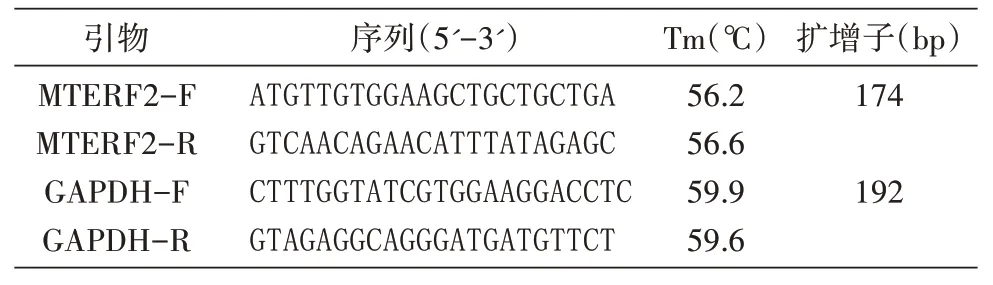
表1 qRT-PCR引物序列
1.5 Western印迹检测细胞内蛋白质表达水平
收集各组细胞沉淀,用D-PBS 洗2 次,加入含蛋白酶抑制剂PMSF 的细胞裂解液提取总蛋白,95℃水浴加热10 min,置于冰上,用BCA 试剂盒进行蛋白质定量。将预制的SDS-PAGE 胶固定于电泳装置上,加入电泳缓冲液,再加入变性后的50 μg 蛋白质样品,100 V 恒压电泳,样品进入分离胶后,改变电压至80 V,直至样品指示剂迁移至分离胶底部。恒压65 V 转膜2 h。5%脱脂奶粉室温封闭2 h,分别用不同的一抗于4℃孵育过夜;TBST 洗膜3 次,每次10 min;用对应的二抗室温摇床孵育2 h;TBST 洗膜3 次,每次10 min;加入ECL 化学发光试剂,在凝胶成像系统中进行图像采集,用Image Lab 5.2.1 软件计算条带灰度值。实验重复3 次,分析各组细胞蛋白质的相对表达量。
1.6 XTT法检测HeLa细胞的增殖
每组设置3 个复孔,分别培养0、24、48、72、96、120 h 后,每孔加入50 μL XTT 溶液;用铝箔包裹培养板,37℃孵育4 h;每孔加入150 μL DMSO,置摇床上低速振荡10 min,溶解残留的甲臜结晶;用酶标仪检测D450nm值并绘制细胞生长曲线。实验重复3 次。
1.7 流式细胞术检测细胞周期
常规消化并收集对数期各组细胞,计数细胞;PBS 洗涤2 次,用70%冷乙醇于4℃固定超过24 h;PBS洗去乙醇,加 入50 μg/mL RNA 酶,37℃作用30 min;PBS 洗涤2 次,加入100 μg/mL PI,4℃避光作用30 min;流式细胞仪检测细胞周期,激发波长488 nm,发射光波长大于630 nm,计数20 000 个细胞。用Cellquest 软件分析荧光强度直方图,统计不同处理下各时相细胞所占比例,分析细胞周期G0/G1、S、G2/M 不同时相分布情况。实验重复3 次。
1.8 平板克隆形成实验
将处于对数生长期的各组HeLa 细胞用胰酶消化并吹打成单细胞悬液,计数细胞,以5000/孔接种于6 孔板,每组设3 个复孔。于37℃、5% CO2培养箱中培养2 周,弃去培养基,PBS 冲洗3 次,4%多聚甲醛固定15 min,结晶紫染色30 min,流水冲洗,干燥,扫描仪采集图片后用Image J 软件分析计数,最后计算克隆形成率:克隆形成率(%)=克隆数/接种细胞数×100%。实验重复3 次。
根据文献[22]取α=α′=β=β′=0.88,λ=λ′=2.25,依据式(6)~式(7)计算双边主体的前景值,构建前景值矩阵,其中[V(Rij)]M×N和[V(Lij)]M×N分别为云服务需求企业和云服务供给企业的前景值矩阵,具体如下:
1.9 细胞划痕实验
常规消化各组细胞并接种于6 孔板中,待细胞生长至单层100%融合即可行细胞迁移实验。用高压灭菌的100 μL 移液枪尖垂直培养皿底部做划痕,PBS 洗涤2 次,加入无血清培养基2 mL,在37℃、5% CO2培养箱中培养,于0、6、12、24 h分别取样,拍照。实验重复3 次。
1.10 Transwell迁移实验和侵袭实验
1.10.1 细胞迁移实验 各组细胞于生长旺盛期消化制成单细胞悬液,用无血清培养基洗涤3 次后重悬,调整细胞密度为1×106~5×106/mL。每个Transwell 小室(8 μm)上腔内加入100 μL 制备的细胞悬液,下腔内加入500 μL 含15%胎牛血清的培养基,于37℃、5% CO2培养箱中孵育24~48 h;取出小室,PBS 洗涤2 次,4%多聚甲醛固定30 min;用Giemsa 染液(1∶9)室温染色30 min,PBS洗涤2 次,擦干;显微镜下观察计数细胞,拍照。实验重复3 次。
1.10.2 细胞侵袭实验 Transwell 小室实验前须经Matrigel 包被。Matrigel 于4℃冰箱过夜呈液态备用;将Matrigel 与无血清培养基1∶7 稀释后包被Transwell 小室(8 μm)底部聚碳酸醋膜,于37℃、5% CO2培养箱中孵育4~6 h 至包被层凝固。其余步骤同迁移实验。用0.1%结晶紫染液室温染色30 min。实验重复3 次。
1.11 流式细胞术检测细胞凋亡
收集对数期各组细胞,用预冷的PBS 洗涤2次,用1×结合缓冲液将细胞制成1×106/mL 的悬液,分别加入5 μL AnnexinⅤ-FITC 和5 μL PI,室温避光孵育10 min,用流式细胞仪对染色的细胞进行检测。实验重复3 次。
1.12 统计学方法
采用SPSS 21.0 和Graphpad Prism 7.0 软件进行统计学分析和绘图,计量资料结果用x±s表示,组间均数比较采用独立样本t检验,P<0.05 表示差异具有统计学意义,P<0.01 表示差异极显著。
2 结果
2.1 正常子宫颈上皮细胞和子宫颈癌细胞株中MTERF2 mRNA和蛋白质表达差异
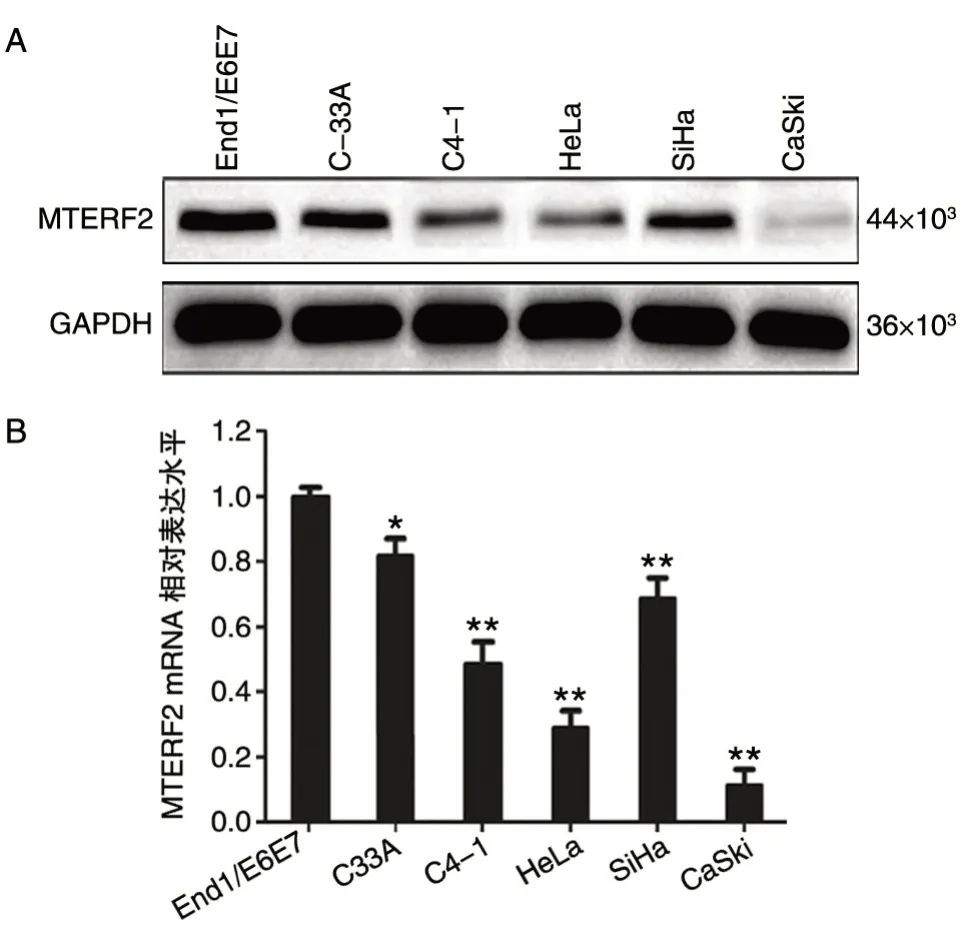
图1 MTERF2 蛋白及mRNA 在正常子宫颈上皮细胞株和子宫颈癌细胞株中的表达水平
2.2 稳定过表达或干扰敲低MTERF2表达的宫颈癌HeLa细胞株的鉴定
qRT-PCR 结果显示,与对照组(WT 和NT组)相比,稳定过表达MTERF2(OE 组)HeLa 细胞中MTERF2 mRNA 表达水平为2.61±0.578 倍;干扰敲低MTERF2(KD-1 组和KD-2 组)HeLa 细胞中MTERF2 表达水平分别下降至40.32%和24.85%(图2)。结果说明,稳定转染过表达和干扰敲低MTERF2 基因的HeLa 细胞株均构建成功。

图2 稳转HeLa 细胞株中MTERF2 mRNA 的表达水平
2.3 MTERF2对宫颈癌HeLa细胞增殖的影响
XTT 实验结果显示,稳定过表达MTREF2 的细胞生长明显被抑制,且差异极显著(P<0.01);而稳定转染pSi-MTERF2-1 和pSi-MTERF2-2 质粒的细胞与WT 对照组和NT 对照组相比生长速度略有上升,但组间差异并无统计学意义(P>0.05)(图3)。此外,细胞增殖力在两对照组之间差异无统计学意义(P>0.05)。

图3 XTT 检测MTERF2 基因对细胞增殖的影响
2.4 平板克隆形成实验
平板克隆形成实验结果(表2)显示,在不同处理组中,过表达组HeLa 细胞克隆形成数目较WT 和NT 组显著减少,且差异有统计学意义(P<0.05)。而干扰敲低组HeLa 细胞克隆形成数目有所增加。细胞平板克隆形成能力在两对照组之间差异无统计学意义(P>0.05)。
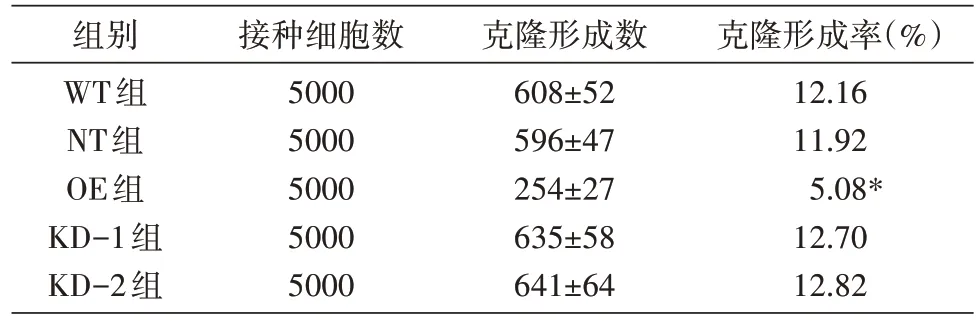
表2 平板克隆形成实验检测MTERF2基因对HeLa细胞增殖能力的影响(n=3)
2.5 流式细胞术分析MTERF2对HeLa细胞周期的影响
流式细胞术结果显示,与WT 组和NT 组细胞相比,稳定过表达MTERF2 基因的HeLa 细胞出现明显的G1/S 期阻滞,subG1 期细胞有所增加,但未有明显的凋亡峰出现。而稳定干扰MTERF2 的HeLa 细 胞G0/G1 期有 所减 少,S 期和G2/M 期 细胞总量有所增加,表明下调MTERF2 后细胞能顺利通过G1/S 控制点,细胞周期未出现阻滞(图4)。
2.6 MTERF2对周期蛋白D1、B1及pRb蛋白表达水平的影响
Western 印迹结果显示,与NT 对照组细胞相比,稳定过表达MTERF2 基因的HeLa 细胞中周期蛋白D1 的水平明显下降,pRb 蛋白的磷酸化水平也显著下降,同时周期蛋白B1 表达水平也有所下降。而稳定转染pSi-MTERF2-1 或pSi-MTERF2-2敲低MTERF2 基因表达的HeLa 细胞中,周期蛋白D1 和B1 的水平与NT 对照组相比无显著差异,pRb 蛋白的磷酸化水平也无明显变化(图5)。

图4 流式细胞术检测MTERF2 基因对细胞周期的影响

图5 Western 印迹检测MTERF2 基因对周期蛋D1、B1 和Rb 蛋白表达水平的影响
2.7 细胞划痕实验
细胞划痕实验显示,MTERF2 过表达组HeLa细胞的迁移速度较阴性及空白对照组均明显减慢(P<0.01);而干扰敲低组HeLa 细胞的迁移速度较阴性及空白对照组均明显增快,在24 h 时差异最为显著(P<0.01)。细胞迁移力在两对照组之间差异无统计学意义(P>0.05)(图6)。

图6 细胞划痕实验检测MTERF2 对HeLa 细胞迁移力的影响
2.8 Transwell小室实验检测细胞迁移与细胞侵袭能力
通过Transwell 小室实验,测定MTERF2 过表达组、干扰敲低组及对照组细胞侵袭和迁移能力的差异,结果见图7。细胞迁移实验结果表明,MTERF2 过表达组HeLa 细胞穿膜细胞数目明显少于阴性及空白对照组(P<0.01);MTERF2 干扰敲低组HeLa 穿膜细胞数目明显多于阴性及空白对照组(P<0.01),细胞迁移力在两对照组之间的差异无统计学意义(P>0.05)。细胞侵袭实验结果同样表明,过表达组HeLa 细胞穿透Matrigel 层侵袭至Transwell 下室的细胞数目明显少于阴性及空白对照组(P<0.05);干扰组细胞穿透Matrigel 层侵袭至Transwell 下室的细胞数目明显增多(P<0.05),而两对照组中细胞侵袭力无显著差异(P>0.05)。
2.9 细胞凋亡
各组HeLa 细胞经AnnexinⅤ和PI 双染后,用流式细胞术分析检测细胞凋亡情况,WT、NT、OE、KD-1、KD-2 组细胞早期凋亡率分别为(4.57±0.51)%、(4.63±0.53)%、(5.37±0.73)%、(7.09±0.82)%、(7.61±0.93)%(图8)。以上结果显示,在子宫颈癌HeLa 细胞中过表达或干扰敲低MTERF2 基因的表达后,HeLa 细胞凋亡情况均没有发生显著变化(P>0.05),提示MTERF2 基因可能不参与子宫颈癌细胞凋亡的调控。

图8 流式细胞术检测MTERF2 基因对HeLa 细胞凋亡的影响
3 讨论
线粒体转录终止因子是一类由核基因编码且高度保守的mtDNA 结合蛋白,在线粒体基因复制、转录与翻译中发挥调控作用[13]。MTERF 蛋白家族广泛存在于后生动物与植物中,而在真菌中尚未发现同源蛋白质,推测真菌在早期进化过程中丢失了MTERF 基因[14-15]。定位于线粒体和存在不定重复数的MTERF 基序(由30 个氨基酸折叠而成的亮氨酸拉链结构),是MTERF 蛋白家族的主要特征[16]。生物信息学分析发现,MTERF2 与MTERF1 在氨基酸序列上有52%的同源性和29%的一致性,并含有与MTERF1 相同的结构域[2]。研究发现,MTERF2 蛋白是非序列特异性的mtDNA结合蛋白,而且是哺乳动物线粒体类核组成成分,在细胞内的表达水平约为线粒体转录因子A(mitochondrial transcription factor A,TFAM)表达水平的5%左右[5]。目前,MTERF2 在体外培养的子宫颈癌细胞中表达水平及其对子宫颈癌细胞恶性生物学行为的影响尚未见报道。
本研究中,我们首先比较了MTERF2 基因在体外培养的人类正常子宫颈上皮细胞株和子宫颈癌细胞株中的表达情况,Western 印迹和qRTPCR结果均显示,MTERF2蛋白及mRNA在各种不同的子宫颈癌细胞株中的表达水平均显著低于正常宫颈上皮细胞株。在此基础上,进一步构建了稳定过表达和干扰敲低MTERF2 基因表达的HeLa 细胞株,并 通过qRT-PCR 检测MTERF2 表达水平。结果显示,与两对照组(WT 和NT 组)相比,OE 组细胞MTERF2 在mRNA 水平的表达明显增高,而KD 组细胞MTERF2 在mRNA 水平的表达受到显著抑制。以上结果说明,稳转过表达和干扰敲低MTERF2 基因的HeLa 细胞株均构建成功。接着,我们分别采用XTT 实验、平板克隆形成实验和流式细胞术分析细胞增殖和细胞周期情况。在MTT 实验中,稳定过表达MTERF2 的HeLa 细胞在48 h 后生长速度显著下降,干扰敲低MTERF2 的细胞增殖速度略有增加,但组间差异不显著。平板克隆形成实验显示,稳定过表达MTERF2 的HeLa 细胞集落显著减少,干扰敲低MTERF2 的细胞在转染后细胞集落有所增加,但组间差异不显著。流式细胞术分析显示,稳定过表达MTERF2 的HeLa 细胞G0/G1 期比例显著增加,处于S 期的细胞比例减少,提示细胞周期出现G0/G1 期阻滞;而稳定敲低MTERF2 的表达后,G0/G1 期细胞减少,S 和G2/M 期细胞增多,表明细胞周期未出现阻滞,细胞仍然处在良好的增殖状态。同时,采用Western 印迹对各组细胞周期蛋白D1 和B1 的水平进行检测,也发现MTERF2 过表达的HeLa 细胞周期蛋白D1 水平较对照组细胞明显下降,而MTERF2 表达下调的细胞在同一时段的周期蛋白D1 和B1 水平无显著变化。以上实验结果提示MTERF 基因可能是一个抑制细胞生长的基因。已有文献报道,当HL-60 细胞内ATP含量下降使细胞周期蛋白D1 表达下调并出现细胞周期阻滞[16]。当细胞ATP 水平下降程度较低时,会引起细胞G0/G1 期阻滞;当ATP 水平进一步下降到较高程度时,会同时引起G0/G1 和G2/M 期阻滞[17]。还有研究表明,细胞中ATP 水平下降会使周期蛋白D1 的286 位苏氨酸的磷酸化水平增加,导致周期蛋白D1 在蛋白酶体的降解速率增加[18]。我们前期研究结果提示,过表达MTERF2基因能显著抑制线粒体DNA 的复制和转录水平,进而影响线粒体编码呼吸链上复合物亚基的生物合成,导致细胞内呼吸链复合体酶活性和氧化磷酸化水平降低,从而导致细胞ATP 含量减少。由此,我们推测MTERF2 基因对细胞增殖的影响可能是与其调节氧化磷酸化活性和细胞ATP 水平的变化相互关联的,MTERF2 通过调控线粒体基因表达来影响线粒体编码的呼吸链复合体的组装,从而影响了细胞氧化磷酸化水平和细胞内ATP 的生成。细胞内ATP 的减少使周期蛋白D1表达水平和Rb 基因磷酸化水平下降,导致细胞周期出现G0/G1 期阻滞,最终抑制细胞生长增殖。
侵袭转移是恶性肿瘤特有的生物学特征,是指肿瘤细胞脱离原发部位,侵犯周围正常组织,并通过各种方式转运至其他靶组织或器官继续生长,最终形成与原发肿瘤相同性质肿瘤的过程[19]。肿瘤要完成侵袭转移需要肿瘤细胞与细胞外基质(extracellular matrix,ECM)的异质黏附、降解ECM 并穿透移行,这就形成了一系列相互关联的过程[20]。本研究采用细胞划痕和Transwell 小室实验测定不同处理组HeLa 细胞侵袭、迁移力的差异。实验结果显示,OE 组HeLa 细胞侵袭和迁移力都显著减弱;KD组HeLa 细胞侵袭和迁移力都显著增强,且较NT 对照组和WT 对照组差异显著,而两对照组HeLa 细胞之间及迁移能力均无显著差异。这一结果提示,MTERF2 基因可能对宫颈癌HeLa 细胞的迁移和侵袭能力具有一定的抑制作用。此外,通过流式细胞术检测发现,在HeLa 细胞中过表达或干扰敲低MTERF2 表达并不会造成细胞凋亡,说明MTERF2基因可能没有参与调控细胞凋亡相关过程,且提示MTERF2 对细胞存活可能并不是一个必需基因。
综上所述,本研究中我们发现MTERF2 mRNA 及蛋白质在各种不同的子宫颈癌细胞株中的表达水平均低于正常宫颈上皮细胞株。我们还构建了过表达或干扰敲低表达MTERF2 的稳定转染HeLa 细胞株,通过与对照组对比观察子宫颈癌HeLa 细胞生物学行为的改变,结果表明MTERF2 基因参与调控子宫颈癌细胞增殖、迁移、侵袭及细胞周期,提示MTERF2 基因在子宫颈癌细胞中发挥类似抑癌基因的功能。

