电解锰渣基沸石对锰离子的吸附性能研究
常 军,贾福康,胡成山 ,叶乾旭
(1.铜仁学院材料与化学工程学院,贵州铜仁554300;2.昆明理工大学材料科学与工程学院)
锰是重要的战略资源,90%以上用于钢铁工业,可谓“无锰不成钢”。特别是近年研究报道了超级钢的发明,其锰添加量达到10%,无疑体现了锰在钢铁工业中具有举足轻重的作用[1]。据国际锰协会最新统计数据显示,2018年中国电解金属锰产量为150 万 t,占世界锰产量的 97%[2]。然而,中国电解锰产业在飞速发展的同时,也面临着巨大的环境压力。电解锰渣是电解金属锰生产过程中产生的一种高含水率的工业固体废弃物。每生产1 t锰产品将产生8~10 t锰渣,照此推算中国每年将有超过1 000万t的锰渣排放量,再加上现有露天堆存的电解锰渣1.2 亿~1.3 亿 t[3],数量如此庞大的固体废弃物不仅占用大片土地,而且还随着雨水的洗淋产生大量渗滤液废水,给电解锰企业周边地区带来严重的环境污染。因此,如何处置电解锰渣及渗滤液废水已成为当前电解锰企业亟待解决的共性问题。
大量的研究报道表明,沸石作为吸附剂在废水处理方面具有巨大的潜力。从化学成分可以看出,电解锰渣以氧化铝和氧化硅为主,是一种硅酸盐矿物废渣,与天然沸石的组成类似[4]。因此,利用电解锰渣为原料制备沸石并用于金属离子废水的处理是其资源化利用的有效途径之一,从而达到以废治废的目的。Li等[5-6]采用碱熔融-水热法将电解锰渣合成沸石用于对亚甲基蓝以及金属离子的吸附研究,结果表明该沸石比表面积为35.38 m2/g,对亚甲基蓝吸附容量可达39.12 mg/g,对金属离子锰和镍吸附容量分别为 66.93 mg/g 和 128.70 mg/g。 Shu 等[7]以水热法合成了改性锰渣吸附材料用于亚甲基蓝的去除,结果表明改性锰渣比表面积可达500.8 m2/g,吸附容量达到548.15 mg/g。上述研究表明,电解锰渣基沸石具有良好的应用前景。
近年来微波焙烧作为一种绿色高效的加热方式在沸石吸附材料制备中已有文献报道。Li等[8]采用微波碱熔辅助水热合成粉煤灰基沸石并用于吸附水溶液中的Cd(Ⅱ),相比于传统水热法合成的沸石,其降低了碱熔温度、缩短了反应时间,制得的沸石比表面积为75.72 m2/g,对Cd(Ⅱ)的吸附容量达到86.96 mg/g。因此,笔者采用微波碱熔活化法制备了电解锰渣基沸石,并用于溶液中锰离子的吸附,考察了溶液初始锰离子质量浓度、溶液初始pH、吸附温度及吸附时间等因素对Mn2+吸附效果的影响,探索电解锰渣基沸石对锰离子的吸附动力学,为电解锰渣基沸石吸附重金属离子提供科学指导。
1 实验部分
1.1 原料、试剂和仪器
原料:电解锰渣,取自贵州松桃某电解金属锰企业。电解锰渣主要化学成分及含量(质量分数):SiO2,33.59%;Al2O3,7.81%;CaO,14.41%;Fe2O3,7.07%;MnO,4.01%;K2O,3.26%;MgO,1.12%。
试 剂 :H2SO4、NaOH、NaAlO2、MnSO4、KMnO4、 氧化锌粉、NaC2O4,均为分析纯。
仪器:集热式恒温加热磁力搅拌器,棕色酸式滴定管,高温微波炉,pH酸度计,电热鼓风干燥箱,循环水真空泵。
1.2 实验方法
1.2.1 电解锰渣基沸石的合成
将二次浸出后的电解锰渣烘干,与固体NaOH按照1∶1.5的质量比混合均匀,置于坩埚中,然后置于微波高温炉中于500℃加热60 min。待坩埚冷却后取出,将烧结物破碎并与去离子水搅拌均匀,按照Si与Al物质的量比为1∶1向其中加入铝酸钠,然后在100℃晶化7 h,过滤、洗涤,将所得固体烘干,即为电解锰渣基沸石。
1.2.2 测试表征分析
采用PHS-3C pH计测定溶液pH;采用IRAffinity-1傅里叶红外光谱仪(FT-IR)分析材料的物质结构特征;采用ASAP2020M全自动比表面积和微孔隙分析仪测定样品的孔径分布及比表面积。
1.2.3 吸附实验
在圆底烧瓶中加入一定量电解锰渣基沸石,加入100 mL硫酸锰溶液,用稀硫酸和氢氧化钠溶液调节pH,然后置于一定温度下的水浴锅中进行搅拌吸附反应。吸附完成后静置冷却,取上清液采用氧化还原滴定法测定其中Mn2+质量浓度,根据式(1)计算吸附量。

式中:qe为吸附容量,mg/g;ρ0为锰离子初始质量浓度,mg/L;ρe为吸附平衡时锰离子质量浓度,mg/L;V为溶液体积,mL;m为吸附剂质量,g。
2 结果与讨论
2.1 电解锰渣基沸石N2吸附-脱附研究

图1 电解锰渣基沸石N2吸附-脱附曲线
电解锰渣基沸石N2吸附等温线见图1。由图1看出,此吸附曲线符合国际纯粹与应用化学联合会(IUPAC)分类中具有滞后环的Ⅳ型等温线,属于典型的介孔物质吸附曲线。样品在相对压力(p/p0)为0.5~0.9有一个陡峭的突越,这是由于N2在孔道中毛细凝聚所致。通过BET测定得到电解锰渣基沸石吸附平均孔径为13.68nm,比表面积为40.18m2/g。相比于相同条件常规焙烧方法,微波碱熔活化法制备的电解锰渣基沸石具有更大的比表面积和较多的孔道,有利于Mn2+的吸附。
2.2 各因素对锰离子吸附效果的影响
2.2.1 溶液初始pH的影响
pH是影响吸附效果的重要参数之一。在电解锰渣基沸石用量为0.6g、Mn2+初始质量浓度为500mg/L、吸附温度为60℃、磁力搅拌转速为150 r/min、吸附时间为2 h条件下,用0.5 mol/L的H2SO4溶液和0.5 mol/L的NaOH溶液调节pH,考察溶液pH对锰离子吸附效果的影响,结果见图2。由图2看出,随着溶液pH从2增加到4,锰离子吸附量由13.35 mg/g急剧增加至67.10 mg/g;继续增大溶液pH至6,锰离子吸附量增幅放缓,并在pH=7时达到最高值79.84 mg/g。这是由于,铝硅酸盐骨架沸石表面通常带负电荷,pH为2~3时H+浓度较高,会与金属锰离子形成竞争吸附关系,从而减少沸石表面的吸附位点,阻碍了其吸附的进行导致吸附量较低[9]。当pH>7时,锰离子吸附容量有所降低。可能的原因是,水溶液呈现弱碱性环境,Mn2+和水中的OH-结合形成沉淀物,造成锰离子吸附量下降。为保证锰离子零水解,后续实验控制pH为6的弱酸性条件下进行。
苏楠的房子离老公学校近,离尼罗河也不过十分钟的车程。当初母亲想在尼罗河挑套大的,是想让苏楠跟他们住在一起。苏楠以老公上班不方便为借口,拒绝了。住得太近,就没有隐私了。还有一个原因是,尼罗河略显奢侈,苏楠这样的年龄,不合适。苏楠说不上勤俭,但太奢侈也不是她的风格。低调,她一再提醒自己。社会上好多极端案例,都是跟仇富心理有关。自己还年轻,不是享受的时候。
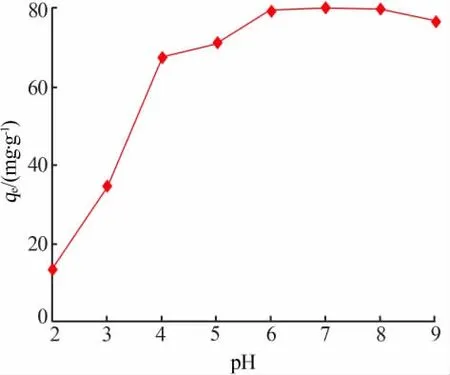
图2 溶液初始pH对Mn2+吸附量的影响
2.2.2 吸附温度的影响
电解锰渣基沸石用量为0.6 g、硫酸锰溶液质量浓度为500 mg/L,在溶液pH=6、磁力搅拌转速为150 r/min、吸附时间为2 h条件下,考察了吸附温度对锰离子吸附效果的影响,结果见图3。从图3看出,与其他因素相比,温度对锰离子吸附量的影响不大。温度为30℃时Mn2+吸附量为71.98 mg/g,温度升高至50℃时Mn2+吸附量升至79.52 mg/g,继续升高温度对锰离子的吸附效果没有明显的改善。升高温度,一方面增强了溶液中金属离子的扩散速率,使吸附过程得到强化;另一方面,能够促使Mn2+克服沸石表面界膜能力增强,从而增加锰离子吸附量。锰离子吸附量随着温度的升高而升高,即单位质量电解锰渣基沸石对Mn2+的交换量逐渐增大。这一结果也说明电解锰渣基沸石与Mn2+的吸附过程是吸热反应[10]。
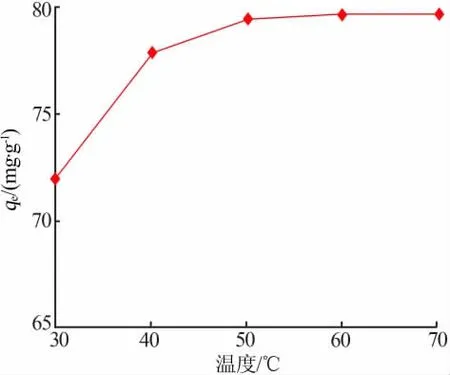
图3 吸附温度对Mn2+吸附量的影响

图4 吸附时间对Mn2+吸附量的影响
2.2.3 吸附时间的影响
吸附反应经过一定时间后会趋于平衡,即水溶液中的离子浓度会保持不变。不同的吸附剂其吸附平衡时间有所不同。在50℃条件下,取0.6 g电解锰渣基沸石加入到质量浓度为500 mg/L、pH为6的硫酸锰溶液中,磁力搅拌转速为150 r/min,考察吸附时间对锰离子吸附效果的影响,结果见图4。由图4看出,随着吸附时间由15 min延长到120 min,电解锰渣基沸石对锰离子的吸附量迅速增加;吸附时间由120 min延长到150 min,吸附量的变化非常缓慢。这是由于,吸附初期电解锰渣基沸石表面吸附孔穴和孔道比较多,锰离子可快速地填充到电解锰渣基沸石的孔穴中;随着吸附时间的延长,电解锰渣基沸石的表面吸附位点被锰离子占据,且锰离子从沸石材料表面的介孔逐渐进入吸附剂中的内部微孔结构,传质阻力逐渐增强,导致锰离子吸附量无明显增加,最终达到平衡吸附量[11]。
2.2.4 锰离子初始质量浓度的影响
配制了系列质量浓度的硫酸锰溶液,分别在其中加入电解锰渣基沸石0.6 g,在溶液初始pH为6、温度为50℃、磁力搅拌转速为150 r/min条件下反应2 h,考察了锰离子初始质量浓度对吸附量的影响,实验结果见图5。由图5看出,吸附剂对锰离子的吸附量随着锰离子质量浓度的增加而逐渐增大,当锰离子质量浓度增加到500 mg/L后,吸附量几乎维持不变。这是由于,随着溶液中锰离子质量浓度增加,锰离子与沸石吸附位点形成的浓度差也增大,锰离子在浓度差的作用下向电解锰渣基沸石内部孔穴迁移,使吸附量增大。当吸附剂的孔穴被锰离子占据后基本达到吸附饱和,此刻的吸附量即为电解锰渣基沸石的最大吸附量,继续增加锰离子质量浓度,吸附量基本不变。

图5 初始锰离子质量浓度对吸附量的影响
2.3 吸附动力学
吸附过程中吸附量和时间的关系是吸附动力学的理论基础。研究吸附动力学有助于理解锰离子的吸附动力学特征,确定吸附速度和吸附动态的平衡时间。实验对象为液、固两相体系,采用准一级和准二级动力学方程可较好地描述电解锰渣基沸石对锰离子的吸附动力学行为。准一级和准二级动力学方程线性表达式分别见式(2)(3)[7,10]。
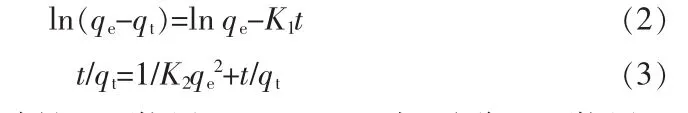
式中:qt为t时刻的吸附量,mg/g;qe为平衡吸附量,mg/g;K1为准一级动力学模型的吸附平衡常数,1/min;K2为准二级动力学模型的吸附平衡速率常数,g/(mg·min)。
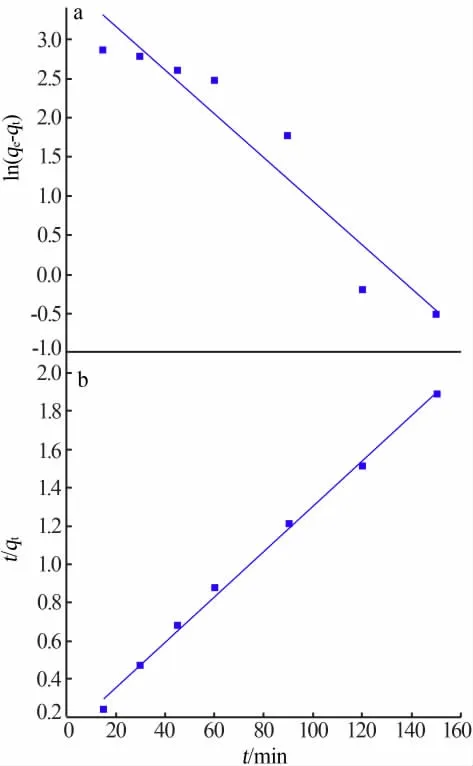
图6 准一级(a)和准二级(b)动力学拟合结果

表1 准一级和准二级动力学模型参数
2.4 等温吸附模型
分析吸附机理时常用到吸附等温模型,Langmuir吸附等温线和Freundlich吸附等温线是两种常用于描述水处理吸附剂吸附机理的等温吸附数学模型。Langmuir模型以假设在有限数量的吸附点位下进行的单分子层之间的吸附为前提,表达式见式(4)。Freundlich模型则考虑了固体表面非均匀且有可能是多层面的吸附过程,表达式见式(5)[12]。
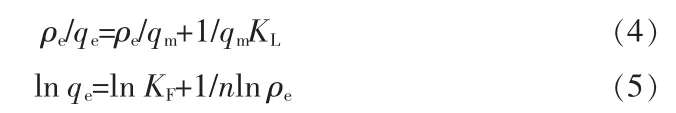
式中:qe为平衡吸附量,mg/g;qm为最大饱和吸附量,mg/g;ρe为平衡时溶液质量浓度,mg/L;KL是 Langmuir模型的吸附平衡常数,L/mg;KF为 Freundlich等温常数;n为与吸附强度或与吸附程度相关的特征常数。
将2.2.4节实验数据代入上述两个数学模型进行拟合,结果见图7。根据拟合直线的斜率和截距计算得到吸附等温模型的各个参数见表2。由图7和表2看出,Langmuir等温吸附方程线性拟合较好;Freundlich等温模型的相关系数仅有0.6114,相关性比较差。这表明,电解锰渣基沸石对溶液中锰离子的吸附过程符合Langmuir吸附等温模型,说明溶液中Mn2+在吸附剂表面形成单分子层吸附。由Langmuir方程得到的理论最大吸附量qm=80.91 mg/g,与通过平衡吸附实验得到的最大吸附量79.18 mg/g十分接近。
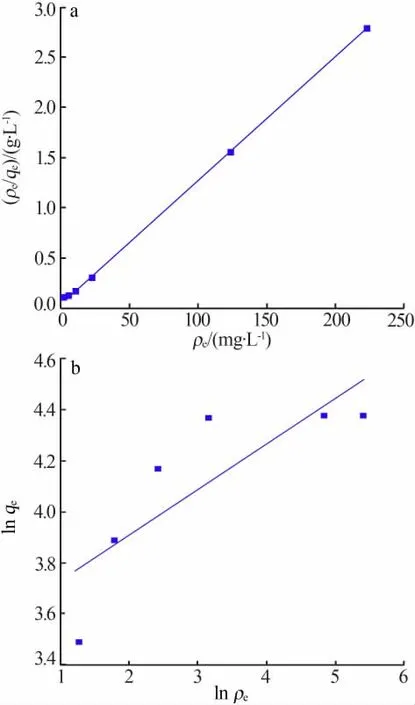
图 7 Langmuir(a)和 Freundlich(b)吸附等温线
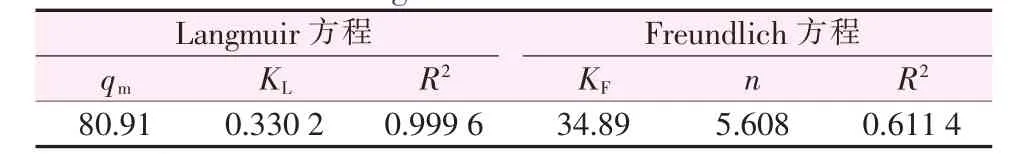
表2 吸附Mn2+的Langmuir和Freundlich等温模型相关参数
与文献[6]采用常规方法合成的电解锰渣基沸石相比,实验采用微波碱熔活化法制备的电解锰渣基沸石在最佳实验条件下对锰离子的最大吸附容量提高了14 mg/g,吸附锰离子的能力显著提高。这主要是因为,在微波作用下Si和Al转化率得到提高,从而增加了电解锰渣基沸石表面的吸附位点[13]。
2.5 红外光谱分析
图8为电解锰渣基沸石吸附Mn2+前后的FT-IR图。由图8可知,电解锰渣基沸石吸附Mn2+前后的峰值基本保持不变,3 400 cm-1附近为水分子O—H伸缩振动吸收峰,1 640 cm-1附近为水分子O—H弯曲振动吸收峰,1 000 cm-1附近为骨架M—O—M(M为Si或Al)反对称伸缩振动吸收峰,700 cm-1附近为骨架M—O—M对称性伸缩振动吸收峰,450 cm-1是Si—O弯曲振动所引起的吸收峰。吸附Mn2+后1 000 cm-1处峰明显减弱,这是因为SO42-参与了Mn2+的吸附过程。

图8 电解锰渣基沸石吸附Mn2+前后的FT-IR图
2.6 吸附剂循环使用性能
将饱和负载锰离子的电解锰渣基沸石用0.5 mol/L的H2SO4进行12 h的搅拌脱附,然后用去离子水洗涤至中性,烘干后进行锰离子吸附实验,如此循环使用5次所得结果见表3。由表3可知,经过5次循环吸附,电解锰渣基沸石对锰离子的平衡吸附量还能保持在65mg/g以上,说明应用电解锰渣基沸石吸附水体中的金属锰离子具有较好的开发前景。
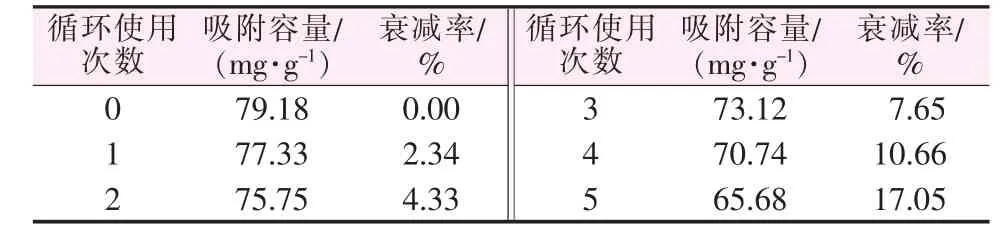
表3 电解锰渣基沸石循环使用性能
3 结论
1)采用微波碱熔活化法制备的电解锰渣基沸石具有较大的比表面积,对Mn2+的吸附效果较好,溶液pH、锰离子质量浓度对吸附效果的影响显著。在溶液pH为6、溶液初始锰离子质量浓度为500 mg/L、吸附温度为50℃、吸附时间为2 h条件下,沸石对Mn2+的吸附容量接近80 mg/g。2)动力学研究表明,准二级动力学方程可以较好地描述电解锰渣基沸石对溶液中锰离子的吸附速率,吸附过程符合单分子层均匀吸附的Langmuir模型,其理论最大吸附容量为80.91 mg/g。3)电解锰渣基沸石具有良好的再生性能,经过5次循环使用,其平衡吸附量仍能达到65 mg/g以上,说明电解锰渣基沸石在处理锰渣场含重金属渗滤液废水方面具有潜在的应用前景。

