玉米皮多酚提取工艺优化及抗氧化性研究
徐彩红 金渭荃 姜忠丽 闵钟熳
(沈阳师范大学粮食学院,辽宁 沈阳 110034)
玉米皮是玉米淀粉深度加工的主要副产品,约占玉米干重的14%[1-2],营养成分十分丰富,一般含有3%~9%粗脂肪、3%~6%粗蛋白质、25%~40%淀粉、20%~25%纤维素、35%~40%半纤维素,此外,还含有膳食纤维、甾醇酯和总多酚等多种活性成分。 这些营养物质含量因玉米品种、品质、淀粉加工技术及生产工艺的不同而有所差异[3-5]。 玉米皮中膳食纤维和多酚等活性成分在预防和治疗一些疾病及在保健食品领域发挥着十分重要的作用[6-7]。 我国玉米皮年产量超过200 万t,主要用于饲料行业或者直接废弃掉,有效利用率偏低[1]。 因此,推进玉米皮的基础研究和开发应用具有重要的科学意义和经济价值。
食源多酚具有抗氧化、抗炎、抗癌[8-9]等重要作用,因而一直是国内外食源功能性成分研究的热点。谷物食用部分的多酚含量较少,大部分多酚集中于谷物的麸皮中[10],其多酚类物质受谷物的种类、加工方式等因素的影响而不同[11-12]。 目前,关于谷物源多酚生物有效性和生物活性方面的研究较少。 近年来,国内外对玉米皮活性成分的研究集中在玉米皮膳食纤维和多糖方面[13-14],对玉米皮多酚类化合物(total phenolic of maize bran,MTP)的组成、含量、生物活性等方面研究报道较少[15]。 因此,研究MTP 对拓宽玉米皮的产业链和开发功能性新产品等具有重要意义。 目前,国内外对MTP 的研究主要集中于玉米皮中阿魏酸、黄酮和黄色素3 种活性成分的提取,常用的提取方法有碱解法[16-18]、溶剂法[19-20]、微波协同酶法[21]和混合酶解法[22],但碱解法和溶剂法存在提取时间长,溶剂污染严重等问题。 而微波协同酶法采用微波系统纤维素酶水系统提取玉米皮黄色素,溶剂用量较少,提取率较高,对玉米皮功能性成分的提取具有一定的参考价值[15]。
木聚糖酶(xylanases,EC 3.2.1.8)是一类能够水解木聚糖的酶系,因其具有优良的酶学性质、较强的催化活性和较高的热稳定性,不仅被广泛应用于纺织、造纸和饲料工业,在改善面制品品质、促进低聚木糖和膳食纤维的生产及酿酒等食品工业中也有着巨大的应用潜力[23]。 近年来,木聚糖酶在多糖、皂苷和多酚等生物活性成分提取方面的应用也越来越多[15,24],但尚未检索到采用木聚糖酶单酶水系统法提取MTP 的报道。因此,本试验采用中心组合(Central Composite Design,CCD)响应面分析法优化酶提MTP 的工艺,并进一步研究其抗氧化性,旨在为推动玉米皮的科学应用提供理论依据。
1 材料与方法
1.1 材料与试剂
玉米皮(市售,产自吉林乾安地区);没食子酸(HPLC≥98%)、木聚糖酶(酶活力≥60 000 U·g-1),上海金穗生物科技有限公司;福林酚试剂(Foin-Ciocalteu 试剂),上海多烯生物科技有限公司;1,1-二苯基-2-苦基肼(1,1-dipheny 1-2-picryl-hydrazyl,DPPH),梯希爱(上海)化成工业发展有限公司;2,2-连氮基-双-(3-乙基苯并二氢噻唑啉-6-磺酸)二铵盐(ABTS),(上海)贸易有限公司;柠檬酸、无水碳酸钠(分析纯),天津博迪精细化工股份有限公司;石油醚(沸程60 ~90℃,分析纯),天津市富宇精细化工有限公司。
1.2 主要仪器
HY-2 型多用调速振荡器,金坛市医疗仪器厂;SB25-12DTDN 超声波清洗机,宁波新芝生物科技股份有限公司;Avanti JE 型高效离心机,贝克曼库尔特商贸(中国)有限公司;T6 型分光光度计,北京普析通用仪器有限责任公司。
1.3 试验方法
1.3.1 玉米皮脱脂处理 粉碎粗玉米皮,过80 目筛,取一定量该玉米皮,加入4 倍质量体积比的石油醚,室温震荡24 h 后抽滤,60℃低温烘干滤渣,即得脱脂玉米皮。 密封,4℃保存备用。
1.3.2 玉米皮多酚提取工艺 40℃预热pH 值4.8的柠檬酸-柠檬酸钠缓冲溶液,临用前加入一定量的木聚糖酶混匀。 准确称量2.0 g 脱脂玉米皮与上述溶液混均,超声(500 W),80℃水浴灭酶2 min,粗提液离心,收集上清液定容至100 mL,测定多酚含量。
1.3.3 总多酚含量的测定 采用Foin-Ciocalteu 比色法[25-27]。 取系列浓度的没食子酸标准品溶液0.50 mL于10 mL 棕色容量瓶中,加入1 mL Foin-Ciocalteu 试剂混匀,再加3 mL 8% Na2CO3溶液,定容后避光放置60 min。 以A760nm对没食子酸质量浓度进行线性回归,得标准曲线方程为:y= 0.068 9x+ 0.007 7,R2=0.999 3,线性范围为1.12 ~8.96 mg·L-1。将稀释至适量浓度待测样品的A760nm值代入没食子酸标准曲线方程,计算样品多酚的没食子酸当量。 参考文献[27]的方法计算总多酚的提取量。
1.3.4 单因素试验 参考文献[27-28],以木聚糖酶添加量2.0%、超声时间6 min、液料比40 mL·g-1、酶解温度55℃为固定水平,考察各因素水平对MTP 提取量的影响。 其中,木聚糖酶添加量分别设为0.5%、1.0%、1.5%、2.0%、2.5%、3.0%,液料比分别设为10、20、30、40、50、60 mL·g-1,酶解温度分别设为45、50、55、60、65℃,超声(500 W)时间分别设为2、4、6、8、10、12 min。 每组试验均重复3 次。
1.3.5 玉米皮多酚最佳提取工艺的确定 在单因素试验结果的基础上,以酶添加量、超声时间、酶解温度和液料比为考察因素,采用Design-Exper 8.0.6 软件进行四因素五水平的CCD 响应面试验设计,筛选超声辅助酶法提取MTP 的最佳工艺参数。 响应面试验因素水平编码见表1。
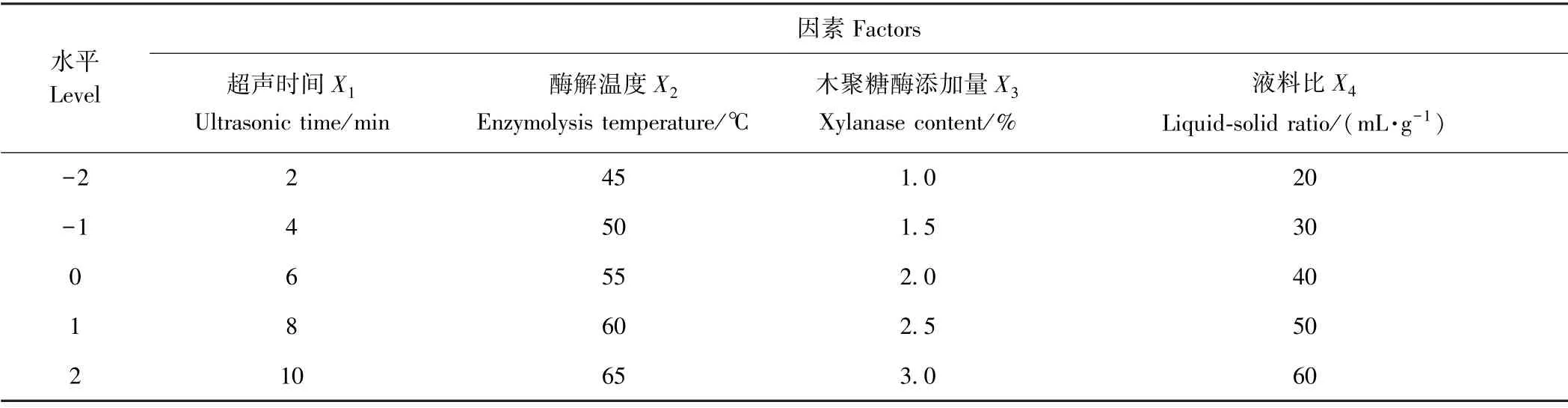
表1 响应面试验设计因素水平编码表Table1 Design and factors of response surface experiment
1.3.6 MTP 提取物体外抗氧化活性研究
1.3.6.1 DPPH·清除能力的测定 参照文献[29-30]的测定方法并略作修改。 将待测液稀释至0.05~3.00 mg·L-1浓度范围内,吸取该待测液2.0 mL,加入2.0 mL 0.2 mmol·L-1DPPH·溶液,涡旋30 s,室温避光反应60 min,以无水乙醇调零,测定517 nm 波长处的吸光度(As);再以2.0 mL 样品待测液与等体积无水乙醇混合后测定吸光度(Ab);再测定2.0 mL DPPH·溶液与等体积无水乙醇混合后测定吸光度(A0),按照公式计算MTP 对DPPH·清除率:

1.3.6.2 ABTS+·清除能力的测定参照文献[29,31]的方法。 取25 mL 7 mmol·L-1ABTS+·储备溶液与440 μL 140 mmol·L-1过硫酸钾溶液混匀,室温避光反应12 h,得ABTS+·溶液Ⅰ。临用时以pH 值7.4的磷酸盐缓冲液稀释ABTS+·溶液Ⅰ,至其在734 nm的吸光度为0.700 ± 0.02,得ABTS+·溶液Ⅱ。取4.0 mL ABTS+·溶液Ⅱ,加入40 μL 样品并混匀,室温避光反应6 min 后于734 nm 波长处测定吸光度值(As),按照公式计算MTP 对ABTS+·清除率:

1.4 数据分析
响应面设计和统计分析采用Design Expert 8.0.6软件进行处理;抗氧化性试验数据结果采用SPSS Statistics 17.0 进行处理。
2 结果与分析
2.1 单因素试验结果
2.1.1 超声时间的确定 由图1可知,固定超声功率500 W,超声时间在2~6 min 范围时,MTP 的提取量增大,且与超声时间呈显著正相关(P<0.01),此后MTP的提取量呈下降趋势。 综合考虑效率、环境等因素,选取超声时间为6 min 进行后续试验。

图1 超声时间对MTP 提取量的影响Fig.1 Effect of ultrasonic time on extraction of MTP
2.1.2 酶解温度的确定 由图2可知,在45.0 ~55.0℃范围内,随着酶解温度的升高,MTP 的提取量呈增加趋势,当酶解温度超过55.0℃后,MTP 提取量显著降低(P<0.05),这可能是因为过高的酶解温度导致了多酚类物质的分解,故选取55℃为后续试验的最佳酶解温度。

图2 酶解温度对MTP 提取量的影响Fig.2 Effect of enzymolysis temperature on extraction of MTP
2.1.3 木聚糖酶添加量的确定 由图3可知,木聚糖酶添加量对MTP 提取量有明显影响。 酶添加量在0.5%~2.0%范围内,MTP 提取量增加并达到最大,且MTP 提取量与木聚糖酶添加量呈显著正相关(P<0.01)。 当酶添加量大于2.0%后,MTP 提取量随着酶添加量的增加而有所降低,这是因为当底物处于酶饱和状态时,增加酶添加量不会使MTP 提取量增加。 因此,选择1.0%~3.0%酶添加量做进一步优化研究。
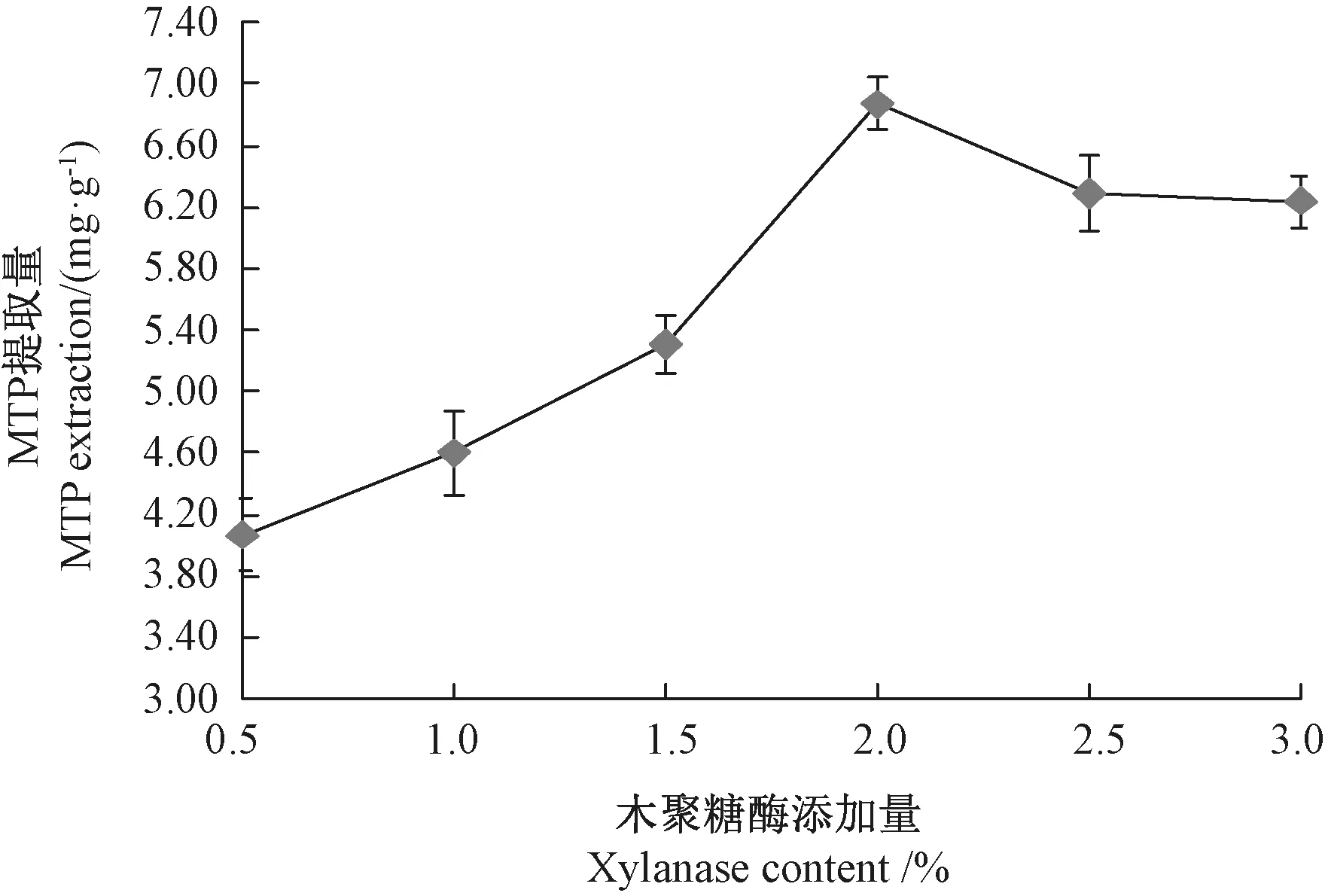
图3 木聚糖酶添加量对MTP 提取量的影响Fig.3 Effect of xylanase content on extraction of MTP
2.1.4 液料比的确定 由图4可知,MTP 提取量随着液料比的增大而增加,且与液料比呈显著正相关(P<0.01);当液料比大于40 mL·g-1时,MTP 提取量逐渐降低(P<0.01)。 液料比过小,MTP 提取量较小,提取不充分,而液料比过大,可能会降低提取效果。 因此,选择液料比20~60 mL·g-1做进一步优化。

图4 液料比对MTP 提取量的影响Fig.4 Effect of liquid-solid ratio on extraction of MTP
2.2 玉米皮多酚提取工艺条件优化试验结果
2.2.1 响应面试验设计与结果
基于单因素试验结果,以多酚提取量为响应值,对选取的4 个因素,进行5 水平的CCD 试验设计。 响应面试验结果见表2。
对表2数据进行多元回归处理,得到二项式拟合的代码方程为:Y=7.09+0.22X1+0.027X2+0.31X3+0.21X4+0.03X1X2+0.13X1X3-0.17X1X4-0.016X2X4-0.11X3X4-0.61X12-0.46X22-0.42X32-0.63X42。
回归模型方差分析的结果见表3(P<0.000 1)。由模型的R2=0.980 4 和可知,模型具有很好的拟合度;模型也具有很好的预测性;失拟项不显著表明回归方程对实际情况模拟度较高。 由各因素P值可知,对多酚提取量的影响极为显著(P<0.000 1),X1X3、X1X4和X3X4对多酚提取量的影响显著(P<0.05),影响大小顺序为:酶添加量(X3)>超声时间(X1)>液料比(X4)>酶解温度(X2)。 因素间交互作用的影响为:X1X4>X1X3>X3X4,而X1X2、X2X3和X2X4对多酚提取量的影响不显著。
响应面有最高点,说明在所选范围内存在极值;响应值对因素条件的改变越敏感表现为响应曲面坡度越陡峭[32-33]。 各因素交互作用越显著表现为响应面在底面的投影图(等高线图)的形状越接近椭圆或鞍形;图形越趋于圆形则说明因素间的交互作用越不显著[34]。 由图5可知,交互项X1X3(图5-B)、X1X4(图5-C)和X3X4(图5-F)的等高线图均趋于椭圆形,说明以上交互项的交互作用均显著;其他交互项的等高线图趋于圆形,其交互作用不显著,这与表3方差分析中回归模型系数显著性检验结果一致。
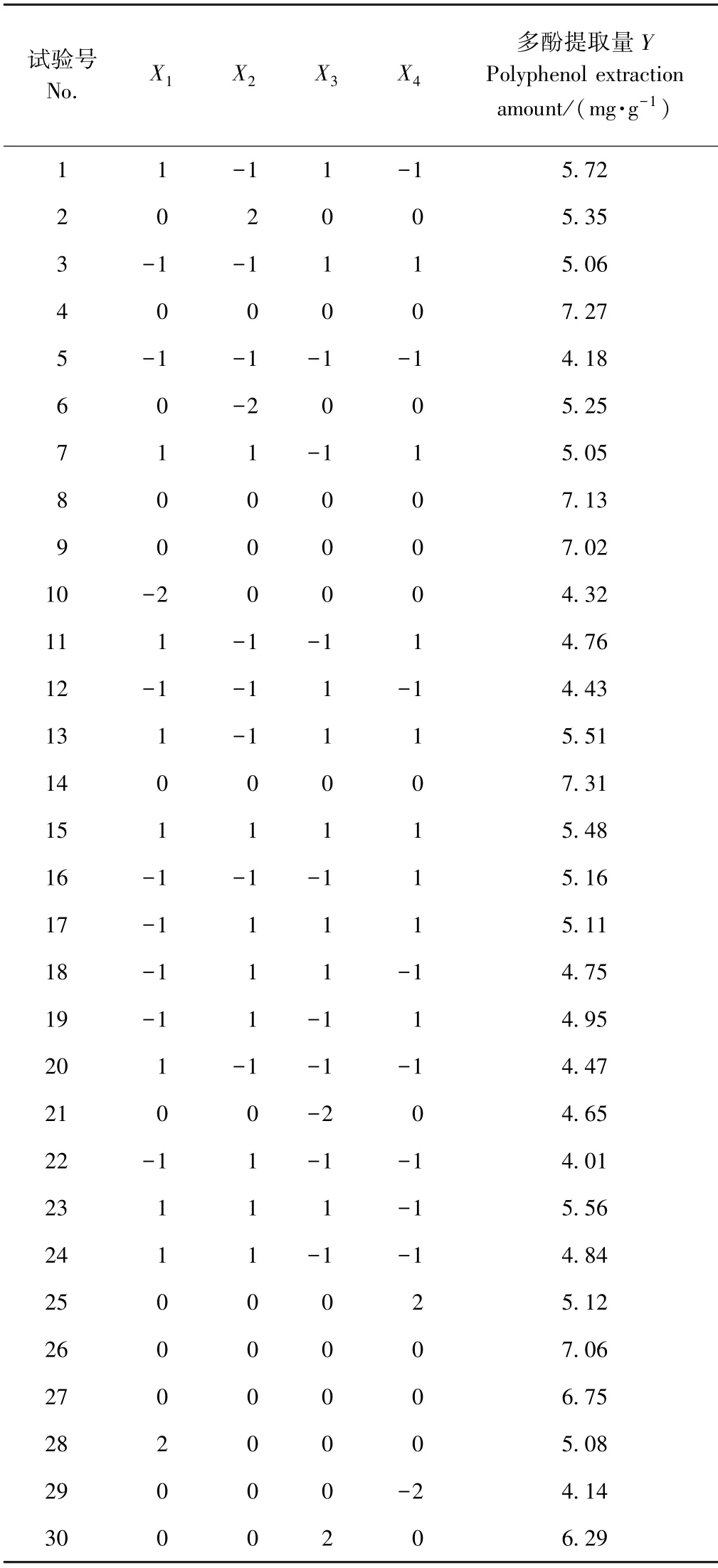
表2 响应面试验设计与结果Table2 Design and results of central composite design
2.2.2 验证试验结果 根据所建立的模型预测得到最佳提取工艺条件为超声时间6.51 min、酶解温度54.70℃、酶加入量2.13%、液料比41.40 mL·g-1,此条件下,MTP 提取量的预测值为7.17 mg·g-1。 为验证模型的可靠性和实用性,依据经济和实际操作的可行性,确定最终试验条件为超声时间6.50 min、酶解温度55℃、酶加入量2.10%、液料比41 mL·g-1,按此工艺进行3 次平行试验,测得多酚的提取量为7.26 ± 0.15 mg·g-1,与理论预测值较接近,说明该回归方程预测性良好。

表3 回归模型方差分析表Table3 Analysis of variance of the regression model
2.3 MTP 提取物体外抗氧化活性研究结果
2.3.1 MTP 提取物对DPPH·的清除能力 由图6可知,在0.05 ~3.00 mg·L-1浓度范围内,MTP 提取物对DPPH·清除能力与其浓度呈显著正相关关系(P<0.01),当MTP 提取物浓度大于1.25 mg·L-1后,其对DPPH·的清除能力提高缓慢。根据IC50值可以确定清除自由基能力的强弱[30],MTP 提取物清除DPPH·的IC50值为0.48 mg·L-1,表明MTP 提取物具有很强的DPPH·清除能力。
2.3.2 MTP 提取物对ABTS+·的清除能力 由图7可知,在0.05 ~6.00 mg·L-1浓度范围内,MTP 提取物对ABTS+·清除能力随着MTP 提取物浓度的增加而增强,其浓度与自由基清除率具有显著正相关关系(P<0.01);MTP 提取物清除ABTS+·的IC50值为2.20 mg·L-1,表明MTP 提取物具有较强的ABTS+·清除能力。
3 讨论
3.1 各因素对玉米皮多酚提取量的影响
本试验选用超声辅助木聚糖酶水解法提取MTP,在预试验基础上,固定超声功率500 W,考察超声时间、提取温度、木聚糖酶添加量和液料比对玉米皮多酚提取量的影响。 结果表明,超声具有使多酚类物质从玉米皮细胞壁中溶出的能力,但是超声时间过长,可能引起多酚类物质的分解或氧化,导致多酚的提取量降低,因此,单因素试验中确定最佳超声时间为6 min,酶解温度范围(45.0~65.0℃)选择木聚糖酶酶活最适温度(40.0~60.0℃)附近,此温度范围内木聚糖酶均具有较高活力且酶活力相当,酶解温度不会对多酚提取量产生较大影响[7]。 但酶解温度大于木聚糖最适温度(60℃)以后MTP 提取量会降低;酶与底物浓度在最适比时,将获得满意的提取效果,加酶量过小,MTP提取量偏低,加酶量过大,由于底物的饱和效应,也不会显著增加MTP 提取量,反而导致浪费,经优化得到木聚糖酶的最适添加量为2.10%;液料比增加,多酚的提取量有所降低,其原因可能是随着料液比的增加,溶剂体积增加使木聚糖酶浓度降低,酶解效果减弱,导致多酚提取量降低。
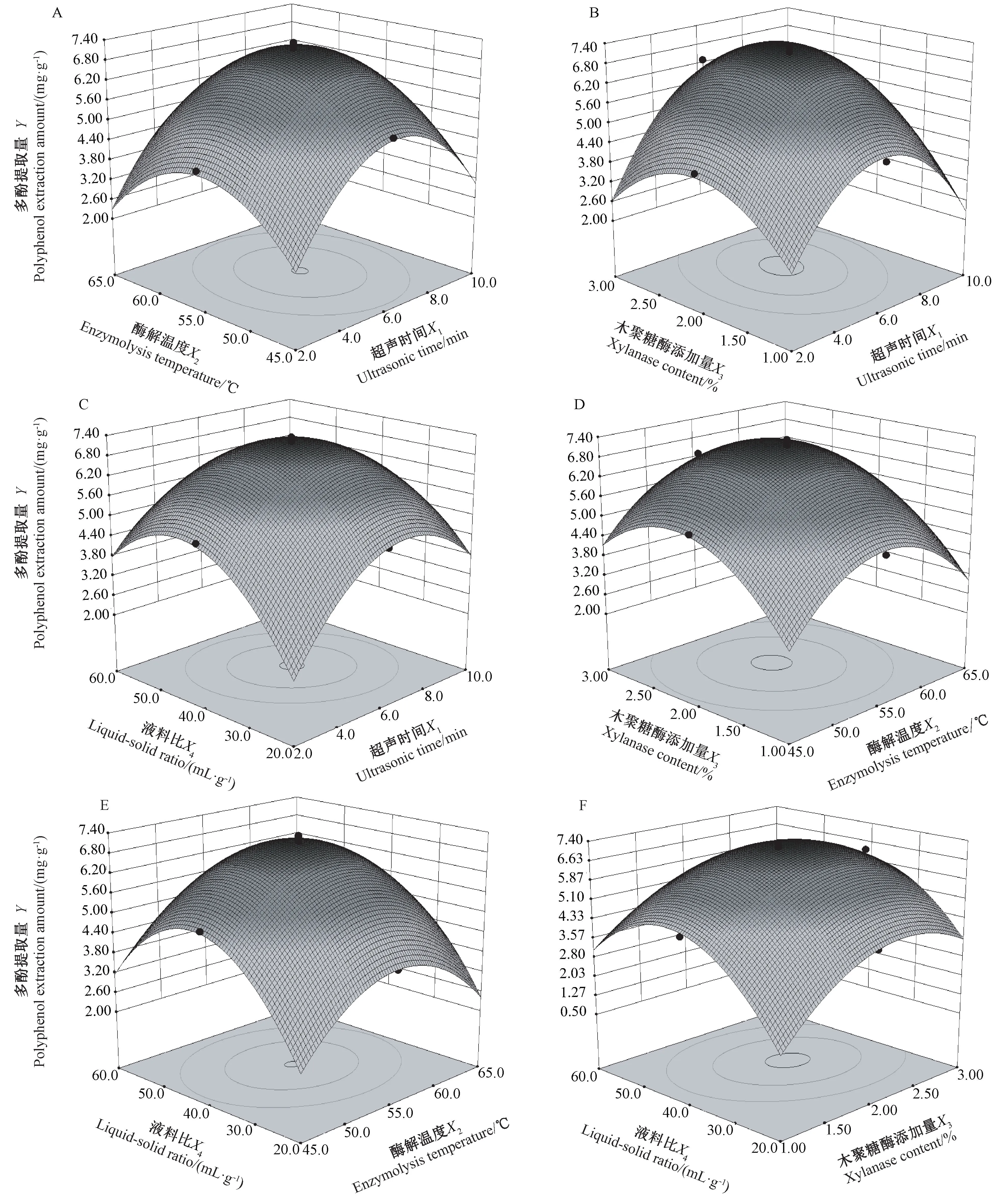
图5 因素交互作用对多酚提取量的影响Fig.5 Effect of the interaction between factors on extraction of polyphenols from maize bran
3.2 MTP 提取物抗氧化活性分析
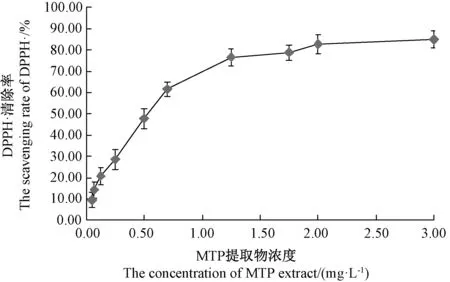
图6 MTP 提取物浓度对DPPH·清除率的影响Fig.6 Effect of MTP extract concentration on DPPH·scavenging rate

图7 MTP 提取物浓度对ABTS+·清除率的影响Fig.7 Effect of MTP extract concentration on ABTS+·scavenging rate
多酚的特性和抗氧化机理不同,单一类型的检测方法不能反映出系统中所有物质的抗氧化情况,因此,组合不同检测方法可以获得系统中多种化合物的抗氧化响应信息[35-36]。 DPPH·和ABTS+·清除能力是体外抗氧化能力评价中广泛采用的指标。这2 个指标均可采用分光光度计定量分析,操作简单快捷,结果较为准确可靠。 DPPH·清除能力测试原理是DPPH·结构中含有一个孤对电子,当加入自由基清除剂时,该孤对电子被配对,深紫色的DPPH·被还原成黄色非自由基形式,其褪色程度与所接受的电子数量呈定量关系[27]。ABTS+·清除能力测试原理是在一定浓度范围内,根据抗氧化剂提供的电子或氢原子可灭活ABTS+·,从而使其溶液颜色发生变化[28,30]。
不同抗氧化剂与DPPH·或ABTS+·反应的速率不同,反应到达平衡的时间也不同。 为了避免抗氧化性评价产生偏差,不能将反应时间固定在某一数值。 抗氧化剂与DPPH·或ABTS+·的反应浓度应适宜,过高或过低都会直接影响反应结果的准确性和可靠性。 因此,本试验充分考察了MTP 测试浓度、反应时间等关键影响因素,最终确定DPPH·或ABTS+·清除率测定时,一定浓度MTP 提取物与DPPH·或ABTS+·试剂的加样体积比分别为1 ∶1 和1 ∶100,反应时间分别为60 min 和6 min。 在本试验研究浓度范围内,MTP 对DPPH·和ABTS+·均具有较强的清除能力,且MTP 提取物浓度与自由基清除率均具有显著的正相关关系(P<0.01)。
谷物多酚分为结合型和游离型,两种类型的多酚对自由基清除率不同,多酚对自由基清除率的贡献率因谷物不同而有所差异[35]。 玉米粉多酚(包括蓝玉米粉、紫玉米粉、花玉米粉等)具有较强的抗氧化能力和保护细胞免受氧化损伤的自由基抑制作用,但因玉米品种而异,其主要成分(原花青素、阿魏酸等)的含量也有所差异,导致其抗氧化能力存在差别[36]。 目前,国内外对MTP 的抗氧化性鲜有报道。 Inglett 等[7]对玉米皮(粒径>30 μm)经50%乙醇二次浸提后得到的MTP 进行抗氧化能力研究,其DPPH·清除能力为15.66 μmol Trolox·g-1。 以Trolox 为对照,本试验提取的MTP 为结合型和游离型的混合型多酚,对DPPH·清除能力为46.50 μmol Trolox·g-1。 因试验条件不同,很难从不同的体外抗氧化试验研究结果直接比较化合物的抗氧化能力[7,35],但也可推测出本试验采用的木聚糖酶水解法提取的MTP 较乙醇浸提法具有更好的抗氧化能力。
4 结论
本试验采用超声辅助酶法提取玉米皮多酚,基于单因素试验考察不同因素对MTP 提取量影响的基础上,通过响应面设计得到优化的提取工艺条件为:酶添加量2.10%、酶解温度55℃、液料比41 mL·g-1、超声时间6.50 min,此条件下MTP 提取量为7.26 ± 0.15 mg·g-1,与理论预测值(7.17 mg·g-1)较接近。 MTP 提取物对DPPH·和ABTS+·均具有较强的清除能力,且抗氧化活性与其浓度在一定范围内有很好的量效关系,MTP 提取物IC50值分别为0.48、2.20 mg·L-1。综上表明MTP 可作为潜在天然抗氧化剂应用于食品行业。

