西南鸢尾花色变异实时定量PCR内参基因的筛选与验证
马璐琳 崔光芬 王祥宁 贾文杰 段 青杜文文 王继华 陈发棣
(1 云南省农业科学院花卉研究所/云南省花卉育种重点实验室/国家观赏园艺工程技术研究中心,云南 昆明 650205;2 南京农业大学园艺学院,江苏 南京 210095)
实时定量PCR(real-time quantitative PCR,RTqPCR)具有定量准确、特异性强、敏感度高、重复性好等特点已被广泛运用于目标基因表达水平的检测和定量研究,但其结果的准确性易受RNA 质量、反转录效率、引物特异性、样品量、PCR 效率等因素的影响[1-3],因此,需要引入内参基因进行标准校正,以提高RTqPCR 结果的准确性[4]。 目前一般以微管蛋白基因(Tubulin,TUB)[5-7]、肌动蛋白基因(Actin,ACT)[1,8-10]、3-磷酸甘油醛脱氢酶基因(Glyceraldehyde-3-phosphate dehydrogenase,GAPDH)[1,9-11]、泛素蛋白基因(Ubiquitin,UBQ)[5-9]、18S 核糖体RNA 基因(18S rRNA,18S)[1,10-12]等表达较高且稳定的看家基因(house-keeping gene)作为内参基因。 理想的内参基因在所有类型组织或细胞中,其基因表达水平应当不受环境因素影响,保持稳定表达[3],然而目前尚未有内参基因可以在各种试验条件下均能稳定表达[13-16],因此,根据不同的物种、样品类型、试验条件筛选适合且稳定的内参基因具有重要意义[3,8,17]。
鸢尾属(IrisL.)植物的花色除了白、红、粉、黄等常见色外,还有在其他花卉中少见的蓝紫色,且有些鸢尾属种类花色多为复色,或带有条纹和斑点,有极高的观赏价值[18]。 鸢尾属植物中有很多花色发生变异的变种和变型,如白花鸢尾(I.tectorumMaxim.f.albaMakino)[19]、白花溪荪(I.sanguineaDonn ex Horn.f.albifloraMakino)[19]、白蝴蝶花(I.japonicaThub.f.pallescensP.L.Chiu et Y.T.Zhao)[19]、白花紫苞鸢尾(I.ruthenicaKer-Gawl.f.leucanthaY.T.Zhao)[19]、白花宽柱鸢尾(I.latistylaY.T.Zhao f.albifloraJ.Luo)[20]、黄花马蔺(I.lacteaPall.var.chrysanthaY.T.Zhao)[19]、蓝花卷鞘鸢尾(I.potaniniiMaxtm.var.ionanthaY.T.Zhao)[19]、蓝花喜盐鸢尾[I.halophilaPall var.sogdiana(Bung) Grubov][19,21]等,这些都是研究鸢尾属植物花色形成和调控机制及花色合成相关基因功能的理想材料[21-22]。 西南鸢尾(I.bulleyanaDykes)为鸢尾属多年生宿根植物,仅分布于我国西南地区,如四川、云南等地,花色为浅紫至蓝紫,可直接用作园林绿化,也可用来培育鸢尾新品种[19,23],其白花变型白花西南鸢尾(I.bulleyanaDykes f.albaY.T.Zhao)花色为乳白色,其他性状与西南鸢尾相同[19]。目前对西南鸢尾的研究主要集中在系统分类、引种栽培、生长发育特性、内含物质组成等方面,而对其花色形成相关基因的筛选克隆及花色形成分子机制等方面尚未见报道。
本研究根据前期已完成的西南鸢尾及其白花变型花蕾组织的转录组测序数据,筛选适用于西南鸢尾及其花色变异材料中花色素合成代谢途径相关基因表达谱分析的内参基因,以期为鸢尾花色形成(或变异)机制研究、花色相关基因功能分析及鸢尾花色育种提供一定的理论依据。
1 材料与方法
1.1 材料
试验材料为自然生长于云南省香格里拉县郊外的野生西南鸢尾及其白花变型白花西南鸢尾,在花期选择发育程度、大小、长度等基本一致,花朵部分约有一半露出苞片的花蕾(图1),去除花蕾基部花梗和苞片后立即-80℃液氮保存备用。 2 种不同花色材料各设3 个生物学重复,共6 个样品。

图1 西南鸢尾和白花西南鸢尾花蕾Fig.1 The flowers and buds of I.bulleyana Dykes and I.bulleyana Dykes f. alba Y.T.Zhao
1.2 方法
1.2.1 侯选基因筛选 根据前期已完成的西南鸢尾和白花西南等尾花蕾组织的转录组测序结果数据(未发表),以估算基因表达量FPKM(Fragments Per Kilobase of transcript per Million mapped reads)值较高(转录组测序结果以FPKM 值大于60 作为目标基因表达明显的指标,本研究候选内参基因筛选标准为大于600)且在6 个样品间基本一致作为筛选标准,共筛选到6 个常用的内参基因(表1),同时以台湾百合(Lilium formosanumWallace) 18S基 因(GenBank:D29775.1)作为来源于转录组测序数据内参基因的对照内参基因。 此外,根据转录组测序KEGG 数据,选取类黄酮/花青素合成途径和类胡萝卜素合成途径中的12 个色素合成相关基因(其中有3 个基因在西南鸢尾和白花西南鸢尾中差异表达)(表2),对最终筛选到的内参基因进行验证。 根据候选基因核苷酸序列采用Roche LCPDS2 软件设计RT-qPCR 引物(表3),由北京擎科新业生物技术有限公司合成。
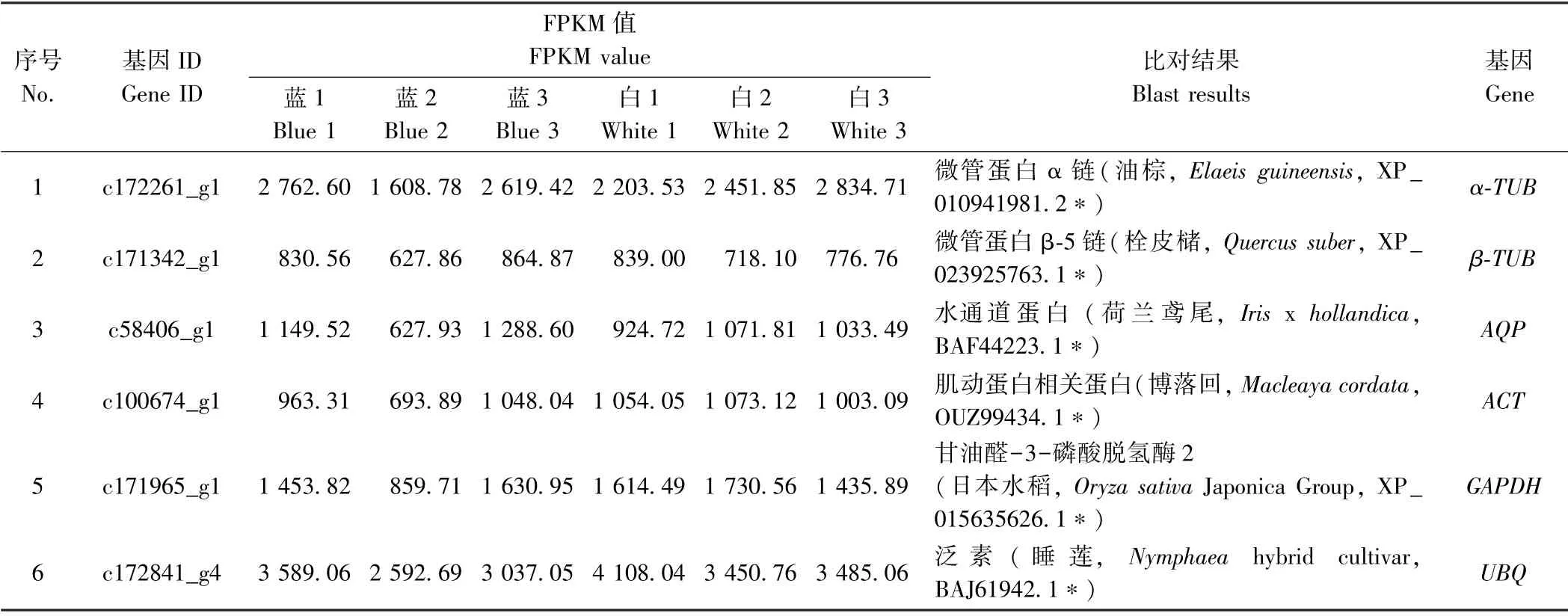
表1 西南鸢尾转录组测序数据中筛选到的6 个候选内参基因Table1 6 candidate reference genes in RNA-seq libraries of I.bulleyana

表2 西南鸢尾转录组测序数据中的类黄酮/花青素合成途径和类胡萝卜素合成途径中的部分相关基因Table2 Part of velated genes in the flavonoid/anthocyanin biosynthetic and carotenoid biosynthetic pathways in RNA-seq libraries of I.bulleyana
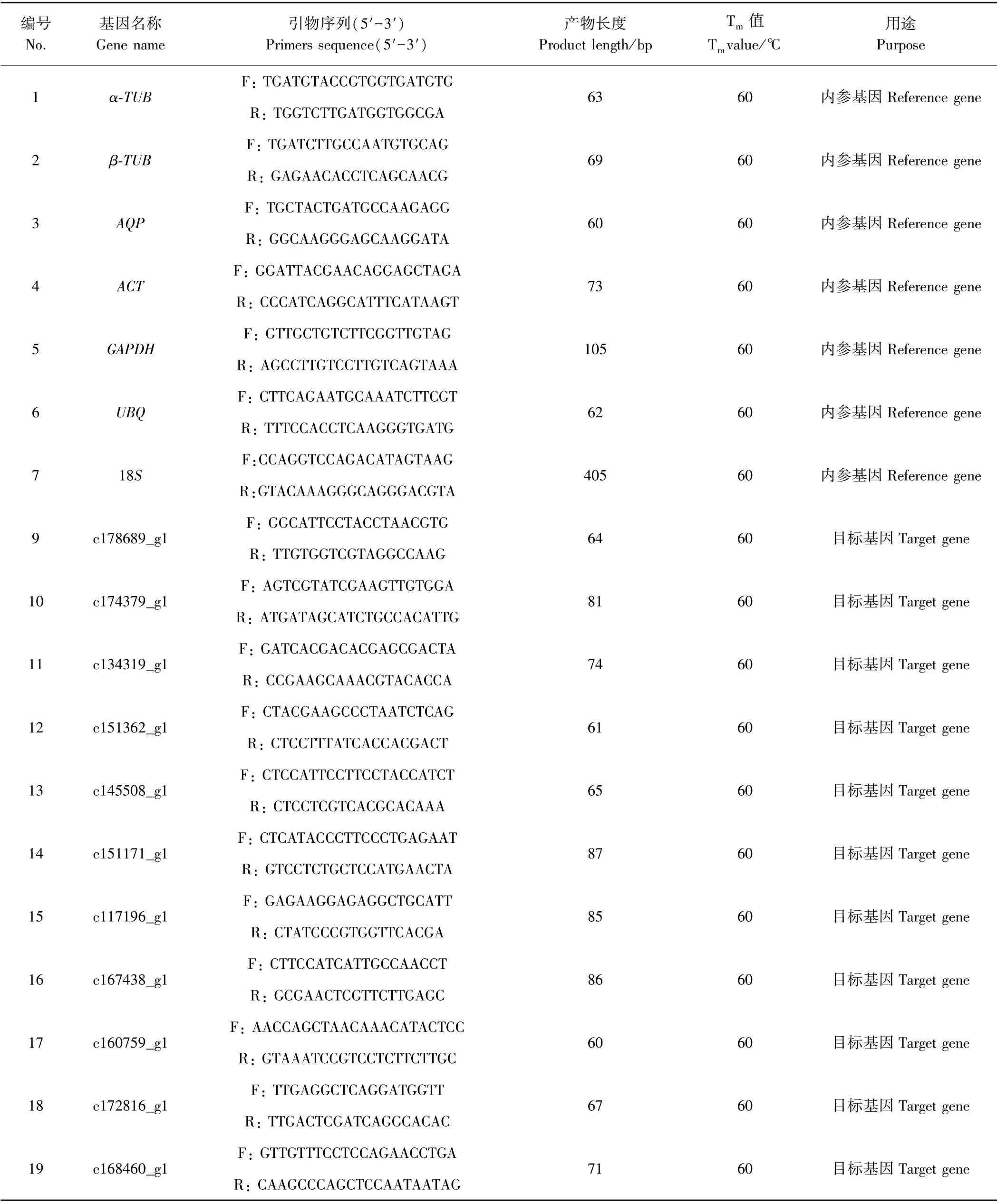
表3 本研究所用引物Table3 Primers used in this study
1.2.2 总RNA 提取及cDNA 合成 按照RNAprep Pure 多糖多酚植物总RNA 提取试剂盒[天根生化科技(北京)有限公司]说明书提取西南鸢尾和白花西南鸢尾花蕾组织总RNA,取部分总RNA 采用NanoDrop 2 000 分光光度计(Thermo,美国)检测浓度及OD260/OD280 值,经1%琼脂糖凝胶电泳检测RNA 完整性。取0.5 μg 总RNA 按照HiScript ⅡQ RT Super Mix for qPCR(南京诺唯赞生物科技有限公司)说明书进行cDNA 合成,将合成的cDNA 稀释10 倍后于-20℃保存备用。
1.2.3 候选内参基因RT-PCR 分析 以已合成的cDNA 为模板,用2×Taq Master Mix 进行反转录PCR(reverse transcription PCR,RT-PCR)。 反应体系包括cDNA 1 μL,上、下游引物(10 μmol·L-1)各1 μL,2×Taq Master Mix 10 μL,ddH2O 7 μL。 反应程序:94℃预变性5 min;94℃变性30 s,55℃退火30 s,72℃延伸30 s,30 个循环;72℃延伸10 min,4℃保存。 取5 ~10 μL PCR 产物经1.5% 琼脂糖凝胶电泳检测。
1.2.4 候选内参基因 RT-qPCR 分析 利用QuantiFast® SYBR® Green PCR Kit(Qiagen,德国)试剂盒于LightCycler® 480 Ⅱ型荧光定量PCR 仪(罗氏,瑞士)上进行RT-qPCR 反应,每反应设置3 次生物学重复。 反应体系包括cDNA 1 μL,上、下游引物(10 μmol·L-1)各0.2 μL,2× QuantiFast® SYBR® Green PCR Master Mix 5 μL,Nuclease-free H2O 3.6 μL。 反应程序:95℃预变性5 min;95℃变性10 s,60℃退火30 s,72℃延伸30 s,40 个循环。 循环结束后利用熔解曲线检测产物特异性,从60℃缓慢升温至97℃,每升温1℃采集5 次荧光信号。
1.3 数据统计与分析
采用Microsoft Excel 2016 对原始Ct值进行统计计算得出平均Ct值。 利用geNorm、Normfider 和Bestkeeper 软件分析候选内参基因在西南鸢尾和白花西南鸢尾 6 个样品中的稳定性。 geNorm 和NormFinder 软件根据原始Ct值进行换算后计算得到各内参基因的表达稳定值,该值大小反映了基因稳定性的高低[24]。 采用BestKeeper 软件分析各候选内参基因原始Ct值之间的标准差(standard deviation,SD)和变异系数(co-variance,CV)即可筛选出最适内参基因。 SD 和CV 值越小,基因表达越稳定,若SD 值大于1,说明该基因稳定性较差[24]。根据geNorm、NormFinder 和BestKeeper 软件分析得到的候选内参基因的稳定性值,通过R 3.2.3 获取其皮尔逊相关系数(pearson correlation coefficient,r)并绘制相关性热图。再采用几何平均值法[25],根据各软件得出的7 个候选内参基因稳定性排名的几何平均数,利用Microsoft Excel 2016 计算7 个候选内参基因表达稳定性的综合排名,通过综合排名筛选出表现最稳定的候选基因。
采用2-ΔΔCt法[26]计算西南鸢尾蓝/白花材料之间的基因表达变化,统计学分析采用平均数±标准差方式,两组样品之间比较采用独立样本t检验,P<0.05被认为具有统计学差异。 采用Microsoft Excel 2016 和R 3.2.3 软件处理数据,并绘制图表。
2 结果与分析
2.1 候选内参基因RT-PCR 分析
候选内参基因的RT-PCR 产物琼脂糖电泳结果表明,7 个候选内参基因均为单一条带,说明引物特异性良好。 7 个候选内参基因在西南鸢尾和白花西南鸢尾各3 个生物学重复共6 个样品间的表达差异不明显,与转录组测序结果相一致,初步判断这7 个候选基因都比较适合作为内参基因。 7 个候选内参基因表达强度差异较明显,其中18S表达最强,UBQ表达最弱(图2)。
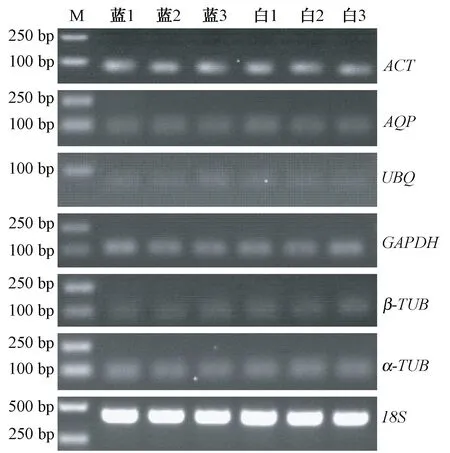
图2 7 个候选内参基因RT-PCR 产物琼脂糖凝胶检测Fig.2 Agarose gel of RT-PCR products of 7 candidate reference genes
2.2 候选内参基因RT-qPCR 分析
RT-qPCR 分析结果表示,7 个候选内参基因的熔解曲线均为明显的单一峰,不存在引物二聚体,说明每个内参基因引物的特异性好,专一性高,结果准确可靠,符合RT-qPCR 标准,该结果与RT-PCR 结果相一致。
对7 个候选内参基因在6 个样品中的Ct值分布情况进行了分析,由图3可知,7 个候选内参基因的平均Ct值介于9.10(18S)~22.52(UBQ)之间,波动范围较大,单个候选内参基因在6 个样品间的因的平均Ct差异较小。 Ct值与表达量成反比,因此18S的表达量最高,UBQ表达量最低,其他候选内参基因Ct值介于二者之间,均为中等表达量。 RT-qPCR 表达量分析结果与RT-PCR 结果相一致。
由表4可知,根据CV 值可初步判断7 个候选内参基因的稳定性均较稳定,其中UBQ的CV(0.916%)最低,稳定性最高;18S的CV 最高,为1.932%,稳定性最低。

图3 7 个候选内参基因的Ct 值分布Fig.3 Distribution of Ct value of 7 candidate reference genes in all samples
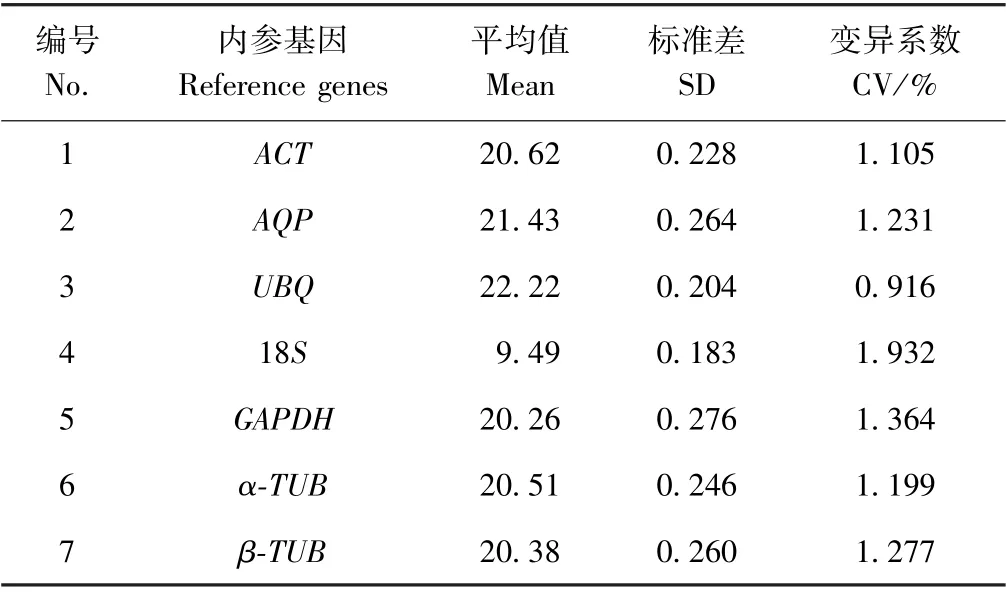
表4 候选内参基因Ct 值分析Table4 Analysis of the Ct values of candidate reference genes
2.3 候选内参基因稳定性分析
通过geNorm、Normfider 和Bestkeeper 软件对7 个候选内参基因的稳定性进行分析。 geNorm 软件是根据计算所得的平均表达稳定(average expression stability,M)值来表示候选基因的表达稳定性,M 值越小候选基因稳定性越好[8]。 geNorm 分析结果表明7个候选内参基因的M 值均较低(<0.4),其中ACT的M 值最低,为0.249,稳定性最好,也最适合作为内参基因;18S的M 值最大,为0.370。 NomFinder 是根据候选基因的表达稳定值(stability value,SV)来表示候选基因的表达稳定性,SV 值越小,候选基因越稳定[8]。NormFinder 分析结果表明ACT的SV 值最小,稳定性最好;18S的SV 值最大,geNorm 与Normfider 分析结果完全一致。 BestKeeper 软件是通过导入Ct值来计算获得候选内参基因在所有样品中的 SD 值。BestKeeper 分析结果表明18S的SD 值最小为0.130,稳定性最好;GAPDHSD 值最大为0.252,稳定性最低。BestKeeper 分析结果与geNorm 和Normfider 的分析结果差异较大。 利用Excel 对geNorm、Normfider 和Bestkeeper 3 个软件分析出的7 个候选内参基因的稳定性排名几何平均数进行综合性评价,结果表明,ACT稳定性最好,最适合做为本研究的内参基因,β-TUB稳定性最低(表5)。 根据3 种软件排名稳定性的r 值分析其相关性,结果发现geNorm 与NormFinder 的相关性最高(r=0.97),达到极显著水平,而NormFinder 与Bestkeeper、geNorm 与BestKeeper 则均为负相关。
2.4 候选目标基因RT-qPCR 分析
以通过稳定性综合评价得到的表现最稳定的ACT作为内参基因,对西南鸢尾及白花西南鸢尾中类黄酮/花青素合成途径和类胡萝卜素合成途径中的12 个色素合成相关基因的表达量进行RT-qPCR 分析,结果表明,12 个花色合成途径的相关基因中有3 个基因(unigene c174379_g1、c178689_g1 和c134319_g1)表现为显著差异表达,且以西南鸢尾为对照,在白花西南鸢尾中unigene c174379_g1 下调表达最明显,其他9个unigene 表达无差异(图4)。 花色素合成相关基因表达量的RT-qPCR 分析结果与转录组测序分析结果相一致。

表5 候选内参基因稳定性分析Table5 Stability analysis of candidate reference genes

图4 西南鸢尾花色素合成相关基因的RT-qPCR 分析结果Fig.4 The RT-qPCR expression pattern of the pigments synthesis related genes in I.bulleyana flower buds
3 讨论
研究表明,植物中的色素类型主要为类黄酮/花青素(flavonoids/anthocyanins)、类胡萝卜素(carotenoids)和甜菜碱素(betalains)3 种,每种色素合成过程均有多个相关基因参与[27-28]。 类黄酮/花青素和类胡萝卜素这2 类色素通常会共存于同一植物体内从而使其花色更丰富[28],关于这2 类色素合成途径的研究也相对较多。 鸢尾属植物中一般以类黄酮/花青素和类胡萝卜素2 种色素类型为主[22,29],鸢尾蓝紫色系花色素主要是飞燕草色素(花青素类色素),橙色、黄色、粉色等色素是类胡萝卜素[29]。 我国鸢尾属植物约有近60 个种、13 个变种和5 个变型,变种和变型多为花色发生变异[19-20]。 在利用花色、果实颜色、叶色、种皮颜色等变异材料进行色素形成机制分析及目标基因筛选研究时常用到转录组测序技术,而对转录组测序结果中色素合成相关基因表达量的分析验证则多通过RTqPCR 来完成[30-32],合适的内参基因是提高RT-qPCR结果准确性的重要前提。
对于色素合成途径中相关基因的表达谱分析,研究者所选用的内参基因也存在一定差异。 对于类黄酮/花青素合成途径相关基因在不同花色、果色等材料之间的表达分析常用的内参基因有ACT[30-31]、TUB[21-32]、AQP[33-34]等;在类萝卜素合成途径相关基因的表达分析上,常用的内参基因有UBQ[35]、转录延伸因子基因(Elongation Factor1a,EF1a)[36]、ACT[37]和18S[29]等。 以上都仅是对类黄酮/花青素或类胡萝卜素两类色素合成途径中的其中一个途径进行分析,未同时对这两类色素合成途径中的相关基因表达谱进行分析,而这两类色素在鸢尾属植物中通常会同时存在。
本研究通过RT-PCR 和RT-qPCR 分析了7 个常用内参基因的表达量,结合3 个不同软件分析它们的稳定性,综合评价筛选出最稳定的内参基因为ACT,与前人研究结果一致[30-31,37]。 此外,进行RT-qPCR 分析试验时,作为本底信号的3 ~15 个循环的荧光信号通常是由于测量的偶然误差造成的,因此RT-qPCR 定量结果一般取Ct值在15~35 个循环的数据进行分析,Ct值过大或过小都会导致定量的不准确[38-39]。 本研究中18S表达量过高(Ct值为9.49),不适合作为RTqPCR 分析的内参基因,结合RT-PCR 电泳结果,该基因可能更适合用于RT-PCR 或核酸杂交(如Northern blot)分析。
Kou 等[2]根据转录组测序数据筛选到适合桃子(Prunus persicaL.Batsch)的内参基因PpMUB6;Liu等[3]利用转录组测序结果筛选到黑麦草(Lolium multiflorum)最稳定的内参基因Unigene14912;杨丹等[8]根据转录组测序数据筛选到适合于平欧杂种榛(Corylus heterophyllaFisch.×C.avellanaL.)的内参基因ChaActin和Ch18S rRNA。 本研究以筛选到的表现最稳定的ACT基因作为内参,对西南鸢尾转录组测序数据中筛选到的类黄酮/花青素和类胡萝卜素两类色素合成途径中的部分相关基因表达量进行RT-qPCR验证,发现RT-qPCR 结果与转录组测序结果相一致。表明本研究筛选出的内参基因不仅可用作西南鸢尾花色变异材料之间花色素合成相关基因表达分析的内参基因,也为鸢尾属其他植物不同花色变异材料或品种间花色素合成相关基因表达量分析时内参基因的筛选提供了参考。 本研究也进一步证明,根据材料本身转录组测序数据来筛选内参基因比引用其他材料(或试验条件下的)内参基因的稳定性更好,尤其是对于一些相关研究基础比较薄弱的物种。 但本研究只选择了与转录组测序所用材料一致的花蕾组织样本对候选内参基因的稳定性及目标基因的表达量进行分析验证。候选内参基因在西南鸢尾其他不同组织部位或同一组织不同发育时期样品中是否也具有良好的稳定性还有待进一步验证。
4 结论
本研究根据西南鸢尾和白花西南鸢尾的转录组测序数据,利用geNorm、Normfider 和Bestkeeper 软件分析了7 个候选内参基因在西南鸢尾及其白花变型花蕾组织中的稳定性,筛选出1 个最稳定的内参基因Actin,以此基因为内参对西南鸢尾花色素合成途径中部分相关基因表达谱的RT-qPCR 验证结果与转录组测序数据完全一致。 该基因可作为西南鸢尾蓝/白不同花色花蕾组织中花色形成相关基因表达分析时的内参基因。 本研究结果为鸢尾属植物花色素合成相关基因表达分析内参基因的筛选以及鸢尾属植物资源利用和花色育种研究提供了理论参考。

