Hsp70在小鼠体外早期胚胎发育中的表达
仇晓飞 何翃闳 张同享 韩小红 刘敏清 潘阳阳 余四九 徐庚全
(甘肃农业大学动物医学院/甘肃省牛羊胚胎工程技术研究中心,甘肃 兰州 730070)
研究表明,一些压力源如温度过高等会影响哺乳动物早期胚胎的发育[1]。 为了抵御压力,生物体会产生一种复杂的包含多种特殊蛋白质的自我保护系统,如热休克蛋白(heat shock proteins,HSP)。 HSP 是指细胞在应激原尤其是高温诱导条件下产生的由热激基因编码合成的高度保守的蛋白质[2]。 哺乳动物细胞内存在多种HSP 家族成员,根据相对分子质量和结构同源程度可分为sHsps、 HSP60、 HSP70、 HSP90、HSP110[3]。 HSP 家族成员在应激条件下与核苷酸或其他伴侣相互作用,介导蛋白质的折叠、再折叠、易位、降解或低聚组装等过程[4-5]。
HSP70 作为分布最广、保守程度最高的一个家族,在植物体中已经鉴定其成员是普遍存在的分子伴侣[6],且对维持动物的细胞稳态发挥着重要作用[7-8]。该家族可分为4 种蛋白质,即HSP70、HSC70、GRP78和GRP75,HSP70 又称HSP72,属于诱导型HSP70,存在于细胞核内,在正常细胞中表达量较少,但是在应激状态下,其表达量迅速增加;HSC70 又称HSP73,属于结构型HSP70,存在于胞浆中,是哺乳动物细胞内的结构蛋白,在所有细胞中均有表达;GRP78 存在于内质网上,主要参与内源性的细胞保护过程[9];GRP75 存在于线粒体内,行使伴侣蛋白的功能,不能被热应激所诱导[10-11]。
研究表明,HSP70 家族中的Hsp70 既能发挥分子伴侣的作用,又能对氧自由基引起的细胞损害产生抗氧化应激反应,起到保护细胞的作用[12]。 此外,Hsp70还参与细胞增殖,抑制细胞凋亡,帮助必需蛋白重新折叠因应激和炎症损伤的结构,从而固定病变[13-14]。Hsp70 作为胚胎转录组激活后在胚胎早期发育中组成表达最早的基因之一[15],能表达于哺乳动物胚胎细胞,促进胚胎细胞的正常发育,增加胚胎对热应激的耐热性,对胚胎细胞有保护作用[16-17]。Hsp70 也存在于雌性生殖系统,当机体受到热应激或氧化应激时,可能通过增加Hsp70 的表达来保护其生殖功能[18]。
小鼠早期胚胎发育过程中基因的表达存在2 种状态:一是受精后不久,胚胎中基因的转录处于非活性状态;二是合子基因激活后的活跃转录状态,这2 种转录状态由3 个时期组成,其中在2 细胞早期,有少量的蛋白质(如HSP70)合成[19]。 研究表明,Hsp70 可通过改善小鼠的免疫功能,保护小鼠免受感染后肠易激综合征(post-infectious irritable bowel syndrome,PI-IBS)的侵袭[14]。 Zhu 等[20]研究表明热应激能使体外培养的小鼠早期胚胎合成热休克蛋白,HSP70 家族的某些热休克蛋白能在小鼠胚胎腭的正常发育过程中表现出不同的表达模式和发育阶段的相关特征。 孤雌激活是指卵子未通过受精作用,即未经过精子和卵子结合成受精卵而发育成胚胎的方式,是在缺乏父源性基因组的情况下,通过物理或者化学方法刺激MⅡ卵被激活并发生卵裂,从而发育成胚胎的过程[21]。 孤雌激活有助于提高MⅡ卵的利用率,能更好地揭示卵细胞被激活的机理,并且在体内外适宜的培养环境中可以进一步卵裂发育成孤雌囊胚,为进一步了解精卵结合过程中的生理机制提供理论依据[22-24]。 但目前关于Hsp70在小鼠早期胚胎发育过程中表达的研究尚鲜见报道。
本试验通过孤雌激活小鼠卵母细胞并收集各时期胚胎,采用实时荧光定量PCR 检测Hsp70 在各个时期小鼠胚胎的表达情况,通过免疫荧光染色检测其在各个时期小鼠胚胎的表达定位,旨在阐明Hsp70 在小鼠早期胚胎发育的表达情况,为进一步研究Hsp70 在胚胎抗热应激中的作用及机理提供理论依据。
1 材料与方法
1.1 材料
选择体重约20 g 的SPF 小鼠100 只(雌鼠80 只,雄鼠20 只)为试验材料,购自中国农业科学院兰州兽医研究所,合格证号:SCXK(甘)2015-0001。
1.2 方法
1.2.1 超排及处理 第1 天下午18:00 为饲养了2周的母鼠腹腔注射(离乳头最近,靠近大腿一侧)10 IU孕马血清促性腺激素( pregnant mare serum gonadotropin,PMSG),在第3 天下午18:00 再次注射10 IU 人绒毛膜促性腺激素( human chorionic gonadotropin,HCG)。 15 h 后,即第4 天上午9:00 左右颈椎脱臼处死母鼠,取出卵巢。
1.2.2 小鼠卵母细胞的采集及体外成熟培养 在处死小鼠前的1~2 h 平衡配制好的孤雌激活剂SrCl2+细胞松弛素B(cytochalasin B,CB)、无血清的磷酸缓冲液,将水浴锅调至38℃预热生理盐水。 处死小鼠并取出卵巢后用生理盐水清洗卵巢。 在BX51-DP71 体式显微镜(Olympus 公司,日本)下观察并挑破输卵管的膨大部,挤出卵丘-卵母细胞复合体(cumulus-oocyte complexes,COCs),用采卵针将其放置于有洗卵液(DPBS+5%FBS)的培养皿中清洗3 遍,然后将COCs 置于已在CO2培养箱中预平衡过的成熟液(TCM199+10% FBS +100 μg·m L-1FSH+100 μg·m L-1LH+100 μg·m L-1E2+100 μg·m L-1青霉素+100 μg·m L-1链霉素) 中培养,培养温度为37℃、湿度为饱和湿度(95%)、CO2浓度为5%,当培养至24 h 第一极体出现时,表明卵母细胞已培养成熟。
1.2.3 小鼠卵母细胞的孤雌激活及其胚胎的发育培养 将培养成熟的卵母细胞移至杜氏磷酸缓冲液(dulbecco’s phosphate buffered saline,D-PBS)进行清洗,用0.1%透明质酸酶将其消化3 ~5 min,用移液枪反复吹打以便快速脱去卵丘细胞。 然后用有血清的D-PBS 将挑选出的卵母细胞漂洗2 ~3 遍,将卵母细胞移至SrCl2+CB 液中进行5 h 的孤雌激活,温度为37℃,在孤雌激活开始后的3~4 h 配制好G1 培养液,孤雌激活完成后在BX51-DP71 体式显微镜下观察其激活状况,然后移至G1 培养液中,将G1 培养液放入37℃、饱和湿度(95%)、5% CO2的培养箱进行培养,适时收集2 细胞期、4~8 细胞期、9~16 细胞期、桑椹期和囊胚期的胚胎。
1.2.4 引物设计 利用GeneBank 查询到Hsp70 基因的核苷酸序列,然后通过Primer Premier 5.0 设计1 对由华大基因公司合成的引物Hsp70。 引物信息详见表1。
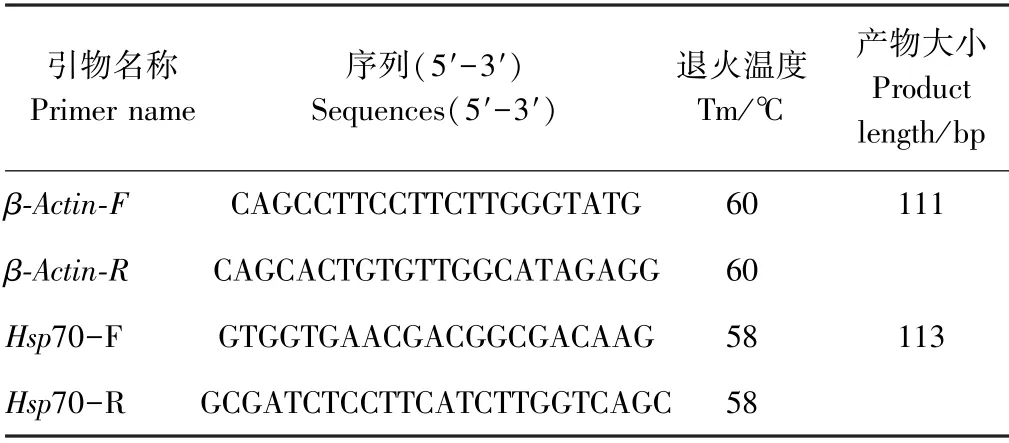
表1 引物序列Table1 Primer sequence
1.2.5 小鼠早期胚胎RNA 的提取和反转录 取小鼠早期胚胎培养至2 细胞期、4~8 细胞期、9~16 细胞期、桑椹期和囊胚期胚胎各10 枚,按照动物细胞Total RNA Kit Ⅰ(50)RNA 提取试剂盒(Omega 公司,美国)说明书提取总RNA,然后按照Go ScriptTMReverse Transcription System 反转录试剂盒(Omega 公司,美国)说明书将提取的总RNA 反转录成cDNA,-20℃保存备用。
1.2.6 小鼠Hsp70 基因在不同时期孤雌激活胚胎中的扩增 用T100TMThermal Cycler 普通PCR 仪(Rio-Rad 公司,美国)以及特异性引物进行目的引物和内参引物的扩增,总体系为20 μL,包括小鼠早期胚胎的cDNA 模板1 μL,Go TapⒸGreen Master Mix 10 μL,ddH2O 8 μL,上下游引物各0.5 μL。 扩增程序:95℃预变性4 min,95℃变性30 s,58℃退火20 s,72℃延伸30 s,35 个循环;72℃终延伸10 min,4℃保存。 PCR 扩增完成后,用2%琼脂凝胶电泳对PCR 产物进行电泳,拍照并分析引物的特异性(内参引物使用β-Actin[25-26])。
1.2.7 Real-time Q-PCR 测定Hsp70 基因在不同时期孤雌激活胚胎中的表达情况 采用ABI ViiAT 实时荧光定量PCR 仪(Life technologies 公司,美国)以及特异性引物进行目的引物和内参引物的扩增,总体系为20 μL,包括cDNA 模板2 μL,Go TapⒸGreen Master Mix 10 μL,ddH2O 6.6 μL、Rox Reference Dye 0.4 μL,上下游引物各0.5 μL。 PCR 扩增程序:95℃预变性30 s,95℃变性10 s,58℃退火30 s,72℃延伸30 s,35 个循环;各个时期胚胎的样品重复4 次,进行熔解曲线检测,并用2-ΔΔCt法[2]计算Hsp70 基因的相对表达量。
1.2.8 间接免疫荧光染色检测Hsp70 在不同时期孤雌激活胚胎中的分布 取小鼠各时期胚胎5 枚在室温下用免疫组化固定液固定30 ~60 min,然后用免疫染色洗涤液将胚胎清洗3 遍,每遍清洗5 min,随后用TritonX-100 透化30 min,磷酸缓冲液冲洗3 遍,每遍清洗5 min,用免疫组化封闭液进行室温封闭30 min,然后一抗4℃孵育过夜。 用磷酸缓冲液冲洗3 遍,每遍清洗5 min,二抗室温孵育1 h,然后用磷酸缓冲液冲洗3 遍,每遍清洗5 min。 随后用4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2phenylindole,DAPI)染色10 min,磷酸缓冲液冲洗3 遍,每遍清洗5 min,封片。 采用BX51-DP71 荧光显微镜(Olympus 公司,日本)分别[在紫外区域激发光(385 ~400 nm)、蓝光区域激发光(475~490 nm)、绿光区域激发光(545 ~565 nm)]照相。
1.3 数据统计与分析
采用SPSS 21.0 分析软件对实时荧光定量PCR检测的结果进行统计分析。
2 结果与分析
2.1 小鼠胚胎体外培养结果
体外培养小鼠胚胎,统计各时期胚胎发育比例:成熟卵母细胞共182 个,卵裂胚胎168 个,占92.31%;4~8 细 胞161 个,占88.46%; 桑 椹 胚156 个,占85.71%;囊胚146 个,占80.22%。 在显微镜下观察到2 细胞期、4~8 细胞期、9 ~16 细胞期、桑椹期、囊胚期的发育情况,且发育状况良好(图1)。
2.2 小鼠Hsp70 基因在不同时期孤雌激活胚胎中的扩增
琼脂凝胶核酸电泳结果显示,内参基因β-Actin与目的基因Hsp70 的条带单一,PCR 扩增产物长度与引物设计的产物长度[β-Actin(111 bp),Hsp70(113 bp)]大小基本相符(图2),证明反转录得到的cDNA 良好,可用于后续研究。
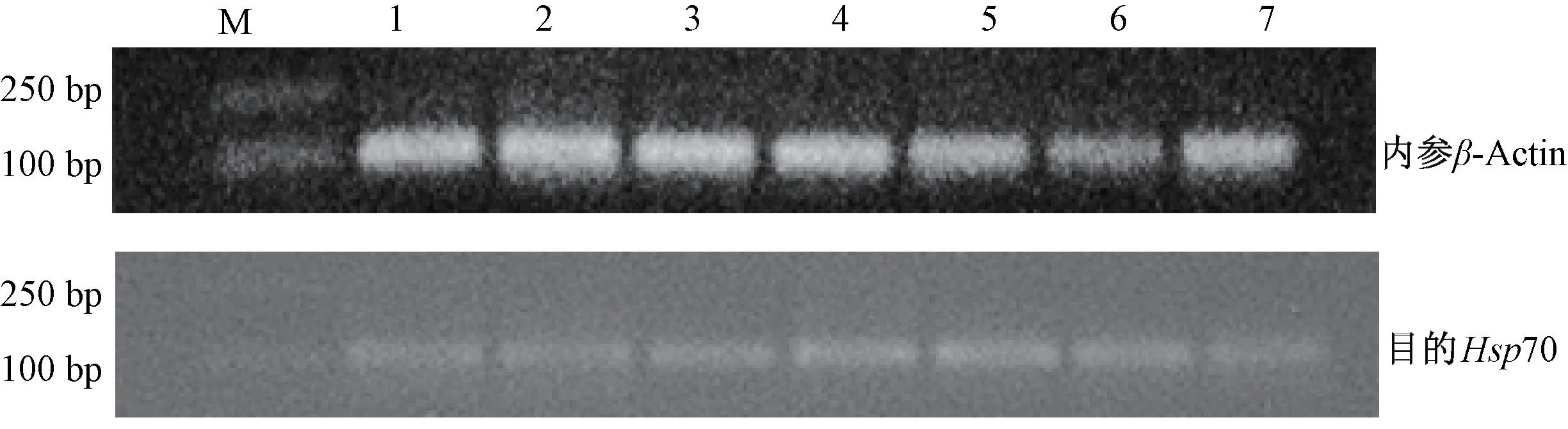
图2 胚胎不同发育时期的核酸电泳图Fig.2 The nucleic acid electrophoresis of embryonic development in different periods
2.3 Real-time Q-PCR 测定Hsp70 基因在不同时期孤雌激活胚胎中的表达情况
由图3可知,内参基因β-Actin与目的基因Hsp70的荧光信号峰都相对单一,表明引物的特异性较好,试验结果合理。 由图4可知,2 细胞期胚胎和4 ~8 细胞期胚胎Hsp70 的相对表达水平较高,9 ~16 细胞期胚胎、桑椹期胚胎和囊胚期胚胎Hsp70 的相对表达水平较低。 其中,Hsp70 在9 ~16 细胞期胚胎、桑椹期胚胎和囊胚期胚胎的相对表达量与2 细胞期胚胎和4 ~8细胞期胚胎的相对表达量均差异显著,且在2 细胞期胚胎和4 ~8 细胞期胚胎Hsp70 的相对表达量分别是桑椹期胚胎Hsp70 相对表达量的1.3 倍和1.4 倍。

图3 Hsp70 和β-Actin 基因的溶解曲线Fig.3 Melting curve of Hsp70 and β-Actin gene
2.4 间接免疫荧光染色检测Hsp70 在不同时期孤雌激活胚胎中的分布
Hsp70 绿色荧光在细胞质中的定位不如在细胞核中明显:在2 细胞期胚胎和4~8 细胞期胚胎,Hsp70 定位于细胞核和细胞质中,9~16 细胞期胚胎以后,Hsp70主要定位于细胞核中(图5)。

图4 胚胎发育各时期Hsp70 的相对表达水平Fig.4 The relative expression level of Hsp70 at different stages of embryonic development
3 讨论
大量研究表明,HSP70 家族与胚胎发育有关,GRP78 可能在小鼠胚胎植入过程中发挥重要作用,GRP78 的表达主要受活性囊胚和母体雌激素的调控[27]。 HSP72 对胚胎发育有一定的保护作用[28]。HSP71 和HSP73 在大鼠胚胎着床后神经胚形成和神经板应激时能表达,而HSC71 在小鼠胚胎着床前从2细胞到囊胚期均有合成,HSC74 在小鼠胚胎着床前于1 细胞期胚胎开始表达,直到囊胚期,HSP68 在小鼠胚胎着床前2 细胞期开始表达,囊胚阶段可热诱导;在小鼠和鸡胚胎着床后于胸腺细胞、鸡的肢芽中都能表达[29]。
朱勇飞等[29]发现Hsp70 在小鼠胚胎着床前,可在桑椹胚和囊胚阶段诱导表达。 张宝[30]也指出Hsp70能表达于多种动物的胚胎,且在其各个发育阶段往往都存在,能够推动胚胎的发育。 本研究发现Hsp70 在小鼠体外早期胚胎的2 细胞期、4 ~8 细胞期、9 ~16 细胞期、桑椹期、囊胚期均有表达,与前人研究一致。 本试验还发现,Hsp70 在2 细胞期胚胎和4 ~8 细胞期胚胎的相对表达水平较高,9 ~16 细胞期胚胎、桑椹期胚胎和囊胚期胚胎的相对表达水平较低。 Edwards 等[31]指出,Hsp70 可在2 细胞期诱导表达,但在4 细胞期阶段之后开始被抑制。 这与本研究发现的Hsp70 在2 细胞期胚胎和4~8 细胞期胚胎的相对表达水平较高,9~16 细胞期胚胎、桑椹期胚胎和囊胚期胚胎的相对表达水平较低的结果相符。 姜同泉等[24,32]发现,轻微的温度改变能引起胚胎发生热休克反应,启动Hsp70 基因的表达;在受到应激时,哺乳动物的胚胎能够诱导合成大量的Hsp70,当应激强度在一定范围时,Hsp70 能起到保护胚胎的作用,但当应激强度超过该范围,Hsp70 会对胚胎的生长发育起到干扰作用。 推测Hsp70 的表达可能还与热应激强度、胚胎耐热性有关,但其具体关系尚不清楚,需要进一步研究。
Matwee 等[33]发现,培养基中Hsp70 抗体的存在显著减少了到达囊胚期的牛胚胎数量,魏世宝等[34]也指出,Hsp70 抗体能显著降低鼠囊胚发育率。 Hunter 等[35]发现Hsp70 能够抑制小鼠胚胎发生期形态学异常。Edwards 等[31]指出牛的后期胚胎对热休克有抵抗反应,且部分抵抗可能是由Hsp70 组成分子调控的改变引起的。 本试验通过观察免疫荧光染色结果发现,在2 细胞期胚胎与4~8 细胞期胚胎,Hsp70 定位于细胞核和细胞质中,而从9~16 细胞期胚胎以后,Hsp70 主要定位于细胞核中。Hsp70 在胚胎不同发育时期,其定位发生变化,暗示其在胚胎发育过程中发挥着调控作用,但具体的调控机理尚不清楚,有待进一步研究。
4 结论
本研究结果表明,Hsp70 在小鼠体外早期胚胎发育的各个时期均会表达,但各个时期的相对表达量存在差异。Hsp70 能定位于细胞核和细胞质中,但在细胞核和细胞质中的相对表达量也存在差异,即随着胚胎的发育,Hsp70 主要定位于细胞核中,表明Hsp70 对小鼠体外早期胚胎的发育具有潜在的调控作用。 本研究为进一步明确Hsp70 在胚胎抗热应激中的作用及机理提供了一定的理论依据。

