60Co-γ射线辐射对木薯组培苗的诱变效应
曾文丹 严华兵 曹 升 谢向誉
(1广西农业科学院经济作物研究所,广西 南宁 530007;2广西作物遗传改良生物技术重点开放实验室,广西 南宁 530007)
组织培养结合辐射诱变技术,可以明显提高植物在分子水平上的变异频率,扩大植物的变异范围,将其中的有益突变进行固定和增殖,对突变体进行有效的诱导和筛选,是种质资源创新和新品种选育的高效途径之一[1-4]。 目前已有果树[5]、花卉[6-7]、蔬菜[8]、中药材[9]等多种植物利用组织培养结合诱变技术获得了优异的突变种质材料的研究报道。 如Mandal 等[10]通过辐射诱变菊花不定芽成功分离出纯色花突变体;Das 等[11]利用辐射诱变结合茎尖培养技术获得了耐高温的马铃薯突变体;Mshara 等[12]在香蕉离体茎段培养中反复进行γ 射线照射,得到了矮化、卵圆形叶、深绿色叶等形态变异的突变体。
木薯(Manihot esculentaCrantz)遗传背景杂合度较高,采用传统育种方法进行种质创新较为困难[13-14]。目前已有运用诱变育种技术对木薯种质创新的研究报道。 Nwachukwu 等[15]以木薯成熟种茎为外植体材料,通过辐射诱变获得了一批氰化物、干物质和淀粉含量存在差异的突变株系;Sanchez 等[16]利用γ 射线诱变木薯种子,获得了一个淀粉颗粒小、直链淀粉含量高的突变株系;Ahiabu 等[17]以木薯组培苗茎尖为外植体,利用γ 射线对加纳品种Bosom nsia 进行辐射诱变,获得了ACMV 抗性的突变株系。 但利用木薯组培苗进行辐射诱变的研究并不常见。
本研究在已建立的木薯组织培养体系的基础上,以2 个木薯品种新选048 和SC205 组培苗为试验材料,研究不同60Co-γ 射线辐射处理对木薯组培苗的诱变效应,以期为利用60Co-γ 射线辐射诱变创造木薯新种质以及木薯诱变育种奠定一定的理论基础。
1 材料与方法
1.1 试验材料
以木薯品种新选048 和SC205 单芽茎段为试验材料,2 个品种均来自于广西农业科学院经济作物研究所。
分别设置0(CK)、5、10、20、40 Gy 5 个60Co-γ 射线辐射处理,剂量率为1 Gy·min-1。 每个处理接种5瓶,每瓶接种6 个单芽茎段,每处理设3 次生物学重复,置于光照培养箱中,培养条件为温度27±1℃、光周期为16 h 光照/8 h 黑暗,光照强度为1 500~2 000 lx。
1.2 试验方法
1.2.160Co-γ 射线辐射处理对木薯组培苗继代增殖及植株再生的影响 取经不同辐射处理后的新选048和SC205 单芽茎段转入新鲜继代培养基(MS + 6-BA 0.02 mg·L-1+ NAA 0.02 mg·L-1+糖20 g·L-1)中培养,分别于继代培养7、14、21、28 d 后,采用直尺法和计数法,调查统计生根率、腋芽萌发率。 取经不同辐射处理后萌发的植株,采用相同继代培养基进行增殖培养,30 d 后调查统计株高和繁殖系数。 同时观察辐射处理后组培苗的生长情况。 随后将生长的组培苗转入生根培养基(1/2 MS + NAA 0.02 mg·L-1+糖20 g·L-1)中,30 d 后调查统计组培苗生根率及生长变异情况。
1.2.260Co-γ 射线辐射处理对木薯组培苗移栽生长情况调查 将生根苗培养30 d 后,移入温室炼苗,放置7 d 左右,拧松瓶盖,使瓶内的环境与外界保持一致,让组培苗在自然状态下驯化3 ~5 d 后取出幼苗,洗净附着的培养基,移植于珍珠岩︰草炭土为1 ∶2体积比的混合基质中,30 d 后统计成活率。 移栽成活后将材料种植于大田,观察统计种植材料的表型变异情况。
1.2.3 组培苗半致死辐照剂量的确定 参考王磊[18]的方法确定半致死剂量(medial lethal dose,LD50)。 本试验以不同辐射剂量x为自变量,不同剂量下的死亡率y为因变量,利用直线回归方程y=a+bx和公式LD50=(50-a)/b 进行计算。
式中,a=(Σy-Σx)/N;b=(Σxy-ΣxΣy/N)/[Σx2-(Σx)2/N]。 N 为样本量,计算半致死剂量。 相关系数r=(Σxy-ΣxΣy/N)/[Σx2-(Σx)2/N]1/2[Σy2-(Σy)2/N]1/2。
1.2.4 DNA 提取与SSR 分子标记 挑选田间表现差异的SC205 和新选048 植株及其正常植株,提取基因组DNA 并进行SSR 分子标记检测,采用CTAB 法[19]提取幼叶总DNA,采用1%琼脂糖凝胶电泳检测DNA质量,并用P330 紫外分光光度计(Implen,德国)检测DNA 浓度和纯度,将DNA 浓度稀释至50 ng·g-1。
运用筛选出条带清晰、多态性高的17 对引物[20]对突变体及正常植株样本进行SSR 分子标记,17 对引物序列详见表1。

表1 引物名称及序列Table1 Primer name and sequence
1.3 数据统计分析
采用SPSS 18.0 和Excel 2003 对数据进行处理、统计与分析。
2 结果与分析
2.1 60Co-γ 射线辐射处理对组培苗继代培养及生根培养的影响
2.1.160Co-γ 射线辐射处理对组培苗腋芽发生率的影响 由表2可知,随着辐射剂量的增加,SC205 和新选048 的生根率和腋芽萌发率均显著降低,表明60Coγ 辐射对组培苗生长具有一定的抑制作用,且抑制作用随着辐射剂量的增加而加强。 随着培养时间的增加,2 个木薯品种在低剂量(≤10 Gy)辐射处理下,组培苗的生根率和萌发率均随之增加;但当辐射剂量为20 Gy 时,新选048 组培苗培养21 d 后,生根率和萌发率均不再增加。 新选048 组培苗培养28 d 后,10 Gy处理下的生根率和萌发率分别为24.5%和60.0%,而SC205 组培苗的生根率和萌发率分别为27.8%和74.4%,当辐射剂量增加至20 Gy 时,新选048 的生根率和萌发率均为0,植株全部死亡,表明低剂量辐射处理的木薯品种新选048 组培苗的生根、萌发均能维持在正常水平。 但随着辐射剂量的增加,60Co-γ 射线对组培苗的伤害程度逐渐增强,其株高明显降低(图1)。SC205 的生根率和萌发率分别为3.3%和5.5%(图2)。 表明新选048 对60Co-γ 的辐射敏感性强于SC205。 当辐射剂量为40 Gy 时,2 个木薯品种的萌发率和生根率均为0,表明新选048 的致死剂量范围为10~20 Gy,SC205 的致死剂量范围为20~40 Gy。
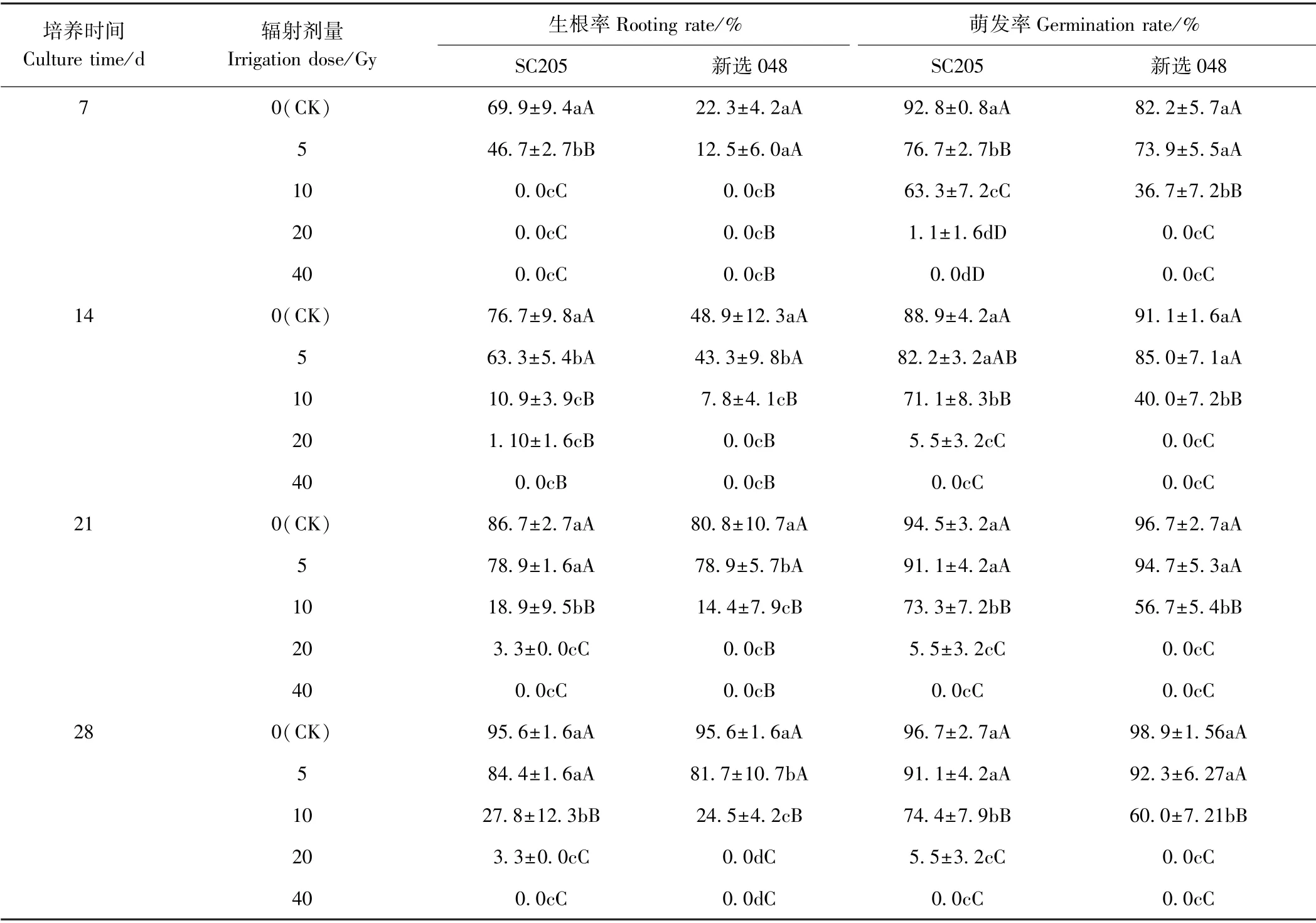
表2 不同60Co-γ 辐射处理对组培苗生根率和腋芽发生率的影响Table2 Effect of different 60Co-γ irradiation treatment on rooting rate and germination rate of the tissue cultured plantlets

图1 不同60Co-γ 辐射处理后木薯品种新选048 组培苗的生长情况(28 d)Fig.1 The growth of the tissue cultured plantlets of xinxuan048 in different 60Co-γ irradiation treatment(28 days)
2.1.260Co-γ 射线辐射对组培苗继代增殖的影响 由表3可知,随着辐射剂量的增加,2 个木薯品种的繁殖系数均有所下降,但各处理间差异不显著,说明60Co-γ射线辐射对组培苗增殖效果影响不大。 随着辐射剂量的增加,2 个木薯品种组培苗的株高逐渐降低,长势也逐渐减弱。 其中5 Gy 处理下,SC205 的苗高有所降低,但与CK 差异不显著,而新选048 的株高极显著降低。 说明60Co-γ 射线辐射对新选048 组培苗的损害较大,且60Co-γ 辐射对继代增殖组培苗同样具有矮化作用,且辐射剂量越大,矮化及损伤效果越明显。此外,低剂量(5 Gy)的60Co-γ 射线辐射处理的部分组培苗叶片较CK 浓绿,长势旺盛。 而当辐射剂量≥10 Gy 时,组培苗生长不整齐,甚至出现黄化苗。

图2 20 Gy 辐射处理木薯品种SC205 组培苗的生长情况(28 d)Fig.2 The growth of the tissue cultured plantlets of SC205 in 20 Gy(28 days)
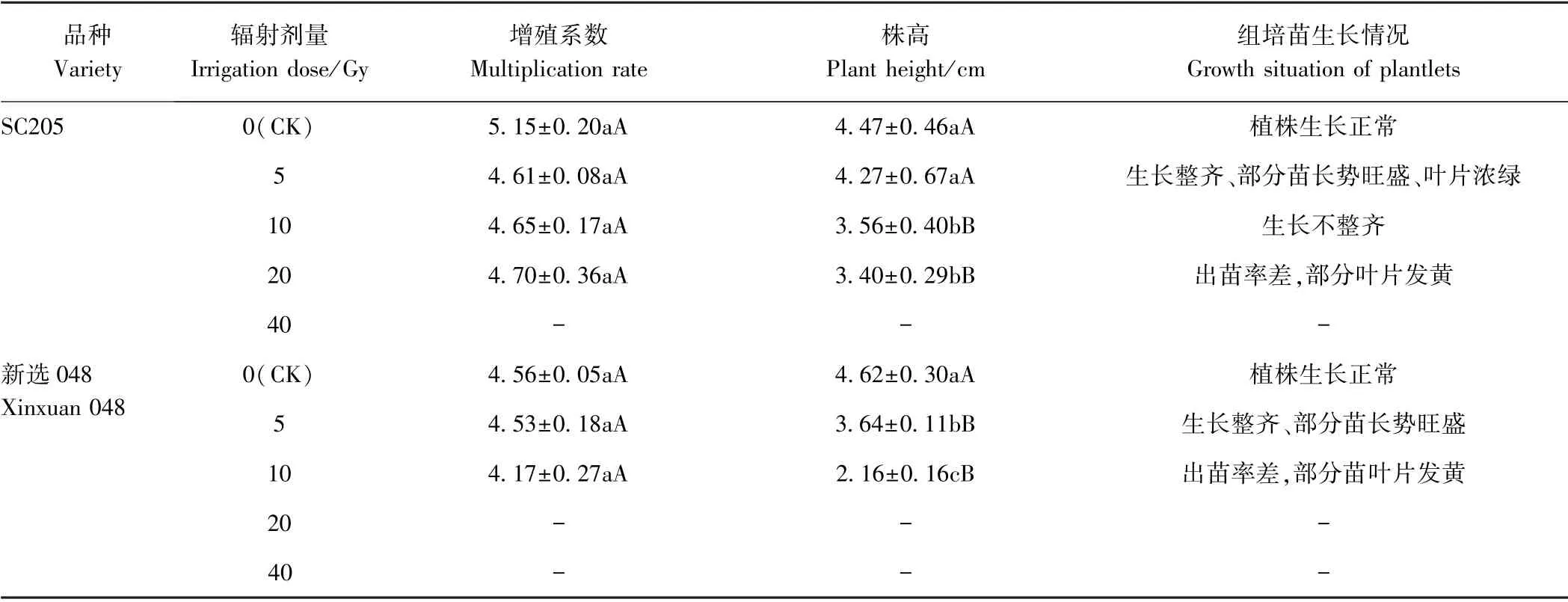
表3 不同60Co-γ 辐射处理对组培苗继代增殖的影响Table3 Effect of different 60Co-γ irradiation treatment on subculture multiplication of the tissue cultured plantlets
2.1.360Co-γ 射线辐射对组培苗生根的影响 由表4可知,随着辐射剂量的增加,60Co-γ 射线辐射对组培苗的生根抑制作用明显增强。 5 Gy 处理下SC205 与CK相比生根率无显著差异,而新选048 生根率极显著低于CK。 当辐射剂量大于10 Gy 时,2 个木薯品种的生根率均极显著降低,且植株生长不整齐并出现叶柄呈红色或紫红色,叶形变异,花叶,细叶,黄化苗的突变体。
通过形态学观察发现,2 个木薯品种均存在不同程度的形态变异。 部分组培苗的叶柄颜色变为紫红色、红色、土黄色;部分组培苗叶片形状发生改变,变为盾状叶、一裂叶等(图3);部分组培苗叶片变为细叶、长叶和黄化苗(图4、图5)。

图3 新选048 组培苗叶片的变异Fig.3 Variation of the leaves of tissue cultured plantlets of Xinxuan 048

图4 新选048 组培苗的形态变异Fig.4 The morphological variation of tissue cultured plantlets of Xinxuan 048
2.2 60Co-γ 射线辐射对组培苗移栽成活率的的影响
由表5可知,随着辐射剂量的增加,2 个品种组培苗的移栽成活率均逐渐降低。 SC205 和新选048 在5 Gy 处理下组培苗的移栽成活率分别为71.2%和76.3%;10 Gy 处理下组培苗移栽成活率分别为50.5%和58.8%。 表明高剂量辐射处理不利于木薯组培苗的移栽成活。 本试验中,SC205 共获得6 株突变体材料,其中10 Gy 处理下共获得4 株突变体材料,20 Gy处理下共获得2 株突变体材料。 新选048 共获得3 株突变体材料,其中5 Gy 处理下获得1 株突变体材料,10 Gy 处理下共获得2 株突变体材料。 突变体材料主要表现在叶形变异或株型变异(图6、图7)。

表5 不同60Co-γ 辐射处理对组培苗移栽成活率的的影响Table5 Effects of different60Co-γ irradiation treatment on transplanting survival rate of the tissue cultured plantlets
2.3 半致死剂量的确定
2 个木薯品种通过对辐照剂量与组培苗死亡率进行相关性与回归性分析,得到线性方程。 新选048 线性方程为y=2.739x+ 8.007,相关系数R2=0.889;SC205 线性方程为y=2.788x+ 1.992,相关系数R2=0.841,说明,2 个木薯品种组培苗的死亡率和辐照剂量均存在正相关关系。 根据直线回归方程可得,新选048 的半致死浓度为15.33 Gy;SC205 半致死剂量为17.22 Gy。 表明木薯品种新选048 对60Co-γ 射线辐射敏感性强于SC205。

图6 新选048 突变体材料Fig.6 Variant plants of Xinxuan048
2.4 60Co-γ 射线辐射诱变材料的SSR 分析
应用多态性较高的17 对引物对筛选得到的SC205 和新选048 突变体进行扩增。 采用引物C4 进行扩增时,SC05 突变体材料对比对照材料在180 ~200 bp 之间缺失1 条条带,而采用引物C97 进行扩增时,在120~140 bp 之间扩增出1 条特异性条带,在160 ~180 bp 之间缺失1 条条带。 采用引物C39 进行扩增时,与突变体2 对比,对照材料和突变体1 在120 ~140 bp 之间扩增出1 条特异性条带(图8)。
采用引物C4 进行扩增时,新选048 突变体材料对比对照材料在100~250 bp 和1 000 ~2 000 bp 之间各扩增出1 条特异性条带。 采用引物C39 进行扩增时,突变体材料在靠近250 bp 条带扩增1 条特异性条带。采用引物C96 进行扩增时,突变体材料2 在100 ~250 bp 缺失1 条条带,突变体材料1 扩增出1 条特异条带。 采用引物C97 进行扩增时,突变体材料在靠近100 bp 缺失1 条条带。 采用引物C119 进行扩增时,突变体材料2 在靠近250 bp 扩增出1 条特异条带(图9)。

图8 SC205 变异植株的SSR 分子标记检测结果Fig.8 SSR molecular marker detection results of SC205 variant plants
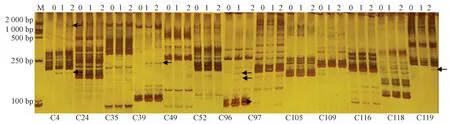
图9 新选048 变异植株的SSR 分子标记检测结果Fig.9 SSR molecular marker detection results of the variant plants of of xinxuan048
上述结果表明,3 条引物(C4、C39、C97)可将SC205 突变体材料与对照区分,其中引物C97 可将2个突变体材料区分开。 5 条引物(C4、C39、C96、C97)可将新选048 突变体材料与对照区分,其中引物C96和C119 可将突变体材料区分。 SSR 分子标记技术可以较好地应用于木薯突变体材料的鉴定。
3 讨论
辐射诱变育种是利用射线诱发生物遗传性的改变,并经人工选择培育新的优良品种的技术[21-22]。 大量研究者运用该技术已成功获得了多种优异的突变种质材料[23-28]。 辐射剂量的选择是获得有效突变体的关键,在一定范围内增加辐射剂量会导致存活率下降和不良突变性状增多,如刘丽强等[29]研究发现,随着60Co-γ 辐射剂量的增加,观赏海棠组培苗的生根率、平均根长、株高、增殖率均明显下降。 邢莉莉等[30]研究发现γ 射线对切花菊试管苗茎段和叶片的愈伤组织诱导及分化具有明显的抑制作用,且随着辐射剂量的增加抑制作用增强。 范明霞[31]以海南本地木薯品种WCE 组培苗离体茎段为试验材料,发现半致死剂量约为25 ~30 Gy。 陆柳英[32]以木薯品种BRA206、SC124、SC8 离体茎段为试验材料,发现60Co-γ 射线辐射的适宜剂量应小于10 Gy。 本研究发现,随着60Co-γ射线辐射剂量的增加,其对2 个木薯品种组培苗的伤害程度均逐渐加强,40 Gy 处理下植株全部死亡,20 Gy下SC205 腋芽萌发率仅为5.5%,新选048 组培苗均死亡,其原因可能是基因型不同,对60Co-γ射线敏感性存在差异。 此外,本研究中,2 个木薯品种经60Co-γ 射线辐射诱变后,在离体培养条件下,均出现叶柄和叶脉颜色改变、叶形变异、黄化苗等形态变异,但随着培养时间的延长以及大田移栽后发现,部分突变性状消失,其原因可能是部分突变材料结构不稳定,细胞进行自我修复或死亡从而导致突变消失[33]。
陆波等[34]研究发现彩色马蹄莲品种Parfait 组培苗经低剂量的60Co-γ 射线辐射后,其丛生芽的增殖系数显著提高,且在一定的剂量范围内呈现剂量效应。罗海燕[35]研究发现,低剂量辐射能促进非洲菊茎尖的生长。 本研究发现低剂量60Co-γ 射线(5 Gy)处理的部分木薯继代组培苗的叶片较对照浓绿,这长势旺盛,与前人研究结果一致。 在一定剂量范围内,60Co-γ 射线辐射处理对木薯组培苗表现出一定的促进作用,可能与植株的酶活性增强有关,但其具体作用机理仍有待进一步研究。
大量研究表明不同基因型对辐射诱变的敏感性和效应存在差异,如郭安熙等[36]发现,绿花、白花、黄花菊花品种诱发花色变异的频率极低,但粉色和紫色菊花品种较易诱发花色变异,且变异谱较宽。 包建忠等[37]对6 个大花君子兰品种进行60Co-γ 射线辐射处理,发现隔覆兰和佛光2 个品种对60Co-γ 射线的敏感性强于其他4 个品种。 本研究发现木薯品种新选048对60Co-γ 射线的敏感程度较SC205 强,SC205 组培苗更适合应用辐射诱变技术获得新种质材料。 本研究为更好地利用60Co-γ 射线辐射诱变创造木薯新种质奠定了一定的理论基础。
4 结论
本研究结果表明不同品种对60Co-γ 射线的敏感程度存在差异,新选048 对60Co-γ 射线的敏感性较SC205 更强;新选048 的半致死剂量为15.33 Gy,SC205 的半致死剂量为17.22 Gy。 随着辐射剂量的增加,对组培苗的伤害程度逐渐加强。 2 个木薯品种组培苗在形态上出现叶柄颜色改变、叶形变异、黄化苗、矮化苗等变异。 经大田移栽后统计,新选048 变异率为3.3%,SC205 变异率为6.6%;SSR 分子标记技术可以较好地应用于木薯突变体材料的鉴定,可为木薯辐射诱变育种早期鉴定提供参考。

