APPL1减轻LPS诱导的心肌细胞损伤的实验研究*
李 波, 郑 植, 陈芃螈
(四川省医学科学院, 四川省人民医院儿科, 四川 成都 610072)
急性心力衰竭是一种临床上常见的心血管系统疾病,感染性内毒素血症诱发的心力衰竭预后较单纯心力衰竭更差[1]。半数以上的感染性内毒素血症诱发心力衰竭与革兰氏阴性菌有关,革兰氏阴性菌细胞壁外膜上的脂多糖(lipopolysaccharides,LPS)是其致病的主要原因之一[2]。LPS能够作用于心肌细胞,诱导心肌组织损伤,导致诱发心力衰竭[3]。APPL1 (adaptor protein, phosphotyrosine interacting with PH domain and leucine zipper 1)在人体内的多个组织和器官中均有表达,参与介导胰岛素信号传递、胞内运输和细胞增殖等生理过程[4-5]。研究表明,APPL1与心血管系统疾病的发生具有密切关系,沉默APPL1可以减弱球状脂联素抗缺氧复氧心肌细胞凋亡作用,提高APPL1表达可以显著增加心肌细胞活力[6-7]。目前对于APPL1在LPS诱导的心肌细胞损伤中作用尚不明确。本实验探讨过表达APPL1对LPS诱导的心肌细胞凋亡及氧化损伤的影响,以期为阐明APPL1在心肌损伤中的作用提供参考资料。
材 料 和 方 法
1 材料
TRIzol试剂、RT-qPCR试剂和逆转录试剂盒均购自TaKaRa;HRP标记的IgGⅡ抗购自Proteintech;全蛋白提取液购自江苏凯基生物技术股份有限公司;过表达APPL1重组慢病毒载体和阴性对照慢病毒载体由上海锐赛生物技术有限公司构建;超氧化物歧化酶 (superoxide dismutase, SOD)检测试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)检测试剂盒和乳酸脱氢酶(lactate dehydrogenase,LDH)检测试剂盒均购自南京建成生物工程研究所;丙二醛(malonaldehyde,MDA)检测试剂盒购自碧云天生物技术研究所;抗活化的caspase-3(cleaved caspase-3)抗体和APPL1抗体购自Stanta Cruz;活性氧(reactive oxygen species,ROS)含量检测试剂盒购自上海翊圣生物科技有限公司。心肌细胞H9c2购自湖南丰晖生物科技有限公司。
2 方法
2.1LPS对心肌细胞中APPL1表达影响 心肌细胞分别经过含有0和1 mg/L LPS的细胞培养液(含10%胎牛血清的DMEM)培养,记为对照(control)组和LPS组。用RT-qPCR和Western blot检测培养24 h后细胞中APPL1的表达变化。
2.1.1RT-qPCR 取control和LPS组的心肌细胞,在细胞中添加TRIzol裂解液,按照TRIzol试剂说明书提取总RNA,逆转录合成cDNA,步骤同逆转录试剂盒。取cDNA,以SYBR进行定量PCR,β-actin作为内参照,分析APPL1的表达量。设置PCR条件为:95 ℃反应30 s,95 ℃反应3 s;60 ℃反应30 s,40个循环。引物由上海生工合成,APPL1的上游引物序列为5’-CAGGGTGGAAATTTAATGAG-3’,下游引物序列为 5’-AGGTGATCTGAAAACAATATC-3’。β-actin 的上游引物序列为 5’-GCAGGAGTA2CGAT-GAGTC-3’,下游引物序列为 5’-ACGCAGCTCAGTAACAGT-3’。
2.1.2Western blot 取control和LPS组的心肌细胞,在心肌细胞中添加全蛋白提取液,每5×106个细胞中添加500μL的提取液,在4 ℃震荡30 s后,离心,吸取上清(全蛋白液)。用BCA法对蛋白定量。在蛋白样品中以1∶4的体积比添加SDS-PAGE上样缓冲液,100 ℃煮沸5 min。以12%的分离胶、5%的浓缩胶进行电泳,每孔按照40 μg蛋白样品上样,上样后用80 V的恒压电泳45 min后,再以120 V的电压电泳1.5 h后结束电泳。根据凝胶大小裁剪PVDF膜,在200 mA恒流条件下转膜45 min。把PVDF膜取出后,在5%的牛血清白蛋白中孵育1.5 h后,置于1∶400稀释的APPL1抗体中,置于4 ℃的冷室中孵育过夜。再将PVDF膜放在1∶2 000稀释的Ⅱ抗孵育液中,在室温结合1.5 h。ECL发光,用Konda In-Vivo Imagine System F采集图像,β-acitn作为内参照,用ImageJ软件分析条带的灰度值。
2.2细胞转染和分组 心肌细胞培养密度为40%时,把培养液上清吸弃,分别添加APPL1重组慢病毒载体和阴性对照慢病毒载体,同时加入转染增强剂Polybrene,继续培养12 h以后,把病毒液吸弃,添加新鲜培养液,继续培养3 d以后,用1 mg/L的嘌呤霉素筛选4 d。把稳定转染APPL1重组慢病毒载体和阴性对照慢病毒载体的心肌细胞经含有1 mg/L LPS的细胞培养液培养后记为Lv-APPL1和Lv-NC。Control和LPS组处理方法同2.1。用RT-qPCR和Western blot检测LPS、Lv-NC和Lv-APPL1组细胞培养24 h后细胞中APPL1的表达变化。
2.3MTT检测细胞活力 取control、LPS、Lv-NC和Lv-APPL1组细胞按照上述各组的分组,分别接种到96孔培养板内,培养24 h后,在每个孔内添加5 g/L的MTT溶液,置于37 ℃孵育4 h,把上清溶液吸弃以后,加入100 μL的DMSO溶液,震荡反应10 min,紫色结晶溶解以后,测定570 nm的A值(以空白孔调零)。相对活力(%)=实验组A÷对照组A×100%
2.4流式细胞术检测细胞凋亡 取control、LPS、Lv-NC和Lv-APPL1细胞按照上述各组的分组,培养24 h后,用胰蛋白酶消化后,配制成单细胞悬浮液,收集106个细胞,以300 μL的结合缓冲液悬浮以后,添加PI和Annexin V-FITC染液,继续加入200 μL的结合缓冲液,流式细胞仪检测凋亡变化。同时用Western blot方法检测细胞中cleaved caspase-3蛋白水平,步骤同上。
2.5LDH和MDA水平检测 取control、LPS、Lv-NC和Lv-APPL1细胞按照上述各组的分组,培养24 h后,收集培养液上清及细胞,用硫代巴比妥酸法检测细胞中MDA含量,用2,4-二硝基苯肼显色法检测培养液中LDH水平,步骤参照试剂盒标准流程。
2.6SOD和GSH-Px活性检测 取control、LPS、Lv-NC和Lv-APPL1细胞按照上述各组的分组,培养24 h后,以胰蛋白酶消化后,反复冻融法将细胞裂解以后,用黄嘌呤氧化酶法检测细胞中SOD活性,5,5’-二硫代双(2-硝基苯甲酸)比色法测定细胞中GSH-Px活性,步骤均同试剂盒标准操作流程。
2.7流式细胞术检测细胞中ROS水平 取control、LPS、Lv-NC和Lv-APPL1细胞按照上述各组的分组,培养24 h后,用4 ℃预冷的PBS将细胞洗涤3次以后,添加0.25%的胰蛋白酶消化后,收集细胞,添加10 μmol/L的DCFH-DA染液500 μL,置于37 ℃孵育30 min后,离心弃上清,用冰预冷的PBS洗涤以后,配制成1×108/L的悬浮液,激发波长为488 nm,发射波长为530 nm,用流式细胞仪检测荧光强度,以荧光强度表示ROS水平。
3 统计学分析
实验数据均经过SPSS 21.0软件统计分析,计量资料按照均数±标准差(mean±SD)表示,两组数据间比较用t检验,多组差异比较用单因素方差,组间比较用SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 LPS降低心肌细胞中APPL1表达水平
心肌细胞经过LPS处理以后,细胞中的APPL1 mRNA和蛋白水平均显著降低(P<0.05),LPS抑制心肌细胞中APPL1的表达,见图1、表1。

Figure 1. Western blot was used to detect the expression level of APPL1 in LPS-induced cardiomyocytes.
图1 Western blot检测APPL1在LPS诱导的心肌细胞中的表达水平
表1 LPS处理后心肌细胞中APPL1表达水平
Table 1. Expression of APPL1 in cardiac myocytes after LPS treatment (Mean±SD.n=3)

GroupAPPL1 mRNAAPPL1 proteinControl1.000.46±0.05LPS0.65±0.08∗0.21±0.03∗
*P<0.05vscontrol group.
2 APPL1重组慢病毒提高LPS条件下心肌细胞中APPL1表达水平
APPL1重组慢病毒转染后的心肌细胞经过LPS处理后,细胞中的APPL1 mRNA和蛋白水平均显著升高(P<0.05),见图2、表2。

Figure 2. Western blot was used to detect the effect of lentiviral overexpression of APPL1 on the expression of APPL1 in cardiac myocytes under LPS condition.
图2 Western blot检测过表达APPL1慢病毒对LPS条件下心肌细胞中APPL1表达影响
表2 过表达APPL1慢病毒感染后经LPS处理后的心肌细胞中APPL1表达水平
Table 2. APPL1 expression level in cardiomyocytes treated with LPS after APPL1 overexpression lentivirus infection(Mean±SD.n=3)

GroupAPPL1 mRNAAPPL1 proteinLPS1.000.25±0.03Lv-NC1.04±0.090.24±0.06Lv-APPL12.54±0.18∗0.39±0.04∗
*P<0.05vsLPS group.
3 过表达APPL1提高LPS条件下心肌细胞活力并诱导心肌细胞凋亡
LPS处理后的心肌细胞活力降低,细胞凋亡率及细胞中cleaved caspase-3蛋白水平升高(P<0.05)。过表达APPL1后的心肌细胞经LPS处理后,细胞活力升高,细胞凋亡率及细胞中cleaved caspase-3蛋白水平降低(P<0.05),见图3、表3。

Figure 3. Overexpression of APPL1 reduced LPS-induced cardiomyocyte apoptosis. A: flow cytometry was used to detect the effect of overexpression of APPL1 on LPS-induced cardiomyocyte apoptosis; B: effect of overexpression of APPL1 on the level of apoptotic protein cleaved caspase-3 in LPS-induced cardiomyocytes detected by Western blot.
图3 过表达APPL1减少LPS诱导的心肌细胞凋亡
4 过表达APPL1减轻LPS条件下心肌细胞氧化损伤
LPS处理后的心肌细胞培养液中LDH活性升高,同时细胞中MDA含量也升高。过表达APPL1后的心肌细胞经LPS处理后,细胞培养液中LDH活性降低,细胞中MDA水平也降低(P<0.05),见表4。
5 过表达APPL1提高LPS条件下心肌细胞中抗氧化酶活性并降低细胞中ROS水平
LPS处理后的心肌细胞中SOD和GSH-Px活性降低,细胞中ROS水平升高。过表达APPL1后的心肌细胞经LPS处理后,细胞中SOD和GSH-Px活性升高,细胞中ROS水平降低(P<0.05),见表5。
表3 过表达APPL1的心肌细胞经LPS处理后细胞活力、凋亡率及细胞中cleaved caspase-3蛋白水平
Table 3. Cell viability, apoptosis rate and cleaved caspase-3 protein level of cardiomyocytes with APPL1 overexpression after LPS treatment (Mean±SD.n=3)
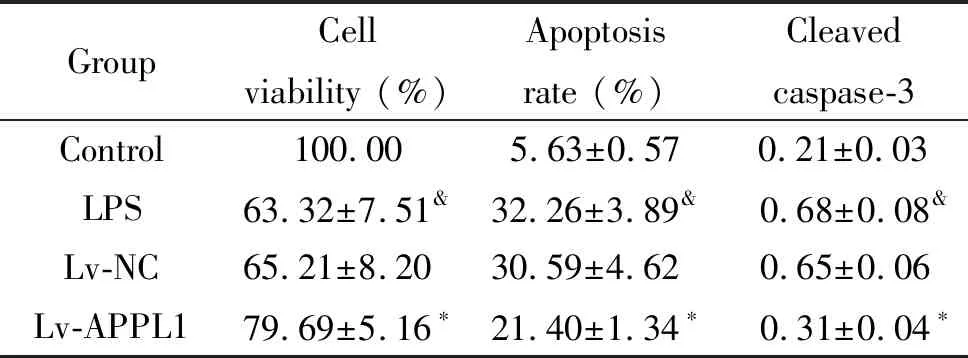
GroupCell viability (%)Apoptosis rate (%)Cleaved caspase-3Control100.005.63±0.570.21±0.03LPS63.32±7.51&32.26±3.89&0.68±0.08&Lv-NC65.21±8.2030.59±4.620.65±0.06Lv-APPL179.69±5.16∗21.40±1.34∗0.31±0.04∗
*P<0.05vsLPS and Lv-NC group;&P<0.05vscontrol group.
表4 过表达APPL1的心肌细胞经LPS处理后细胞中MDA含量及培养液中LDH活性
Table 4. The content of MDA and the activity of LDH in the culture medium of APPL1-overexpressing cardiomyocytes after LPS treatment (Mean±SD.n=3)
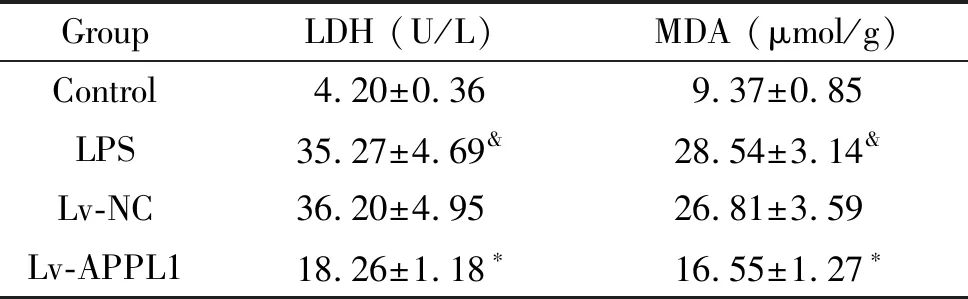
GroupLDH (U/L)MDA (μmol/g)Control4.20±0.369.37±0.85LPS35.27±4.69&28.54±3.14&Lv-NC36.20±4.9526.81±3.59Lv-APPL118.26±1.18∗16.55±1.27∗
*P<0.05vsLPS and Lv-NC group;&P<0.05vscontrol group.
表5 过表达APPL1的心肌细胞经LPS处理后细胞中ROS含量及SOD和GSH-Px活性
Table 5. ROS content and SOD and GSH-Px activity in cardiomyocytes with APPL1 overexpression after LPS treatment (Mean±SD.n=3)
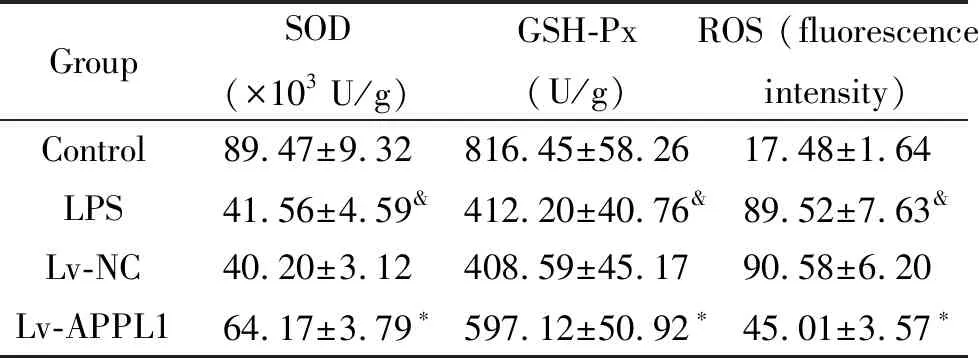
GroupSOD (×103 U/g)GSH-Px (U/g)ROS (fluorescence intensity)Control89.47±9.32816.45±58.2617.48±1.64LPS41.56±4.59&412.20±40.76&89.52±7.63&Lv-NC40.20±3.12408.59±45.1790.58±6.20Lv-APPL164.17±3.79∗597.12±50.92∗45.01±3.57∗
*P<0.05vsLPS and Lv-NC group;&P<0.05vscontrol group.
讨 论
LPS是感染性内毒素血症心力衰竭发生的重要原因,LPS存在于革兰氏阴性菌细胞壁外膜上,是革兰氏阴性菌致病发生的因素[8]。LPS能够诱导心肌损伤,促进心肌细胞氧化损伤,诱导心肌细胞凋亡[9]。本实验结果显示,LPS处理后的心肌细胞活力降低,细胞凋亡率升高,同时细胞中凋亡标志蛋白活化的caspase-3水平升高,细胞中ROS水平也升高,说明成功构建了LPS心肌细胞损伤模型。
APPL1蛋白没有跨膜区且具有高亲水性,含有3个功能结构域,参与转录抑制、小GTP酶结合、信号转导通路蛋白质结合、增加BAR与GTP酶的结合和BAR结构域脂质特异性发挥过程[10-14]。APPL1在骨骼肌、肾脏等多种组织中均可表达,参与胰岛素信号转导、神经元存活和神经突起形成等过程[15-16]。近年研究显示,APPL1具有抗心肌细胞凋亡作用,在心肌缺氧复氧损伤中发挥保护作用,沉默APPL1基因可以逆转球状脂联素对心肌纤维化的抑制作用,另外,APPL1还参与心力衰竭和糖尿病心肌病损伤过程[6, 7, 17-18]。本实验结果显示,LPS降低心肌细胞中APPL1的表达,过表达APPL1可以抑制LPS对心肌细胞凋亡促进和活力抑制作用,这说明APPL1能够减轻LPS诱导的心肌细胞损伤,这与上述研究报道结果类似。
心肌细胞氧化损伤存在于多种原因诱导的心肌损伤中,例如:糖尿病心肌病、心肌肥大、动脉粥样硬化和脓毒症心肌损伤等[19-20]。氧自由基能够被机体内的抗氧化酶降解,从而使机体内氧自由基处于动态平衡状态[21]。SOD和GSH-Px是存在于人体组织中的抗氧化酶,二者活性降低后是细胞氧化损伤发生的标志[22]。细胞内过量的氧自由基可以引起存在于细胞膜上的脂质发生过氧化,导致细胞膜的完整性受到破坏,使存在于细胞内的LDH释放至细胞外,而MDA是脂质过氧化的产物。另外,细胞内过量的ROS可以诱导细胞内caspase凋亡反应激活,促进下游凋亡执行因子caspase-3的活化,最终诱导细胞凋亡发生[23-24]。本实验表明,过表达APPL1后的心肌细胞中ROS水平降低,细胞中SOD和GSH-Px活性升高,细胞生成的MDA水平也降低,细胞培养培养液中LDH水平降低,细胞中活化的caspase-3蛋白水平降低,说明过表达APPL1可以减轻LPS诱导的心肌细胞氧化损伤,提高心肌细胞中抗氧化酶活性,减少细胞凋亡,表明APPL1可能通过减少LPS诱导的心肌细胞氧化损伤而发挥抗心肌细胞凋亡的作用,APPL1在心肌组织损伤中可能发挥保护作用。
综上所述,APPL1参与LPS诱导的心肌细胞损伤发生,过表达APPL1可以减少LPS诱导的心肌细胞氧化损伤和凋亡,这对于研究APPL1在心血管系统疾病中的作用具有意义,为研究感染诱导的心肌损伤发生机制提供了参考。另外,本次实验研究没有在原代心肌细胞和体内进行验证,对于其具体的靶向作用机制仍不清楚,在以后的实验中会对上述部分内容进行探讨。

