细胞焦亡参与脑缺血再灌注损伤的初步研究*
佘 颜, 胡雨琴, 张 荆, 蒿玉兴, 蔡 媛, 张蝈蝈, 王睿智, 邓常清△, 刘新春
(1湖南中医药大学血管生物学实验室, 湖南 长沙 410208; 2湖南中医药高等专科学校附属第一医院, 湖南 株洲 412000)
脑缺血再灌注损伤的病理生理机制是一系列复杂的神经损伤级联反应,神经细胞的死亡贯穿整个损伤过程。细胞焦亡是近年来发现并证实的一种典型依赖于炎症反应的程序性细胞死亡方式。经典焦亡途径依赖于caspase-1激活后诱导的炎症反应,内源性和外源性刺激信号通过不同途径作用于炎症小体而激活caspase-1,介导细胞渗透性肿胀破裂,形成膜孔,胞内物质(如乳酸脱氢酶等)流出,白细胞介素1β(interleukin-1β,IL-1β)和IL-18前体裂解并诱导其它炎症因子、黏附分子等的合成和释放,放大局部和全身炎症反应,诱导细胞焦亡的发生[1-3]。炎症小体的活化是细胞焦亡调控的经典途径,是细胞焦亡调控的核心环节,核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)炎症小体是通过caspase-1与含CARD 结构域的凋亡相关颗粒样蛋白(apoptosis-associated speck-like protein containing CARD,ASC)等相互作用而构成的蛋白复合体,可诱导细胞焦亡的发生[4-5]。NLRP3炎症小体同样作为脑缺血后中枢神经系统无菌性炎症反应的始动因子,在中枢神经系统中诱导细胞焦亡和炎症反应,导致神经细胞的损伤,在中枢神经系统细胞焦亡中发挥关键作用[6-7]。在脑缺血再灌注中,细胞焦亡及其调控机制与神经系统损伤有何种关系还不清楚,因此,本文研究脑缺血再灌注后不同时间点海马和皮质区细胞焦亡的变化特点,以进一步明确神经细胞焦亡在脑缺血再灌注损伤发生发展中的意义。
材 料 和 方 法
1 动物
SPF级雄性SD大鼠80只,体重240~260 g,由湖南维通利华实验动物有限公司提供,动物合格证号为SCXK(湘)2009-0004。 饲养于SPF级动物实验室,湿度 45%、室温25 ℃。动物实验经湖南中医药大学伦理委员会批准。
2 主要试剂和仪器
兔抗鼠cleaved caspase-1、IL-1β和NLRP3多克隆抗体及Alexa Fluor 594标记的山羊抗兔IgG购自Proteintech;兔抗鼠pro-caspase-1单克隆抗体购自Abcam;兔抗鼠β-actin单克隆抗体购自北京中杉金桥;TUNEL荧光试剂盒购自凯基生物;辣根过氧化物酶标记的山羊抗小鼠IgG和HRP标记的山羊抗兔IgG购自北京中杉金桥;TTC购自Sigma。CM185恒冷箱冰冻切片机购自Leica;荧光显微镜购自Carl Zeiss; ChemiDoc XRS 高灵敏度化学发光成像系统购自Bio-Rad。
3 方法
3.1动物分组及造模 参照Longa等[8]报道的方法进行改良建立右侧大脑中动脉阻塞局灶性脑缺血再灌注(middle cerebral artery occlusion and reperfusion,MCAO/R)模型。脑缺血2 h后拨出线栓恢复血流实现再灌注。分别在脑缺血再灌注后的3个时点(6 h、12 h和24 h)麻醉处死动物检测。假手术组仅手术分离颈总动脉,不放线栓。
将80只大鼠随机分成假手术组(sham组)和模型组(MCAO/R组),模型组按脑缺血再灌注后不同时间再分成脑缺血再灌注6 h组(MCAO/R 6 h组)、脑缺血再灌注12 h组(MCAO/R12 h组)和脑缺血再灌注24 h组(MCAO/R 24 h组),每组各20只。
3.2神经功能评分 根据 Longa 5级4分法对各个时点大鼠进行神经功能评分,模型纳入标准为神经功能评分1~3分,模型剔除标准为神经功能评分为0分或4分。
3.3脑梗死体积的测定 采用TTC染色法测定。大鼠处死后取完整脑组织,去除小脑和脑干,将脑组织置于冰生理盐水中置-20 ℃冷冻20 min,取出后放入专用脑槽切片模具中,按2 mm的厚度沿冠状位切片,将脑组织切片放入2% TTC液中,37 ℃温育15 min,使脑片均匀染色。染色后取出脑片浸入4%多聚甲醛中固定过夜,固定好的脑片取出晾干按顺序拍照。Image-Pro Plus 6.0图像分析软件测定各脑片的缺血区(呈白色)面积,并根据脑片厚度计算缺血区体积。
3.4脑组织病理形态观察 采用HE染色观察海马及皮质区形态特征。将脑组织置于4%多聚甲醛中固定48 h,在全自动脱水机上进行组织脱水,石蜡包埋。连续切取5 μm厚冠状切片,梯度乙醇脱水, 二甲苯透明后封片观察。在显微镜下观察海马及皮质区神经细胞形态,以判断神经细胞损伤程度。
3.5神经细胞焦亡的测定 采用caspase-1和TUNEL免疫荧光双染法检测大鼠海马及皮质区神经细胞焦亡。大鼠先用生理盐水灌注,待肝脏颜色变浅后,经心脏灌注4%多聚甲醛磷酸缓冲液250 mL固定,取脑组织作冰冻切片,按顺序滴加50 μL TdT酶反应液(45 μL equilibration buffer加1.0 μL biotin-11-dUTP和 4.0 μL TdT enzyme)和streptavidin-FITC标记工作液,孵育 I 抗(cleaved caspase-1:1∶50),4 ℃过夜,孵育 II 抗(抗兔-IgG标记荧光抗体:1∶100),DAPI工作液37 ℃染核,暗室中甘油封片。荧光显微镜下取海马及皮质区观察拍照。Cleaved caspase-1荧光呈红色,胞浆和胞核均有表达;TUNEL的荧光呈绿色, 在胞核中表达;蓝色荧光为同视野下的细胞核。选取海马CA1区及皮质区同一部位,计数细胞共表达率(3色重叠细胞/蓝色荧光细胞)作为阳性细胞,计算细胞焦亡阳性细胞率。
3.6NLRP3、cleaved caspase-1、pro-caspase-1和IL-1β蛋白表达的测定 采用Western blot检测海马及皮质区 NLRP3、cleaved caspase-1、pro-caspase-1和IL-1β蛋白表达。分别分离海马及皮质区,加蛋白裂解液提取脑组织总蛋白,BCA法测定蛋白浓度。取50 μg蛋白样品煮沸变性,行SDS-PAGE,转膜,5%的脱脂奶粉 37 ℃ 封闭 1 h。加入稀释的 I 抗(NLRP3:1∶300;cleaved caspase-1:1∶500; pro-caspase-1:1∶100和IL-1β:1∶200)及抗β-actin的I 抗(1∶100),4 ℃孵育过夜。次日用 TBST漂洗膜 3次,将膜放入已用封闭液稀释的 II 抗中,室温孵育1 h 。洗涤后ECL显影,凝胶成像仪照相,QuantityOne软件测定各目的条带的吸光度(IA值),分别以NLRP3、cleaved caspase-1、pro-caspase-1、IL-1β的IA与 β-actin的IA的比值对目的蛋白的表达进行相对定量。
4 统计学分析
采用 SPSS 24.0统计软件进行统计学处理。所有数据均用均数±标准差(mean±SD)表示。各组计量资料比较采用单因素方差分析,组间两两比较采用 SNK-q检验。以P<0.05为差异有统计学意义。
结 果
1 脑缺血再灌注后不同时点脑梗死体积的变化
假手术组未见白色的梗死灶。脑缺血再灌注后大脑皮质出现梗死区,MCAO/R 6 h组、12 h组和24 h组的梗死体积显著大于假手术组(P<0.05),且随着再灌注时间的增加,梗死体积进一步增加,与MCAO/R 6 h组比较,MCAO/R 12 h组和24 h组的脑梗死体积显著增大(P<0.05),见图1。
2 脑缺血再灌注后不同时点海马CA1区和皮质区神经细胞病理形态学的变化
HE染色显示,假手术组大鼠海马区及皮质区神经细胞呈圆形或锥体形,排列整齐致密,胞核饱满,核仁明显,边界清晰;脑缺血再灌注后,脑组织结构疏松,间质水肿,神经细胞肿胀,排列紊乱,细胞核固缩,碎裂,神经细胞数量明显减少,呈细胞死亡的典型特征,尤其在MCAO/R 12 h组和24 h组变化显著,见图2。
3 脑缺血再灌注后不同时点海马CA1区和皮质区神经细胞焦亡的变化
以cleaved caspase-1(呈红色)和TUNEL(呈绿色)的共表达计数细胞共表达率(3色重叠细胞/蓝色荧光细胞)反映细胞焦亡。假手术组可见少量的共表达焦亡细胞。脑缺血再灌注后,海马CA1区和皮质区焦亡细胞显著多于假手术组(P<0.05)。随着再灌注时间的延长,焦亡细胞率增加,其中,在海马CA1区和皮质区,MCAO/R 12 h组和MCAO/R 24 h组的焦亡细胞率大于MCAO/R 6 h组(P<0.05),见图3。
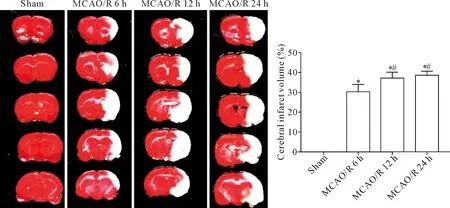
Figure 1. The changes of cerebral infarction volumes at different time points after cerebral ischemia reperfusion. Mean±SD.n=5.*P<0.05vssham group;#P<0.05vsMCAO/R 6 h group.
图1 脑缺血再灌注后不同时点脑梗死体积的变化
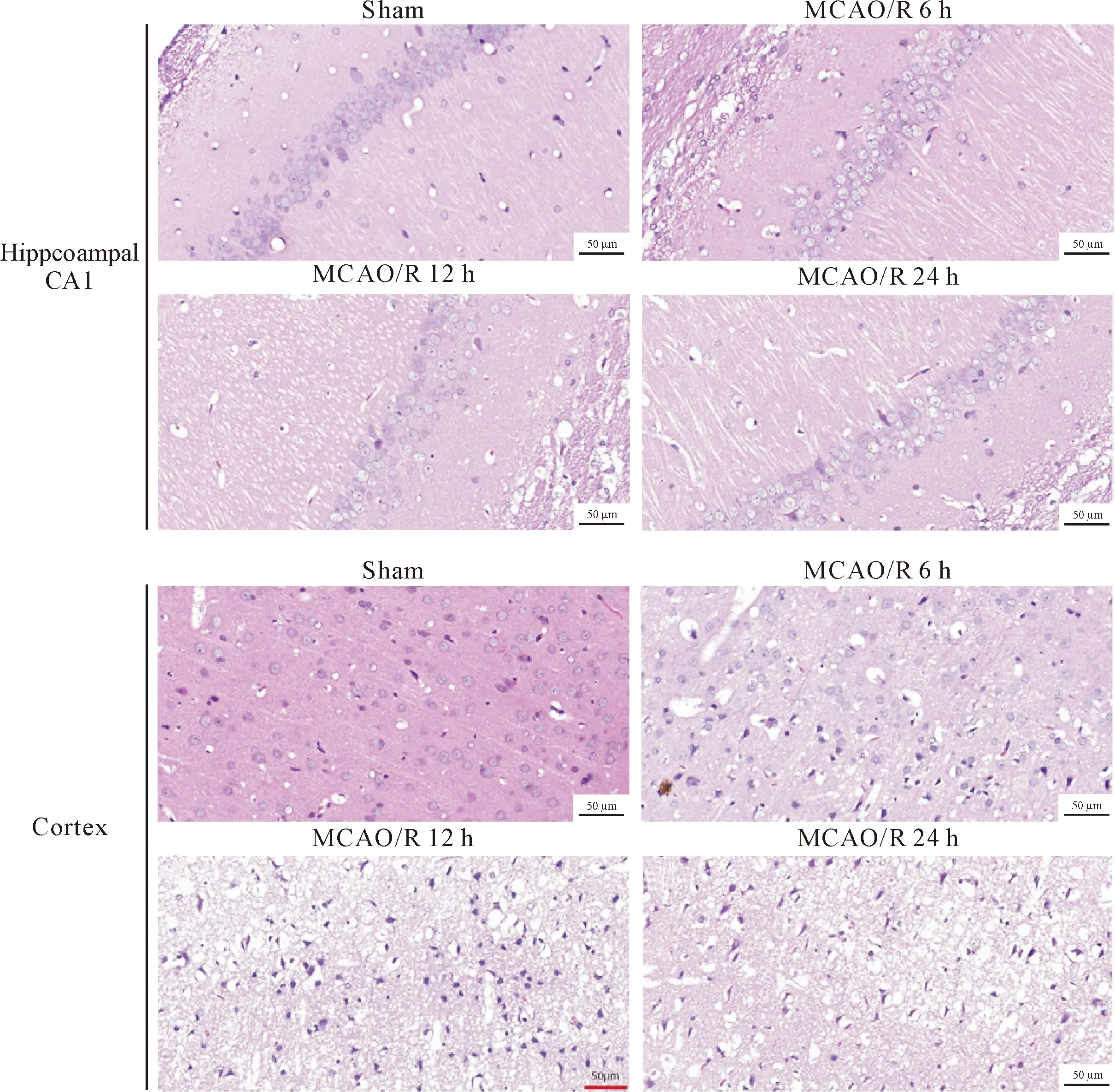
Figure 2. The pathomorphological changes of the hippocampal CA1 and cortical neurons at different time points after cerebral ischemia reperfusion.
图2 脑缺血再灌注后不同时点海马CA1区和皮质区神经细胞的病理形态学变化
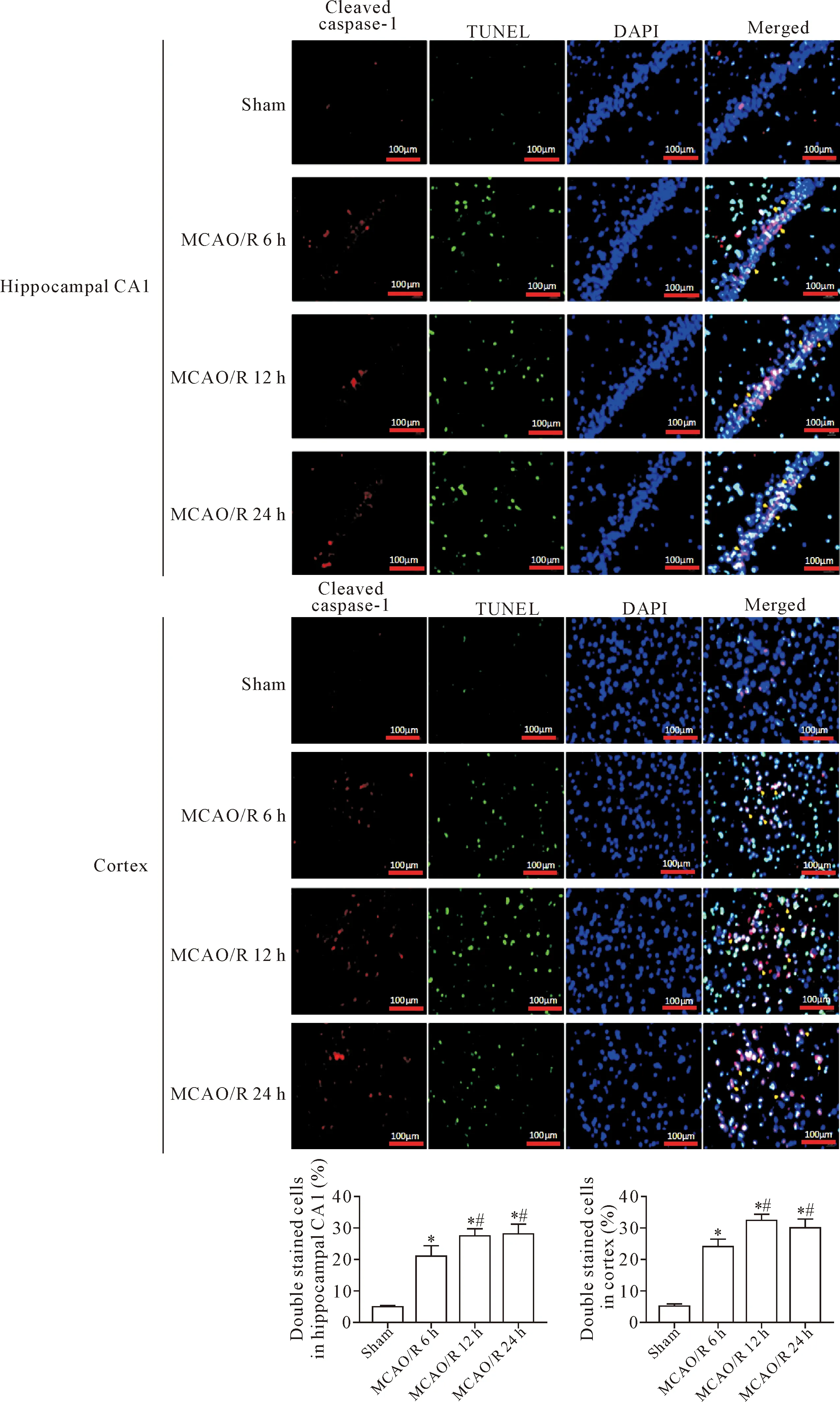
Figure 3. The pyroptosis of the hippocampal CA1 and cortical neurons at different time points after cerebral ischemia reperfusion. Mean±SD.n=5.*P<0.05vssham group;#P<0.05vsMCAO/R 6 h group.
图3 脑缺血再灌注后不同时点海马CA1区和皮质区神经细胞焦亡的比较
4 脑缺血再灌注后不同时点海马和皮质区NLRP3、pro-caspase-1、cleaved caspase-1及IL-1β蛋白表达的变化
脑缺血再灌注后,脑组织NLRP3蛋白表达显著高于假手术组。在海马区,随着再灌注时间的延长,NLRP3蛋白表达不断增加,MCAO/R 24 h组的表达水平最高,MCAO/R 12 h组和MCAO/R 24 h组的NLRP3蛋白表达显著高于MCAO/R 6 h组(P<0.05);在皮质区,模型组各时点的NLRP3蛋白表达显著高于假手术组(P<0.05),以MCAO/R 6 h组的表达水平最高,随后NLRP3蛋白表达缓慢下降,见图4。
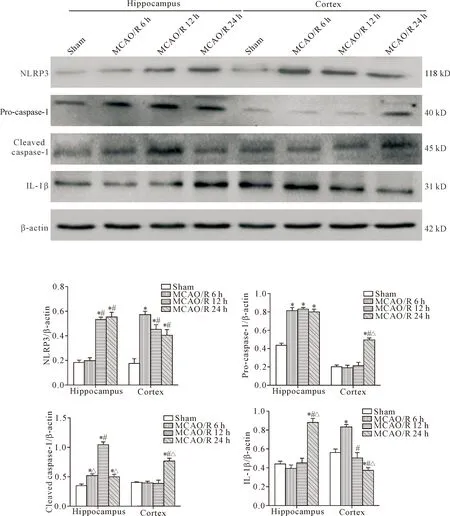
Figure 4. The protein expression of NLRP3, pro-caspase-1, cleaved caspase-1 and IL-1β in the hippocampus CA1 and cortical areas at different time points after cerebral ischemia reperfusion. Mean±SD.n=5.*P<0.05vssham group;#P<0.05vsMCAO/R 6 h group;△P<0.05vsMCAO/R 12 h group.
图4 脑缺血再灌注后不同时点海马CA1区和皮质区NLRP3、pro-caspase-1、cleaved caspase-1及IL-1β蛋白表达的比较
脑缺血再灌注后,脑组织pro-caspase-1的蛋白表达显著增加。在海马区,模型组各时点的pro-caspase-1蛋白表达显著高于假手术组(P<0.05)。在皮质区,MCAO/R 6 h组和12 h组的pro-caspase-1蛋白表达无显著增加(P>0.05),而MCAO/R 24 h组的pro-caspase-1蛋白表达显著增高(P<0.05),见图4。
脑缺血再灌注后,脑组织的cleaved caspase-1蛋白表达显著增加。在海马区,模型组各时点cleaved caspase-1蛋白的表达增高(P<0.05),以MCAO/R 12 h组的增高最显著(P<0.05)。在皮质区,在皮质区,MCAO/R 6 h组和MCAO/R 12 h组的cleaved caspase-1蛋白表达无明显增高(P>0.05),而MCAO/R 24 h组的cleaved caspase-1蛋白表达明显增高(P<0.05),见图4。
脑缺血再灌注后,脑组织IL-1β蛋白表达显著增加。在海马区,MCAO/R 6 h组和12 h组的IL-1β蛋白表达无显著变化,而MCAO/R 24 h组的IL-1β蛋白表达水平显著增高(P<0.05)。在皮质区,MCAO/R 6 h组的IL-1β蛋白表达增高(P<0.05),随着再灌注时间延长,IL-1β蛋白表达逐渐下降,见图4。
讨 论
细胞焦亡是一种典型依赖于炎症的程序性细胞死亡方式,其经典焦亡途径依赖于caspase-1介导。当机体遭受有害刺激时,胞浆内炎症体的形成,使无活性的pro-caspase-1裂解形成有活性的cleaved caspase-1,cleaved caspase-1可以诱导细胞膜穿孔使细胞溶解、死亡,胞内物质外释引起炎症反应;同时促进白介素-1β和白介素-18等促炎症细胞因子的成熟分泌,导致细胞焦亡发生[9-10]。
研究表明,细胞焦亡现象广泛存在于炎症类疾病的发生发展中[11-13],其中caspase-1介导的经典焦亡途径在帕金森症、阿尔兹海默症、亨廷顿舞蹈症及神经炎伴退行性神经功能缺损等神经系统疾病的发生发展中发挥重要的作用[14-16]。Caspase-1的表达在缺血后神经元、星形胶质细胞以及小胶质细胞显著增加,阻断caspase-1的表达能减轻脑缺血后神经损伤[17]。Caspase-1的激活由一系列能形成炎症小体的模式识别受体触发,NLRP3作为固有免疫重要的模式识别受体参与了缺血后的炎症损伤,NLRP3炎症小体既能识别各类外源性病原体,又能感知自身内源性危险信号(如缺血再灌注损伤),衔接天然免疫与获得性免疫反应,是炎症级联反应的关键分子通路。Fann等[7]通过体内外研究均发现脑缺血缺氧后 NLRP3、ASC 及caspase-1等蛋白表达增加,NLRP3 炎症小体激活,IL-1β 和 IL-18 分泌增多,而caspase-1抑制剂可抑制神经元死亡,减轻缺血再灌注损伤。这些研究均证实经典细胞焦亡的相关调控因子参与了缺血性脑损伤,细胞焦亡可能是脑卒中干预的潜在靶点。然而,目前研究仍存在许多问题,如细胞焦亡的检测方法、细胞焦亡在脑缺血再灌注损伤过程中动态演变及分布特点仍需进一步明确。
脑组织中大脑皮质及海马区是对缺血缺氧损害敏感的区域。本文研究了脑缺血再灌注后不同时间细胞焦亡在海马及皮质区的变化特点,并从NLRP3介导的经典焦亡途径探究其机制。细胞焦亡在形态学上同时具有坏死和凋亡的特征。与细胞凋亡相似的是,发生焦亡的细胞同样会出现细胞核浓缩、染色质DNA断裂以及TUNEL染色阳性。细胞焦亡与细胞凋亡均属于细胞程序性死亡方式,但是焦亡并不由传统的凋亡分子caspase-3介导,而是由caspase-1介导。因此,本研究采用cleaved caspase-1和TUNEL免疫荧光双染检测细胞焦亡,同一细胞cleaved caspase-1染色和TUNEL染色双阳性可判断为细胞焦亡。焦亡检测结果表明:脑缺血再灌注后海马及皮质区均出现细胞焦亡现象,尤以MCAO/R 12 h和24 h最明显。这一作用与神经损伤的变化基本一致,证实了细胞焦亡参与了脑缺血再灌注后神经细胞损伤。NLRP3介导的经典焦亡途径相关蛋白检测结果表明,NLRP3和IL-1β蛋白表达在海马区和皮质区的变化趋势不同,随着再灌注时间延长,NLRP3和IL-1β蛋白表达在海马区逐渐上升,而在皮质区表达先升高再逐渐下降,推测经典焦亡途径激活部位的皮质区先于海马区。Pro-caspase-1和cleaved caspase-1蛋白表达在海马区3个时点均升高,以MCAO/R 12 h表达显著,而皮质区只在MCAO/R 24 h表达显著,说明脑缺血再灌注损伤后NLRP3/ caspase-1焦亡轴激活部位主要在海马区。本研究证实细胞焦亡参与了缺血性神经损伤,经典焦亡途径在海马和皮质区均发挥重要调控作用,皮质区对NLRP3/ caspase-1焦亡轴的激活最敏感,而海马区对NLRP3/ caspase-1焦亡轴的激活持续时间比皮质区长。提示海马区是脑缺血后神经细胞焦亡和炎症反应诱发的继发性神经损伤的主要部位,但以何种途径激活经典细胞焦亡参与脑缺血再灌注神经损伤仍需进一步探讨。

