FGFR2-IIIb D3胞外段抑制角质形成细胞的脂质合成*
谢 盈, 刘 鸽, 汪 炬
(暨南大学生物医药研究院, 广东 广州 510632)
角质形成细胞是人体皮肤表面脂质(包括脂肪酸和胆固醇)的主要来源[1-2]。脂质代谢非常复杂,涉及大量的蛋白酶和各种转录因子,并受到一系列相关信号通路的调控。过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptor, PPAR)、肝X受体(liver X receptor, LXR)和类视黄醇 X 受体(retinoid X receptor, RXR)3类核受体及固醇调节元件结合蛋白(sterol regulatory element binding protein, SREBP)介导的脂质代谢通路是研究脂质代谢调控机制的首要环节,其中SREBP是脂质代谢通路中的关键调控因子,调控外源脂质的摄入和内部脂质合成等过程[3]。SREBP-1c属于SREBP家族,是脂质代谢信号转导的关键调节因子[4]。SREBP-1c的靶基因主要有脂肪酸合成酶(fatty acid synthase,FAS)、乙酰辅酶A合成酶(acetyl-CoA synthase,ACS)、硬脂酰辅酶A脱饱和酶(stearoyl-CoA desaturase,SCD)和羟甲基戊二酰辅酶A还原酶(3-hydro-xy-3-methylglutaryl-CoA reductase,HMGCR),其启动子上均含有固醇调节元件(sterol regulatory element, SRE;即SREBP-1c结合区),活化后的SREBP-1c进入细胞核与其靶基因启动子上的SRE结合,激活脂质合成基因的翻译,从而控制脂质的合成。
成纤维细胞生长因子受体(fibroblast growth factor receptor, FGFR)的结构包括细胞外区域、跨膜区和细胞内区域3个部分,在氨基末端包含有3个免疫球蛋白(immunoglobulin,Ig)样结构域,分别被称作 D1环、D2环与D3环[5],其中FGFR1、FGFR2和FGFR3可通过选择性剪切得到2种亚型:FGFR-IIIb和FGFR-IIIc。FGF7的受体为FGFR2-IIIb,且FGF7是FGFs家族中唯一一个只与1种受体结合的[6]。FGFs主要在间质细胞中表达,通过旁分泌机制分泌到细胞外,与细胞膜表面特异性受体FGFRs结合,进而引起胞内相关信号通路的级联反应,在维持组织器官正常发育及稳定性方面起关键性调控作用[7]。目前FGF7对表皮脂质合成的调控机制尚不明确,由于脂质的异常分泌在炎症性皮肤病(如痤疮和银屑病等)的发生机制中起着关键作用,因此抑制皮肤组织中脂质合成途径可能具有治疗炎症性疾病的潜力。本研究选择人永生化角质形成细胞株HaCaT来展开研究,揭示了角质形成细胞中FGF7信号通路对脂质合成的调控机制,及FGFR2-IIIb D3胞外段对脂质合成的抑制作用。
材 料 和 方 法
1 主要试剂
FGFR2-IIIb D3胞外段是本课题组表达纯化;HaCaT细胞由本实验保存。DMEM培养基、胎牛血清和胰蛋白酶购自Gibco;生物素标记试剂盒和BCA蛋白定量试剂盒购自Thermo Scientific;RNA提取试剂盒购自Magen;反转录试剂盒购自TaKaRa;链霉亲和素-FITC和油红O购自Sigma;抗AKT、p-AKT和p-FGFR抗体及AKT抑制剂MK-2206购自CST;CCK-8购自DOJINDO;DAPI、PMSF和RIPA购自碧云天;抗SREBP-1抗体购自Abcam;抗FGFR2抗体购自Santa Cruz;HRP-羊抗兔IgG抗体和HRP-羊抗鼠IgG抗体购自联科生物。
2 主要方法
2.1等温滴定量热法(isothermal titration calorimetry, ITC)研究FGFR2-IIIb D3胞外段与FGF7的结合力 用Buffer B分别对FGFR2-IIIb D3胞外段和FGF7进行透析,测定质量浓度,并稀释至实验所需的摩尔浓度。取400 μL 浓度为500 μmol/L的FGFR2-IIIb D3胞外段加入到样品池中,参比池中加入同等体积的缓冲液作为对照。取50 μL浓度为5 μmol/L的FGF7及缓冲液于上样针中用于滴定,反应温度为25 ℃,每次滴加2 μL,2次滴加间隔时间设为120 s,共滴加20次。
2.2Real-time PCR检测 FGFR1、FGFR2-IIIc、FGFR2-IIIb、FGFR3、FGFR4、SREBP-1c、FAS、ACS、SCD和HMGCR的mRNA表达 使用RNA提取试剂盒抽提细胞总RNA,逆转录合成cDNA,以β-actin为内参照,进行real-time PCR检测。β-actin的正向引物序列为5’-ACGTGGACATCCGCAAAG-3’,反向引物序列为5’-GACTCGTCATACTCCTGCTTG-3’;FGFR1的正向引物序列为5’-CAAAAAGCTTGAAGACCTCACA-3’,反向引物序列为5’-CTGACACGGACTCATCAACAGT-3’;FGFR2-IIIb的正向引物序列为5’-TGGAGAATGAATACGGGTCC-3’,反向引物序列为5’-TCGGTCACAATTGAACAGAGC-3’;FGFR2-IIIc的正向引物序列为5’-GGATATCCTTTCACTCTGCATGGT-3’,反向引物序列为5’-TGGAGTAAATGGCTATCTCCAGGTA-3’;FGFR3的正向引物序列为5’-ATGGGCGCCCCTGCCTGC-3’,反向引物序列为5’-CGTCCGCGAGCCCCCACT-3’;FGFR4的正向引物序列为5’-CACCGTCAAGTTCCGCTGT-3’,反向引物序列为5’-ACCACGCTCTCCATCACGA-3’;SREBP-1c的正向引物序列为5’-GGAGCCATGGATTGCACTTT-3’,反向引物序列为5’-TCAAATAGGCCAGGGAAGTCA-3’;FAS的正向引物序列为5’-CAGGCACACACGATGGAC-3’,反向引物序列为5’-CGGAGTGAATCTGGGTTGAT-3’;ACS的正向引物序列为5’-CCCAGTTTATCCCAATGCTG-3’,反向引物序列为5’-GGGCGCCATAGAACTGATT-3’;SCD的正向引物序列为5’-CCGGGAGAATATCCTGGTTT-3’,反向引物序列为5’-GCGGTACTCACTGGCAGAGT-3’;HMGCR的正向引物序列为5’-TGGCTCTTTCAGAGAGGTCTCA-3’,反向引物序列为5’-TGCCTTCAGAGGTGAGCTGTA-3’。PCR条件为: 95 ℃ 5 s; 58 ℃ 5 s,72 ℃ 30 s,39个循环。循环延伸末端收集荧光信号,所得数据用2-ΔΔCt法进行分析计算。
2.3Western blot法检测FGF7、AKT抑制剂和FGFR2-IIIb D3胞外段对HaCaT细胞的FGFR2、p-FGFR、AKT和p-AKT表达的影响 选取生长良好且密度为80%~90%的HaCaT细胞进行铺板(6孔板)。细胞以每孔2×104个密度接种于6孔板中,37 ℃细胞培养箱内培养24 h,无血清培养基饥饿过夜。添加FGFR2-IIIb胞外段(33.3 μmol/L)和AKT抑制剂MK-2206(1 μmol/L),30 min后加入FGF7(10 μg/L)处理细胞2 h。取出细胞培养板,吸净板中培养基,用经4 ℃预冷的PBS洗涤细胞2次,吸净PBS,全程将细胞培养板置于冰上操作。每孔加入100 μL~150 μL的细胞裂解液(含1%蛋白酶抑制剂,可根据孔中细胞数量做适当调整),轻轻晃动培养板使细胞裂解液与细胞充分接触,冰上静置2 min。用细胞刮尽可能的将细胞全部刮下,将细胞裂解混合物转移至经预冷的EP管中,涡旋振荡数次,每次数秒,冰上孵育10 min使细胞在细胞裂解液的作用下充分裂解。10 min后4 ℃、13 400 r/min离心20 min。上清转至洁净且经提前预冷的EP管中,从中取7 μL 用于BCA测浓度,剩余蛋白加入适量5×loading buffer,混匀后沸水浴5 min,室温13 400 r/min离心5 min,即可进行SDS-PAGE分离蛋白,或保存于-20 ℃中。
2.4油红O染色检测FGF7、AKT抑制剂和FGFR2-IIIb D3胞外段对HaCaT细胞内脂质沉积的影响 选取生长良好且密度为80%~90%的HaCaT细胞进行铺板(共聚焦皿)。消化细胞,尽可能将细胞吹打为单细胞悬液。取20 μL左右细胞悬液于细胞计数板上计数,计数3遍,取平均值。HaCaT细胞每孔以1×104个密度接种于共聚焦皿中,37 ℃细胞培养箱培养加入FGFR2-IIIb胞外段(33.3 μmol/L)和AKT抑制剂MK-2206(1 μmol/L),30 min后加入FGF7(10 μg/L),孵育24 h。PBS清洗,4%中性甲醛固定30 min。蒸馏水清洗2 次,每次2 min。60%异丙醇浸洗10 s。油红O染料(0.5%油红O溶于异丙醇中,使用时用蒸馏水按 3∶2 稀释,定性滤纸过滤)室温避光孵育30 min。60%异丙醇浸洗2次,每次2 min。蒸馏水清洗2次,每次1 min。苏木素复染10 min(20×浓缩苏木素染液,使用时与蒸馏水按 1∶20 稀释)。自来水清洗2次,每次1 min。蒸馏水清洗2次,每次1 min。倒置显微镜观察并拍照。
2.5流式细胞术定量检测FGF7诱导角质形成细胞脂质的合成作用 选取生长良好且密度为80%~90%的HaCaT细胞进行铺板,饥饿12 h后给药,胰酶消化收集细胞。800 r/min离心6 min,吸弃上清,加入PBS缓冲液,重悬细胞,800 r/min离心6 min,重复PBS清洗步骤2次。1.5 mL的EP管中取10 μg尼罗红,用1 mL甲醇将其完全溶解,使其浓度为10 mg/L,4 ℃避光保存,2周内使用。加入990 μL PBS制成单细胞悬液,加入尼罗红染液10 μL,使终浓度为100 μg/L,室温孵育30 min短暂涡旋,300目尼龙膜过滤至流式检测专用试管中。激发波长485 nm,发射波长为565 nm,每个样本检测20 000个细胞,得到每个细胞的平均荧光强度。
3 统计学分析
采用SPSS统计软件对数据进行处理和分析,数据均采用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用最小显著性差异法(LSD法),以P<0.05表示差异有统计学意义。
结 果
1 FGFR2-IIIb D3胞外段的生物特性分析
1.1FGFR2-IIIb D3胞外段可与FGF7结合 利用等温滴定量热法检测FGFR2-IIIb D3胞外段与FGF7的相互作用力。以FGF7对缓冲液的相互作用力,缓冲液对FGF7的相互作用力,缓冲液对缓冲液的相互作用力为空白对照。FGFR2-IIIb D3胞外段与FGF7结合常数K=2.22×108L/mol,说明FGFR2-IIIb D3胞外段可与FGF7结合,见图1。

Figure 1. Isothermal titration calorimetry was used to analyze the interaction between FGFR2-IIIb D3 extracellular domain and FGF7. The horizontal coordinate of the above figure is time, and the vertical coordinate is thermal power. The peak area represents the total amount of heat released at each titration. The abscissa of the figure below is the molar ratio of protein, and the ordinate is the total heat generated by titration.
图1 等温滴定量热法检测FGFR2-IIIb D3胞外段与FGF7的相互作用力
1.2FGFR2-IIIb在HaCaT细胞中高表达 real-time PCR检测FGFR1、FGFR2-IIIc、FGFR2-IIIb、FGFR3和FGFR4的mRNA表达,结果显示,在HaCaT细胞中FGFR2-IIIb mRNA的表达明显高于其它FGFRs家族成员,FGFR2-IIIb mRNA的表达是FGFR2-IIIc mRNA的2.64倍(P<0.01),见图2。
1.3FGFR2-IIIb D3胞外段抑制HaCaT细胞活力 CCK-8检测FGFR2-IIIb D3胞外段对HaCaT细胞活力的影响,结果显示,FGF7可促进HaCaT细胞活力,与空白对照组对比差异显著(P<0.05);FGFR2-IIIb D3胞外段可下调FGF7上调的HaCaT细胞活力,随着FGFR2-IIIb D3胞外段浓度的增加,对HaCaT细胞活力的抑制作用也逐渐增强(P<0.01),且在33.3 μmol/L时抑制效果最好,抑制率达60%,见图3。
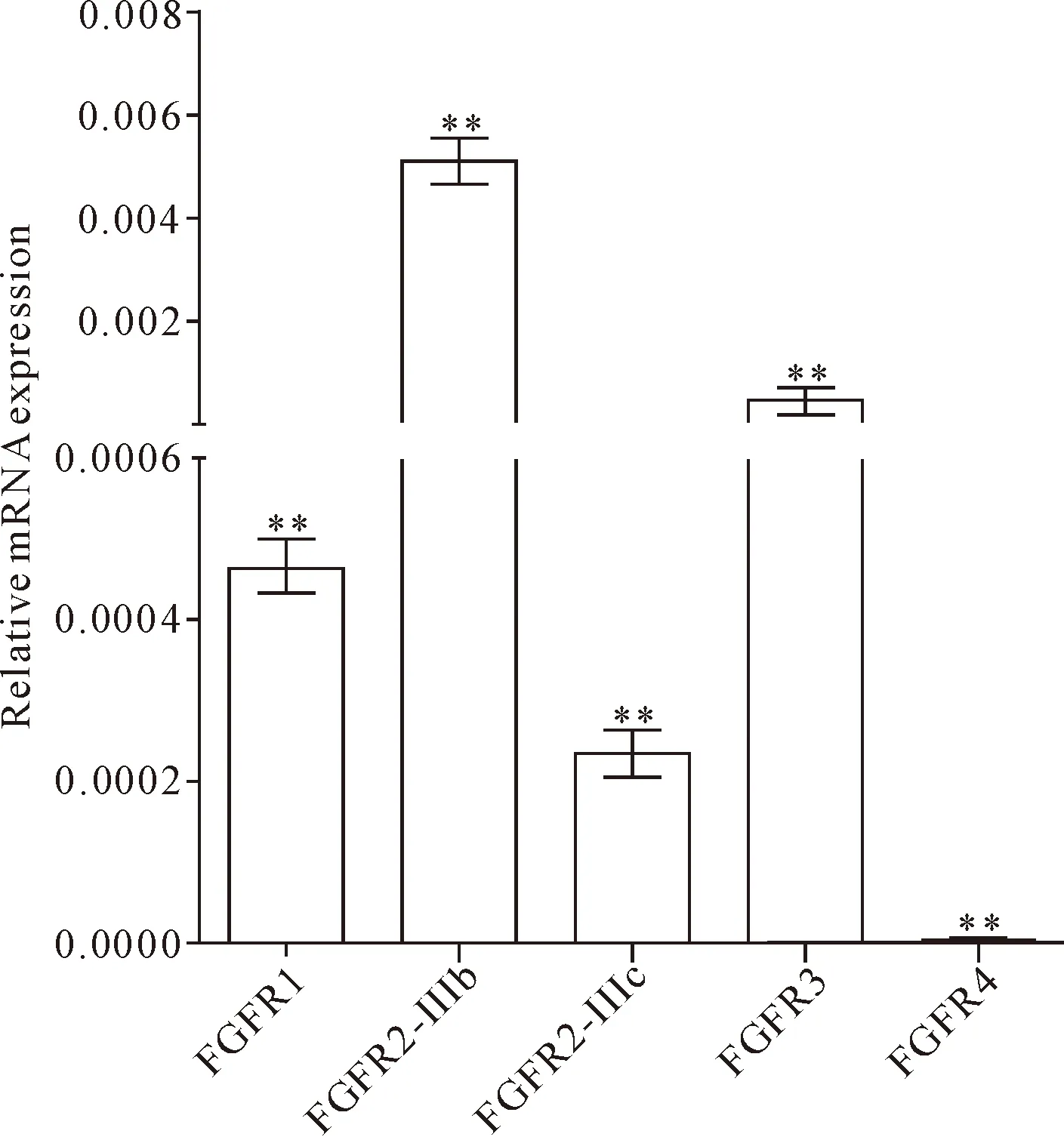
Figure 2. The mRNA expression of FGFRs in HaCaT cells was detected by real-time PCR. Mean±SD.n=3.**P<0.01vsFGFR2Ⅲb group.
图2 HaCaT细胞中FGFRs mRNA的表达
2 FGFR2-IIIb D3胞外段对脂质合成通路的抑制作用
2.1FGFR2-IIIb D3胞外段可抑制FGF7激活的SREBP-1c mRNA的表达 在HaCaT细胞中FGF7可显著上调SREBP-1c mRNA的表达,FGFR2-IIIb D3胞外段和AKT抑制剂MK-2206均可抑制其表达(P<0.05),见图4。这说明FGF7在HaCaT细胞中通过AKT信号调控皮肤脂质的合成。
2.2FGFR2-IIIb D3胞外段可抑制FGF7激活的脂质合成酶(FAS、ACS、SCD和HMGCR)mRNA的表达 在HaCaT细胞中FGF7可上调脂质合成酶(FAS、ACS、SCD和HMGCR)mRNA的表达,FGFR2-IIIb D3胞外段及AKT抑制剂可抑制其上调,且与FGF7组相比差异显著(P<0.01),见图5。这进一步说明,FGF7在HaCaT细胞中通过激活FGF受体以及下游AKT信号通路调控皮肤脂质合成。
2.3FGFR2-IIIb D3胞外段可下调FGF7激活的p-FGFR、p-AKT和SREBP-1的表达 FGF7可上调HaCaT细胞中p-FGFR、p-AKT及SREBP-1的表达,而FGFR2-IIIb D3胞外段和AKT抑制剂下调FGF7激活的p-FGFR、p-AKT、SREBP-1的表达(P<0.01),见图6。这说明FGF7通过激活FGFR2-IIIb信号通路中PI3K-AKT信号调控SREBP-1c的表达,调控下游脂质合成酶的表达,从而调控皮肤脂质的合成;FGFR2-IIIb D3胞外段通过与FGF7结合抑制FGFR2-IIIb信号的转导,进而抑制皮肤脂质的合成。
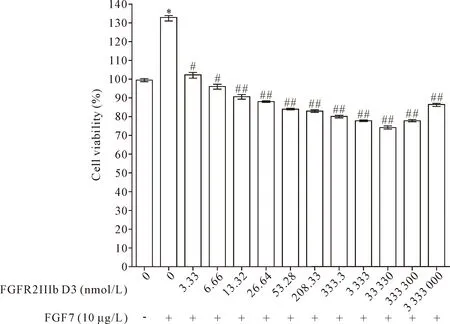
Figure 3. The effect of FGF7 and FGFR2-IIIb D3 extracellular domain on viability of HaCaT cells. The FGF7 and FGFR2-IIIb D3 extracellular segment groups were used as blank controls, and only FGF7 group was added as a positive control. The abscissa is the concentration of extracellular domain of FGFR2-IIIb D3, the ordinate indicates the percentage of cell proliferation. Mean±SD.n=3.**P<0.01vsblank control group;#P<0.05,##P<0.01vsFGF7 group.
图3 FGF7和FGFR2-IIIb D3胞外段对HaCaT细胞活力的影响
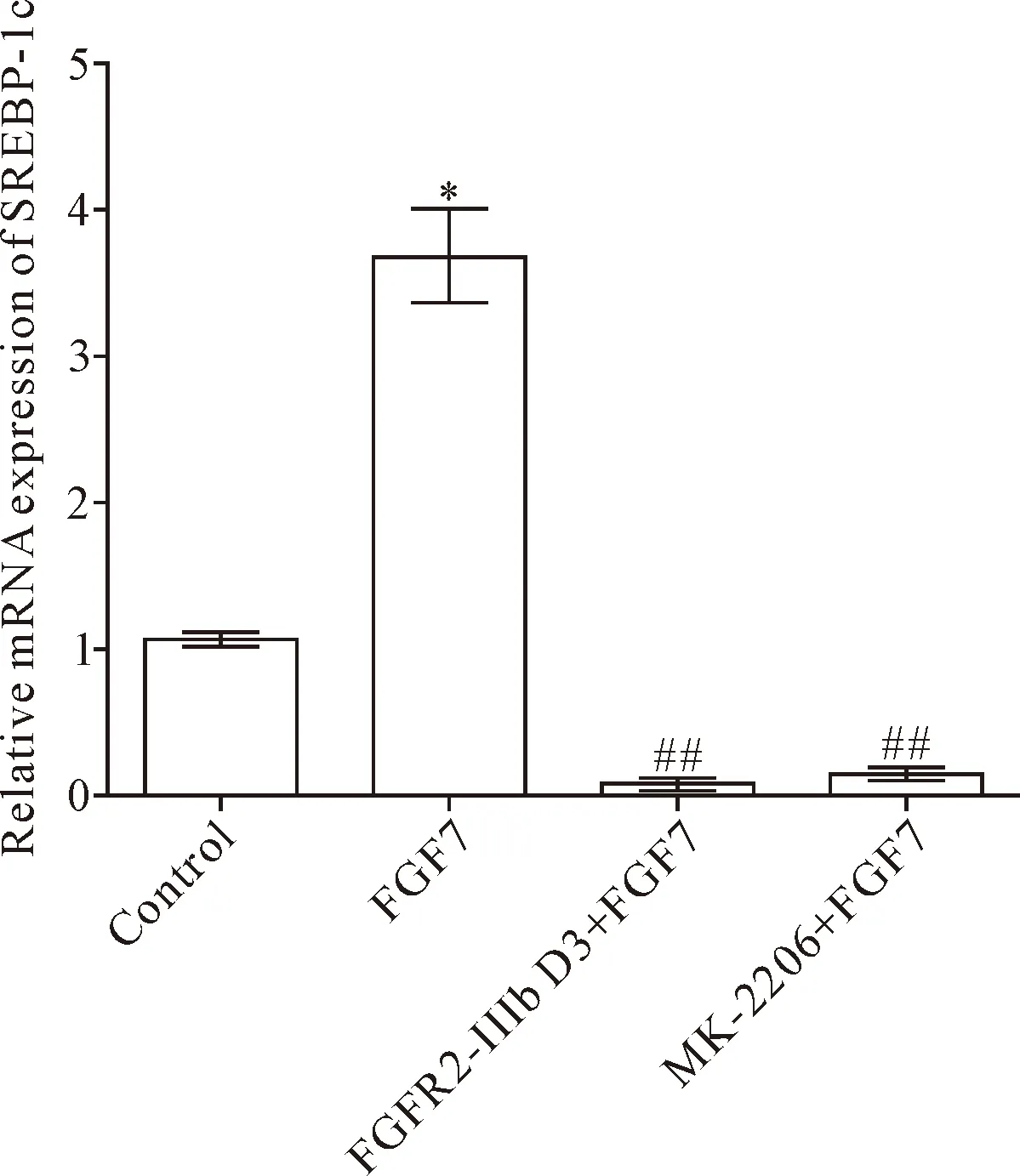
Figure 4. The mRNA expression of SREBP-1c in HaCaT cells treated with FGF7, FGFR2-IIIb D3 extracellular domain and AKT inhibitor MK-2206. Mean±SD.n=3.*P<0.05vscontrol group;##P<0.01vsFGF7 group.
图4 HaCaT细胞中SREBP-1c mRNA的表达
2.4FGFR2-IIIb D3胞外段可抑制FGF7激活的脂质合成 分别用油红O染色法和流式细胞术检测FGFR2-IIIb D3胞外段对角质形成细胞中脂质合成的影响。结果显示,FGF7诱导后HaCaT细胞的脂质含量明显上调,用FGFR2-IIIb D3胞外段和AKT抑制剂MK-2206处理后,脂质含量下调,见图7、8。这说明在HaCaT细胞中FGFR2-IIIb D3胞外段可通过AKT信号通路抑制FGF7上调的脂质合成,即FGF7可激活FGFR2-IIIb信号通路中PI3K-AKT信号进而调控皮肤脂质的表达。
讨 论
角质形成细胞是皮肤脂质合成的主要场所,因此我们选择HaCaT细胞(人永生化角质形成细胞)进行研究。本文通过real-time PCR、Western blot和油红O染色等实验方法研究FGF7对角质形成细胞中脂质合成的调控作用。Real-time PCR结果表明,FGF7可上调SREBP-1c mRNA及SREBP-1c下游脂质合成酶(FAS、ACS、SCD和HMGCR)mRNA的表达;Western blot结果表明,FGF7可上调p-FGFR、p-AKT和SREBP-1蛋白的表达;油红O染色和流式细胞术结果表明,FGF7可促进脂质的合成。同时,当加入AKT抑制剂MK-2206后,FGF7上调的SREBP-1c及其脂质合成酶的mRNA和蛋白水平均被抑制,脂质的合成也受到抑制。因此,FGF7可通过AKT调控皮肤脂质的合成,即FGF7通过与细胞膜上受体FGFR2-IIIb结合后激活FGFR2-IIIb信号通路中PI3K-AKT信号,调控SREBP-1c及其脂质合成酶的表达,进而调控皮肤脂质的合成。

Figure 5. The mRNA expression of lipid synthases (FAS, ACS, SCD and HMGCR) in HaCaT cells treated with FGF7 and FGFR2-IIIb D3 extracellular domain or AKT inhibitor MK-2206. Mean±SD.n=3.**P<0.01vscontrol group;##P<0.01vsFGF7 group.
图5 HaCaT细胞中脂质合成酶(FAS、ACS、SCD和HMGCR)mRNA的表达
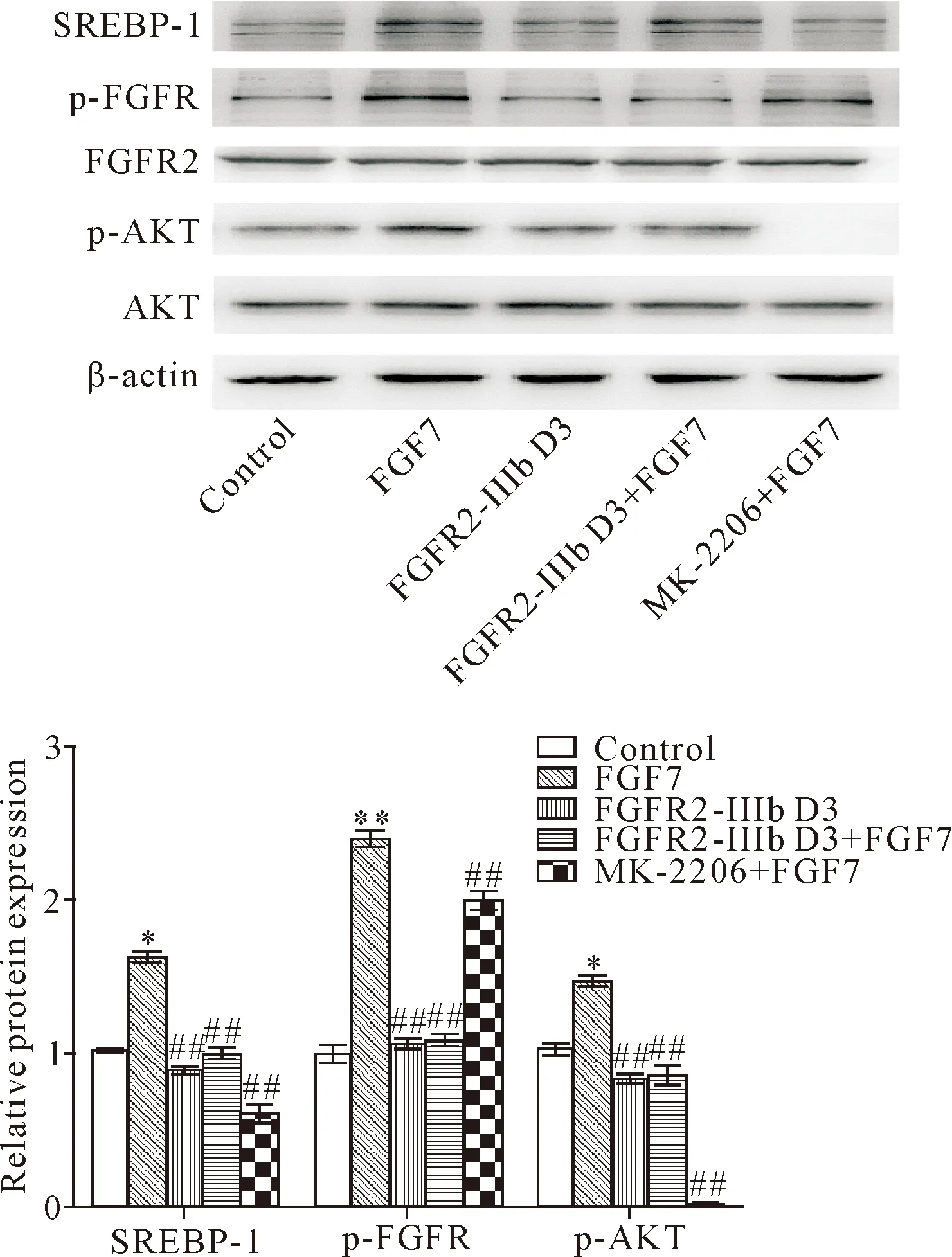
Figure 6. The effect of FGF7, FGFR2-IIIb D3 extracellular domain and AKT inhibitor on the expression of p-FGFR, p-AKT and SREBP-1 in HaCaT cells. Mean±SD.n=3.*P<0.05,**P<0.01vscontrol group;##P<0.01vsFGF7 group.
图6 FGF7、FGFR2-IIIb D3胞外段和AKT抑制剂对p-FGFR、p-AKT及SREBP-1的表达的影响
我们采用等温滴定量热法研究FGFR2-IIIb D3胞外段与FGF7的相互作用,以缓冲液对缓冲液的相互作用、缓冲液对FGF7的相互作用及FGF7对缓冲液的相互作用为空白对照,将实验组的结果和空白对照组的结果利用Origin软件进行融合后得到FGFR2-IIIb D3胞外段与FGF7的相互作用。ITC结果表明FGFR2-IIIb D3胞外段可与FGF7结合。FGFR2-IIIb信号通路可促进细胞活力,而FGFR2-IIIb胞外段可与细胞膜上受体竞争性地结合FGF7进而阻断FGFR2-IIIb信号通路,从而抑制细胞活力,而CCK8结果也表明FGFR2-IIIb D3胞外段可抑制HaCaT细胞活力。
FGFR2-IIIb信号通路主要有3条:Ras-MAPK途径、PI3K-AKT途径和PLCγ途径[8-9]。有肺癌的研究报道暗示,脂质的合成可能与AKT信号通路相关[10],real-time PCR、Western blot、油红O染色和流式细胞术等实验均证明FGFR2-IIIb D3胞外段可通过竞争性地与FGF7的结合,阻断FGF7通过AKT调控的皮肤脂质合成的信号通路,从而抑制角质形成细胞脂质的合成。
综上所述,本研究阐明了FGF7与细胞膜上受体FGFR2-IIIb结合后激活FGFR2-IIIb信号通路中的PI3K-AKT信号,调控SREBP-1c及其脂质合成酶的表达,进而调控角质形成细胞中脂质的合成。同时,我们构建的FGFR2-IIIb D3胞外段可通过竞争性地与FGF7结合阻断FGFR2-IIIb信号通路,进而阻断皮肤脂质合成通路。
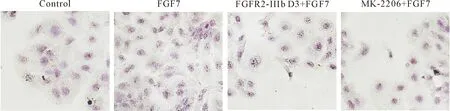
Figure 7. Oil red O staining was used to detect the deposition of lipids in HaCaT cells after treatment with FGF7, FGFR2-IIIb D3 extracellular domain and AKT inhibitor MK-2206 (blue-purple: DAPI; red: lipid; ×200).
图7 油红染色检测HaCaT细胞中脂质的含量
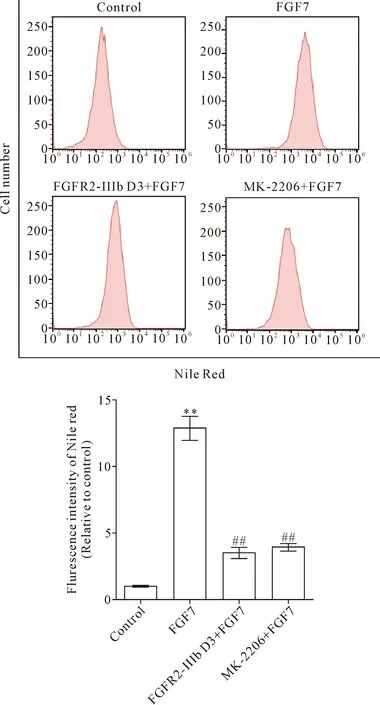
Figure 8. Flow cytometry was used to detect the expression of lipids in HaCaT cells after treatment with FGF7, FGFR2-IIIb D3 extracellular domain and AKT inhibitor MK-2206. Mean±SD.n=3.**P<0.01vscontrol;##P<0.01vsFGF7 group.
图8 流式细胞术检测 HaCaT细胞中脂质的含量

