RNA干扰ATF5基因下调NF-κB信号诱导脑胶质瘤细胞凋亡*
马进海, 马淑娟, 汪 涛, 张王成
(1青海大学附属医院神经外科, 2青海省人民医院妇科, 青海 西宁 810000)
脑胶质瘤是颅内常见的原发性神经上皮肿瘤,具有恶性程度高、复发率高、预后差和病死率高等特点,给患者的生命健康造成严重威胁[1]。脑胶质瘤的恶性进展及复发是一个多阶段、多基因、多步骤的复杂过程,目前基因治疗成为研究热点[2]。转录激活因子5(activating transcription factor 5,ATF5)是ATF/CREB家族的一个转录因子,参与细胞增殖、凋亡、发育和分化等过程,国内外研究显示,ATF5在肝癌、乳腺癌和恶性神经胶质瘤等多种恶性肿瘤中呈现阳性表达,其在肿瘤中作用机制复杂,涉及Wnt、PI3K和RAS/MAPK等信号途径[3-5]。有研究显示,人巨细胞病毒(human cytomegalovirus,HCMV)感染可上调恶性神经胶质瘤细胞ATF5表达,而干扰ATF5表达后的细胞活力明显降低,凋亡率升高[6],但相关细胞凋亡的机制尚未明确。NF-κB为核转录因子,在脑胶质瘤和肺癌等多种肿瘤中呈现高表达,其高表达影响脑胶质瘤的发生与进展[7-8]。本研究旨在探讨敲减ATF5表达对脑胶质瘤细胞凋亡及NF-κB信号的影响,以期为脑胶质瘤的治疗提供理论基础。
材 料 和 方 法
1 细胞、试剂和仪器
人脑胶质瘤细胞系U251细胞购自ATCC。胎牛血清和DMEM培养基均购自Gibco;抗ATF5、血管内皮生长因子(vascular endothelial growth factor,VEGF)、环氧化酶2(cyclooxygenase-2,COX-2)、 p-p65、p-IκB和Bax抗体购自Abcam;MTT和PDTC试剂均购自Sigma;Annexin V-FITC/PI双染细胞凋亡试剂盒和流式细胞仪均购自BD。酶标仪购自BioTek。
2 方法
2.1细胞培养及siRNA转染 U251细胞用含10% 胎牛血清的DMEM培养基,于37 ℃恒温、5%体积分数CO2培养箱中培养,胰酶消化后传代。以1×109/L的密度接种生长至对数期的U251细胞于6孔板,培养箱内常规培养24 h,细胞达80%~90%生长融合时,参照Invitrogen的LipofectamineTM2000转染说明将制备的特异性ATF5 siRNA (siATF5)-Lipo2000复合物加入至6孔板,轻晃混匀后于37℃恒温、5%体积分数CO2培养箱中常规孵育4~6 h后更换为完全培养基。收集转染48 h的细胞用于细胞凋亡及蛋白表达检测。实验分为siATF5组(细胞转染ATF5的特异性siRNA)、阴性对照(negative control, NC)组(细胞转染阴性对照siRNA)和空白对照(blank)组(仅加入脂质体)。
2.2MTT实验检测细胞活力 胰酶消化转染siRNA后的各组细胞,配制成浓度为2×107/L的细胞悬液,以每孔200 μL接种于96孔板,每组设置5个重复孔,观察到细胞完成贴壁后,分别于24、48和72 h加入MTT溶液(5 mg/L),每孔20 μL,继续培养4 h,离心,弃掉上清液,在每孔中加入100 μL的DMSO溶液。酶标仪测定450 nm处的吸光度(A)值。实验重复3次。
2.3流式细胞术检测细胞凋亡 收集转染siRNA 48 h的细胞,调整细胞浓度为1×109/L,参照Anne-xin V-FITC/PI双染细胞凋亡试剂盒说明,使用500 μL的binding buffer悬浮细胞,然后加入Annexin V-FITC 10 μL,于暗室中室温温育染色15 min,在上机前5 min加入5 μL的PI(10 mg/L),流式细胞仪检测,观察细胞凋亡的百分比。实验重复3次。
2.4Western blot实验检测蛋白水平 在转染siRNA 48 h的细胞中加入适量的预冷细胞裂解液制备成匀浆,离心,取上清。BCA法测定蛋白浓度,调整样品为相同浓度,加上样缓冲液,于沸水中变性5 min,取变性蛋白50 μg,每孔道等量,经10% SDS-PAGE分离,分离后的蛋白经电转移至PVDF膜,转好的膜用5%的脱脂奶粉封闭2 h,分别加抗ATF5、VEGF、COX-2、 p-p65、p-IκB、Bax和GAPDH抗体(皆按照1∶500稀释),4 ℃摇床孵育过夜,加1∶2 000稀释的HRP标记的 II 抗室温孵育1.5 h,洗膜,ECL发光剂显色,X胶片曝光,拍照。以Quantity软件分析目的蛋白与内参照GAPDH灰度值,以其比值作为各个蛋白的相对表达量。实验重复3次。
2.5抑制NF-κB信号对U251细胞活力及凋亡的影响 U251细胞用siATF5转染后采用NF-κB信号通路抑制剂PDTC(0.05 μmol/L)处理,细胞分为siATF5组和siATF5+PDTC组,收集处理48 h的2组细胞,通过MTT及Annexin V-FITC/PI双染法检测细胞的活力及凋亡情况。方法同上。
3 统计学处理
所有实验数据均采用SPSS 21.0软件进行分析,计量资料用均数±标准差(mean±SD)表示,多组差异比较采用单因素方差分析,两两比较采用SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 ATF5转染效果检测
siATF5组ATF5蛋白的表达显著低于空白对照组(P<0.05),NC组ATF5蛋白表达与空白对照组差异无统计学意义(P>0.05),见图1。
2 siATF5可抑制U251细胞活力
MTT结果显示,与空白对照组比较,转染siATF5 24 h、48 h和72 h的U251细胞活力均明显降低(P<0.05),见表1。
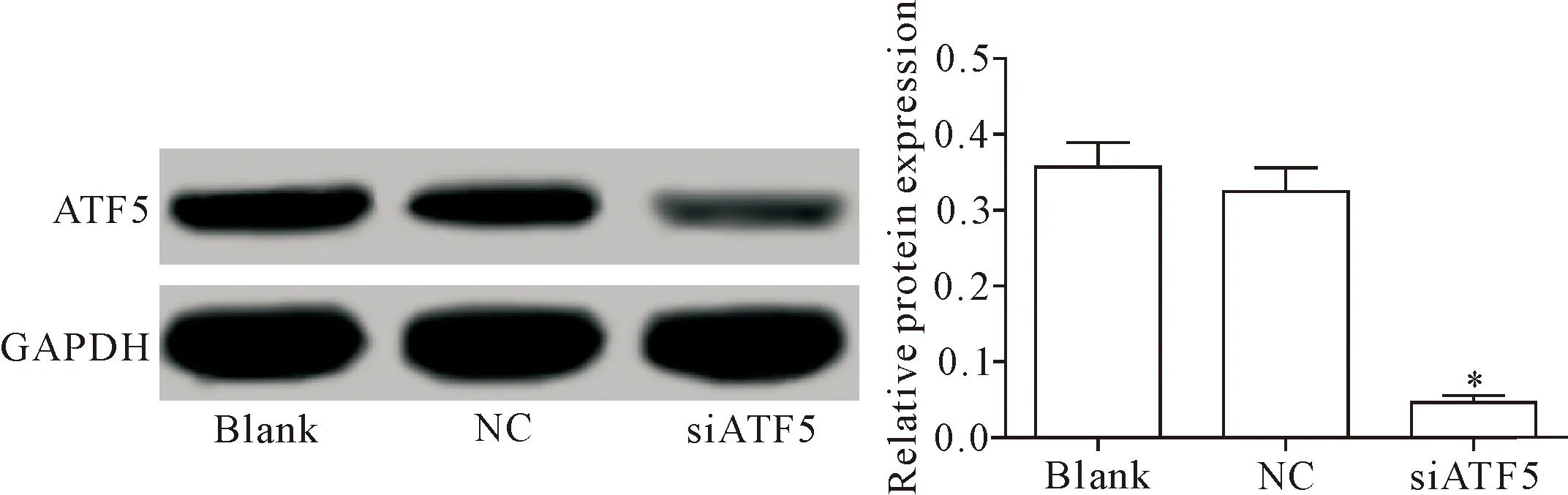
Figure 1. Relative protein expression of ATF5 in the U251 cells. Mean±SD.n=3.*P<0.05vsblank group.
图1 ATF5在转染siATF5的U251细胞中的表达

表1 MTT检测各组U251细胞活力
*P<0.05vsblank group.
3 siATF5可诱导U251细胞凋亡
流式细胞术结果显示,与空白对照组比较,siATF5组U251细胞凋亡率明显升高(P<0.05),见图2。
4 siATF5可下调U251细胞免疫抑制因子VEGF和COX-2的表达
Western blot结果显示,与空白对照组比较,siATF5组VEGF和COX-2蛋白表达均显著降低(P<0.05),见图3。
5 siATF5可下调U251细胞NF-κB信号通路相关分子的蛋白水平
Western blot结果显示,与空白对照组比较,siATF5组p-p65和p-IκB的蛋白水平显著降低,Bax的蛋白水平显著升高(P<0.05),见图4。
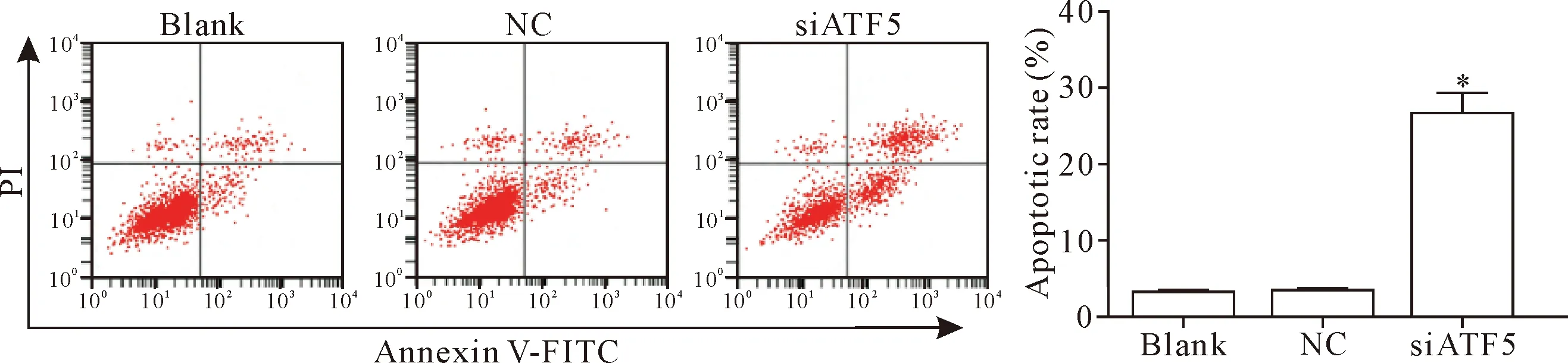
Figure 2. The apoptotic rate of the U251 cells. Mean±SD.n=3.*P<0.05vsblank group.
图2 流式细胞术检测siATF5转染的各组U251细胞的凋亡率

Figure 3. The protein expression of VEGF and COX-2 was determined by Western blot. Mean±SD.n=3.*P<0.05vsblank group.
图3 Western blot检测VEGF和COX-2蛋白表达的变化
6 抑制NF-κB信号通路对U251细胞活力及凋亡率的影响
用siATF5和NF-κB信号通路抑制剂PDTC处理U251细胞,细胞活力及凋亡率的检测结果显示,siATF5+PDTC组的细胞活力(0.312±0.034)显著低于siATF5组(0.544±0.051),siATF5+PDTC组的细胞凋亡率显著高于siATF5组(P<0.05),见图5。
讨 论
利用RNA干扰技术抑制目的癌基因表达,降低癌细胞增殖及诱导凋亡,从而达到肿瘤治疗目的,在治疗恶性肿瘤中有很好的前景及应用价值[9-10]。ATF5基因定位于19q13.3,属于ATF/CREB核转录因子家族,其在胶质母细胞瘤中有广泛表达,干扰其表达可影响细胞存活[11];HCMV感染可上调恶性神经胶质瘤细胞ATF5表达,而干扰ATF5表达后的细胞活力明显降低,凋亡率升高[6],以上研究提示抑制ATF5表达可降低胶质瘤细胞生长。本研究中通过RNA干扰技术抑制人脑胶质瘤U251细胞ATF5表达,发现细胞活力明显降低,凋亡率升高,这与前人的研究结果一致。

Figure 4. The protein levels of NF-κB signaling pathway-related molecules were determined by Western blot. Mean±SD.n=3.*P<0.05vsblank group.
图4 Western blot检测NF-κB信号通路相关分子的蛋白水平

Figure 5. The effect of PDTC on the apoptotic rate of U251 cells. Mean±SD.n=3.*P<0.05vssiATF5 group.
图5 抑制NF-κB信号通路对U251细胞凋亡率的影响
目前已发现多种细胞因子可使机体发生免疫抑制,如TGF-β、VEGF和COX-2等[12]。大多数肿瘤可产生VEGF,从而促进肿瘤血管生成[13]。有研究发现,肿瘤细胞培养上清可降低树突细胞分化,而这种抑制作用可被VEGF抗体阻断[14]。COX-2可被细胞因子、癌基因、生长因子和肿瘤细胞诱生,为前列腺素生物合成的限速酶,其表达过度与多种肿瘤发生发展存在密切关系[15]。COX-2可通过上调caspase-3引起免疫细胞凋亡[16],还可通过抑制肿瘤坏死因子(tumor necrosis factor,TNF)的产生间接引起白细胞介素10(interleukin-10,IL-10)产生,进而降低机体杀瘤免疫作用[17]。已有研究表明,抑制VEGF和COX-2表达可降低胶质瘤免疫抑制[18-19]。本研究结果显示,抑制ATF5表达可降低U251细胞VEGF和COX-2的表达,这提示ATF5表达抑制可能降低脑胶质瘤免疫抑制。
NF-κB是一种细胞核转录因子,几乎在所有细胞内存在,近些年的研究显示,NF-κB信号与肿瘤细胞增殖、凋亡、分化、侵袭和转移等密切相关。多种实体肿瘤中NF-κB表达升高或呈持续激活状态,且这些肿瘤普遍存在抵抗现象,预后差[20-21]。而有研究显示,抑制NF-κB信号可降低脑胶质瘤细胞生长[22]。激活ATF家族ATF3可通过结合NF-κB p65亚基抑制炎症反应[23]。ATF5是否参与调控NF-κB信号影响胶质瘤细胞生长尚未清楚。Bax是Bcl-2家族成员,发挥促凋亡作用,肿瘤细胞活化的NF-κB可通过上调Bax表达诱导癌细胞凋亡[24-25],抑制ATF5表达诱导胶质瘤细胞凋亡与上调Bax表达有关[6]。本研究结果显示,抑制ATF5表达可下调NF-κB信号通路p-p65和p-IκB表达,上调Bax表达,提示ATF5表达抑制诱导脑胶质瘤凋亡机制可能与NF-κB信号的下调有关。

