miR-499通过靶向调控PTEN基因减轻大鼠心肌损伤*
许海涛, 王佳子
(1锦州医科大学附属第三医院心内2科, 辽宁 锦州 121001; 2 93263部队场站医院, 辽宁 锦州 121000)
心肌供血不足将导致心肌细胞的结构和功能发生改变,引起心肌梗死等心脏病理状态。在临床上,通常采用溶栓疗法和皮冠状动脉接入法等再灌注治疗手段来快速恢复血液供应、挽救濒坏死心肌、改善心肌梗死预后等。然而,心肌血流的快速供应将会加重心肌损伤,抑制心脏功能,这种现象被称为心肌缺血再灌注(ischemia-reperfusion,I/R)损伤。I/R引起的心肌细胞凋亡、心律失常、心肌顿抑等并发症,严重危害患者的生命,大大削减了再灌注治疗为患者带来的收益。缺血预处理最初由Murry等[1]引入,可作为一种有效的内源性心脏保护形式,通过降低缺血后心率失常严重程度和发生率,减少凋亡发生,从而促进缺血后心肌功能的恢复[2-3]。和预处理效果类似,2003年Zhao等[4]提出在灌注开始时采用短暂的间歇重复性阻断心肌供血,可显著减轻I/R并提高机体对再灌注损伤的耐受力,显著限制心肌梗死面积,改善冠状动脉内皮功能。研究表明,缺血后处理能够有效的抑制细胞的氧化应激、凋亡和炎症反应等[5-6],然而关于其具体分子作用尚不清楚,因此,探讨并揭示这些分子机制对于心肌梗死、急性心肌濒死的临床引用具有重要意义。
近年来发现,微小RNA(microRNA,miRNA,miR)参与了心血管疾病中心率失常、心力衰竭、心肌肥厚以及心肌细胞凋亡等病理进程,尤其在心肌梗死和心肌缺血等疾病中发挥重要作用[7-9]。据报道,miR-499在心脏部位高表达[10],可调节线粒体平衡在心肌缺血中发挥重要作用[11];上调其表达水平可显著抑制凋亡并减少心肌梗死面积[12]。然而,关于miR-499与第10号染色体缺失的磷酸酶-张力蛋白同源蛋白(phosphatase and tensin homolog deleted on chromosome 10,PTEN)的作用机制尚不清楚。因此,本研究将构建大鼠I/R模型以及心肌细胞损伤模型,探讨miR-499和靶基因PTEN在心肌细胞损伤病理过程中的作用和分子机制。
材 料 和 方 法
1 实验材料
SD雄性大鼠购于武汉大学动物实验中心,动物合格证编号为Y20180216,8周龄,体重220~260 g。胰酶、Ⅱ型胶原酶、DMEM培养基和10%牛血清购自GIBCO;TRIzol和Lipofectamine®2000购自Invitrogen;SYBR® Premix Ex TaqTMII购自TaKaRa;基因组去除和反转试剂盒购自Thermo;萤光素酶和BCA试剂盒购自碧云天;抗兔PTEN和GAPDH抗体及HRP标记的羊抗兔 II 抗购自CST;siR-PTEN、miR-499模拟物和抑制剂购自上海吉玛。引物由上海生工合成。
2 实验方法
2.1大鼠心肌I/R模型的构建 设置实验组和假手术组,对鼠龄相近的健康大鼠称重,按照4 mL/kg量腹腔注射10%水合氯醛,麻醉后除去空腔分泌物,气管切开后连接插管,并连接呼吸机,调整频率为60 min-1和潮气量10~13 mL。左侧胸消毒,第4肋间开胸,撕开心包,暴露心脏,6/0无损缝合线穿过心肌阻断血管,判断阻断成功的标志为心电图ST段抬高、心肌苍白。30 min后松开缝合线,使血管再通。
2.2大鼠原代心肌细胞的获取 取健康大鼠使用75%乙醇浸泡数秒,在无菌条件下固定大鼠,暴露左胸,使用剪刀从第2肋间开胸,迅速取下心肌组织并浸入无菌预冷PBS中,剔除红细胞和血管组织等,分出心室部位剪碎至1 mm×1 mm×1 mm大小的组织碎块,加入Ⅱ型胶原酶混匀消化,加入DMEM终止消化,离心收集细胞,培养基重悬制备细胞单悬液,转移细胞悬液至无菌瓶中,37 ℃静置培养,待非心肌细胞沉降贴壁后吸取心肌细胞转移至新的培养瓶中继续培养。
2.3细胞损伤模型的建立 取培养48 h的原代心肌细胞,0.25%胰酶消化,离心收集细胞,加入新鲜DMEM重悬细胞,并调整浓度为5×108/L,取2 mL至6孔板中,48 h后换培养基,加入终浓度为100 μmol/L的过氧化氢,2 h后测定细胞生物学特性。
2.4细胞转染 设置对照(control)组、miR-control组、miR-499组、anti-miR-control组和anti-miR-499组,使用Lipofectamine® 2000转染相应物质至细胞,操作参考说明书。
2.5CCK-8法检测细胞活力 调整细胞浓度为1×108/L,接种100 μL于96孔板,37 ℃、5% CO2条件下培养24 h,加入过氧化氢,培养6 h后加入10 μL CCK-8,避光孵育1 h,酶标仪测定450 nm吸光度(A)值,每组3个重复,结果取平均值。
2.6乳酸脱氢酶(lactate dehydrogenase,LDH)释放量的检测 调整细胞浓度为5×108/L,接种100 μL于96孔板,37 ℃孵育2 h,收集各组细胞,LDH试剂盒检测乳酸脱氢酶的释放量,每组3个重复,结果取平均值,具体参考说明书。
2.7RT-qPCR实验 提前准备0.1% DEPC水去除实验用品RNA酶,取出不同实验组的细胞,弃细胞培养液,预冷PBS冲洗,使用TRIzol法提取细胞内总RNA。NanoDrop 2000测定A260/A280(1.8~2.0范围内),甲醛变性电泳检测RNA完整性,DNA酶去除残余基因组,试剂盒合成cDNA第1链。添加TB Green 10 μL、上游引物(10 μmol/L) 0.5 μL、下游引物(10 μmol/L) 0.5 μL和cDNA 1 μL,ddH2O补足至20 μL至反应体系中,设置程序:95 ℃ 3 min;95 ℃ 30 s;60 ℃ 30 s;40 cycles。以GAPDH为内参照,每组3个重复,2-ΔΔCt法计算PTEN的mRNA表达水平。PTEN的上游引物为5’-CGACGGGAAGACAAGACAAGTT-3’,下游引物为5’-GCTAGCCTCTGGATTTGACG-3’;GAPDH的上游引物为5’-ACCACAGTCCATGCCATCAC-3’,下游引物为5’-TCCACCACCCTGTTGCTGTA-3’。以U6为内参照,检测miR-499的表达水平。miR-499的上游引物序列为5’-GGGGTTAAGACTTGCAGTG-3’,下游引物序列为5’-CAGTGCGTGTCGTGGAGT-3’;U6的上游引物序列为5’-CTCGCTTCGGCAGCACA-3’,下游引物序列为5’-AACGCTTCACGAATTTGCGT-3’。
2.8萤光素酶实验 使用TargetScan查找miR-499和PTEN结合位点,设计合成PTEN的3’UTR-WT和3’UTR-Mut,使其连入ARE-GFP荧光报告质粒中,分别与miR-499模拟物或miR-control共转染,试剂盒检测各组萤光素酶活性。
2.9Western blot实验 收集miR-control组、miR-499组、anti-miR-control组和anti-miR-499组细胞,RIAP裂解,收集上清液,BCA测定蛋白浓度。取50 μg蛋白行SDS-PAGE,转移至PVDF膜上,TBST洗1次。使用5%牛血清室温封闭2 h,TBST洗2次,每次10 min,I 抗(1∶1 000)低温过夜孵育,TBST洗2次,每次10 min,II 抗(1∶2 000)室温孵育1 h,TBST洗3次,每次10 min。DAB法显色成像,进行条带灰度分析。
3 统计学分析
SPSS 19.0分析处理数据。所得数值以均数±标准差(mean±SD)表示,两组间比较使用t检验,多组间比较使用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 miR-499在I/R损伤模型中表达的变化
在I/R不同时点麻醉后摘取心脏,取左心室心尖组织检测miR-499的表达水平。RT-qPCR结果显示,与大鼠假手术组(1.00±0.06)相比,I/R 6 h、12 h和24 h组miR-499相对表达水平分别为3.27±0.30、1.94±0.23和0.81±0.11。可见,在大鼠心肌缺血再灌注损伤中,miR-499表达水平迅速提升,之后呈时间依赖性逐渐下降(F=95.649,P=0.000),见图1。
2 miR-499过表达对心肌细胞的保护作用
先以100 μmol/L的过氧化氢构建心肌细胞损伤模型,后进行转染处理, 将miR-499模拟物转染至细胞损伤模型中,细胞转染miR-449模拟物后,miR-499显著上调(P<0.01)。与control相比,I/R细胞损伤模型细胞存活率下降,LDH释放量增加;上调miR-499显著提升细胞模型的存活率,LDH表达水平显著下调(P<0.05),见图2。
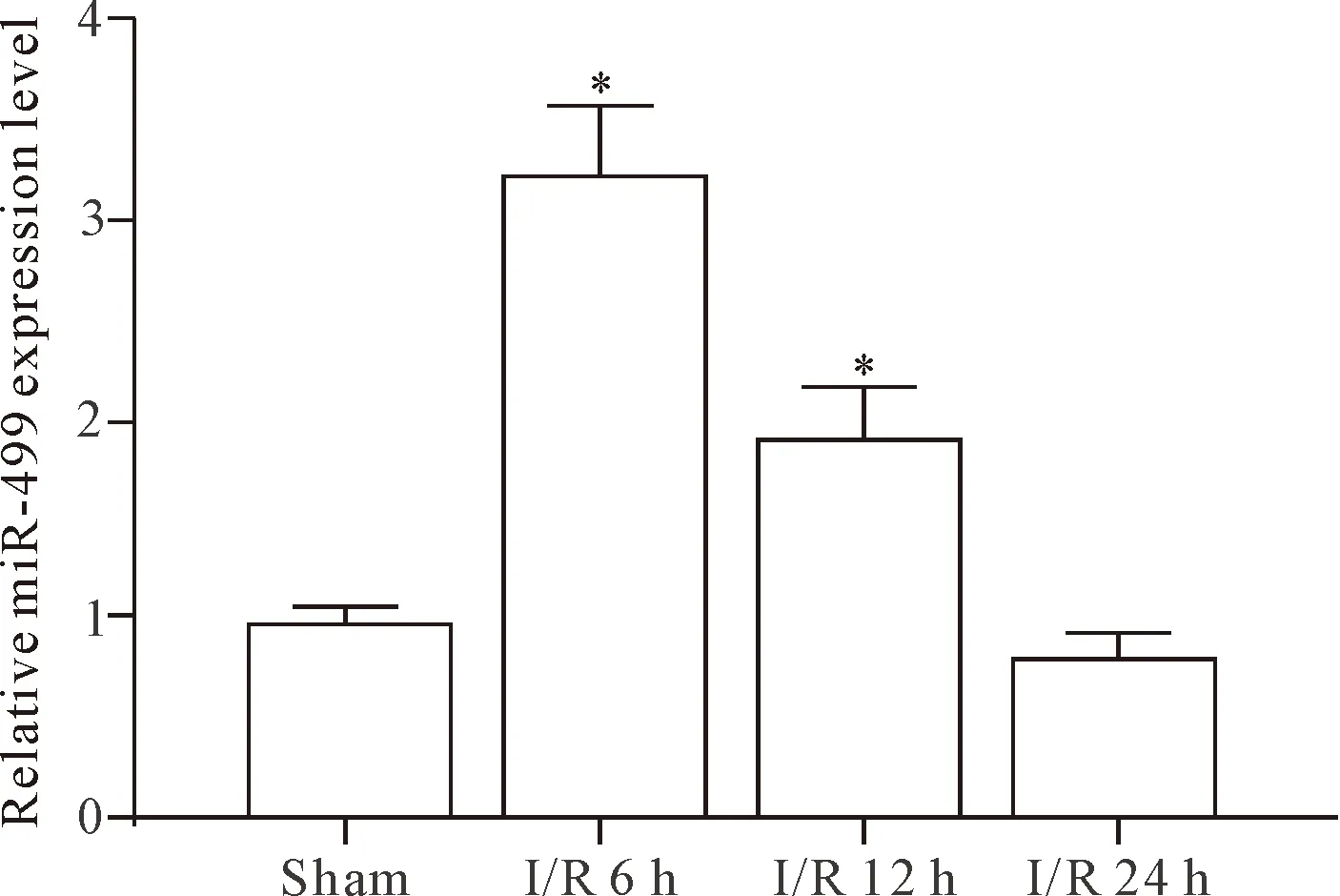
Figure 1. The expression level of miR-499 in the myocardium of I/R injury model. Mean±SD.n=8.*P<0.05vssham group.
图1 miR-499在I/R损伤模型心肌组织中的表达水平
3 miR-499靶向调控PTEN
TargetScan分析发现PTEN mRNA的3’UTR含有miR-499种子序列保守碱基,萤光素酶实验验证两者的靶向关系。结果显示,与转染miR-control相比,miR-499和PTEN 3’UTR-WT报告质粒共转染,细胞萤光素酶相对活性明显下降(P<0.05),见图3。
4 过表达miR-499抑制PTEN的表达
为探究miR-499对PTEN表达的影响,分别转染miR-499模拟物和抑制剂至细胞,RT-qPCR和Wes-tern blot检测PTEN表达水平的变化。结果显示,上调miR-499表达促使PTEN mRNA和蛋白表达显著减少,敲减miR-499表达促使PTEN的mRNA和蛋白表达显著上调(P<0.05),见图4。
5 siR-PTEN对心肌细胞的保护作用
将siR-PTEN转染细胞,检测细胞活力和LDH释放的变化。结果显示,转染siR-PTEN使胞内PTEN的mRNA和蛋白表达均显著下调(P<0.05)。下调细胞内PTEN的表达显著提升细胞活力,促使LDH释放量显著减少(P<0.05),即siR-PTEN能减轻心肌细胞损伤,见图5。
6 miR-499靶向PTEN对心肌细胞的保护作用
为探究miR-499和PTEN在I/R中的作用机制,将anti-miR-499和siR-PTEN共转染,检测其在H2O2氧化应激中作用效果。当添加H2O2刺激心肌细胞后,与control相比,anti-miR-499组的细胞活力显著下降,LDH生成量增加,细胞损伤加重;与anti-miR-499组相比,miR-499抑制剂和siR-PTEN共转染后细胞活力显著得到提升,LDH释放量显著下降(P<0.05),见图6。
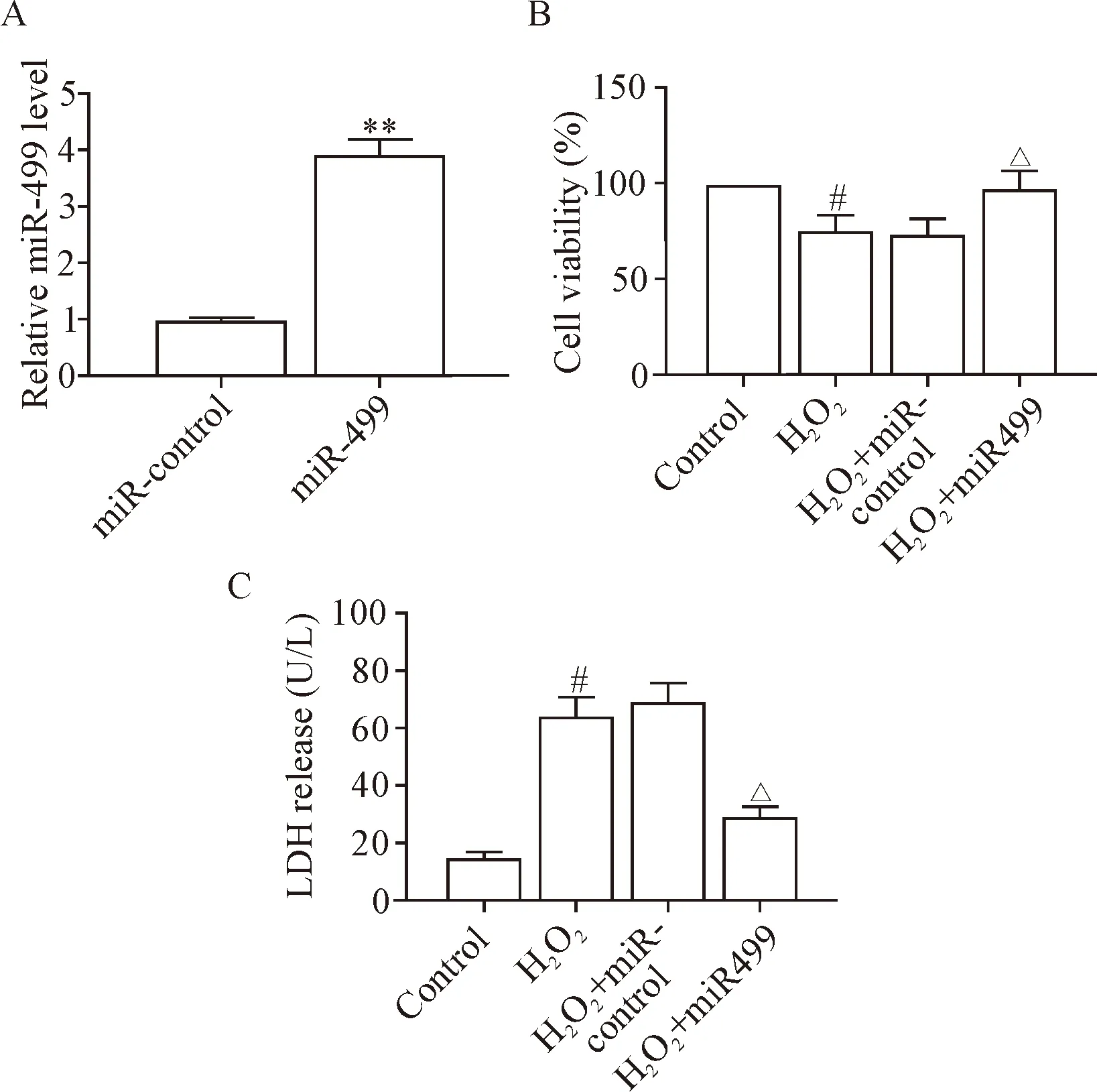
Figure 2. Effect of miR-499 on I/R injury model of the cardiomyocytes. A: the miR-499 transfection efficiency was determined by RT-qPCR; B: the cell viability was measured by CCK-8 assay; C: LDH release detection. Mean±SD.n=3.**P<0.01vsmiR-control group;#P<0.05vscontrol group;△P<0.05vsH2O2+miR-control group.
图2 miR-499对细胞损伤模型的作用
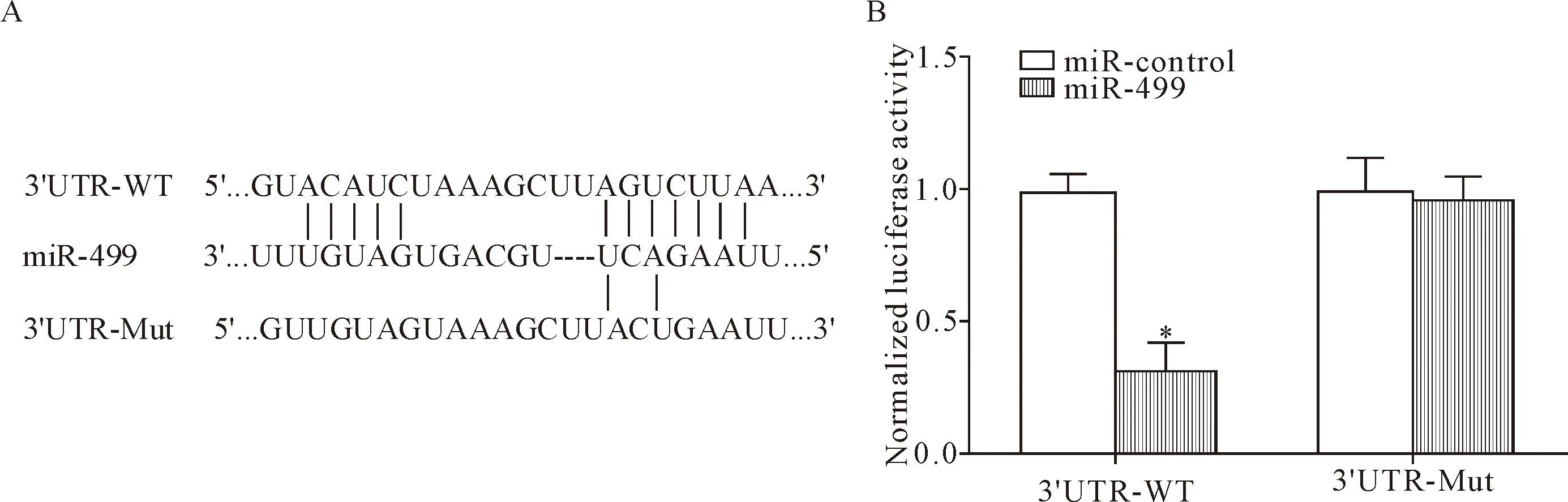
Figure 3. Verification of the targeting relationship between miR-499 and PTEN. A: the target binding sites of miR-499 and PTEN; B: the results of luciferase assay. Mean±SD.n=3.*P<0.05vsmiR-control group.
图3 miR-499和PTEN的靶向关系验证
讨 论
miRNA是一类约为21 nt的小分子RNA,通过靶向调控靶mRNA参与机体生理病理过程[13-16]。近些年的研究表明,miRNA与心血管类疾病密切相关,目前miR-1、miR-24、miR-145、miR-26和miR-126等被认为在心肌缺血发挥重要作用[17-18]。Agiannitopoulos等[19]发现,miR-499的表达水平在心肌梗死中显著上调,其表达水平可作为判断心梗的分子标志物;Qin等[20]对犬类进行心肺移植时发现,犬左心室的miR-499在缺血再灌注后出现显著下调;Zhu等[12]通过上调miR-499靶向抑制PDCD4因子的表达,能减轻再灌注损伤,减少心肌细胞凋亡和心肌梗死面积,从而改善左心室功能。在本研究中,我们检测了大鼠I/R模型中miR-499的表达变化,结果与上诉报道一致,与假手术组相比,大鼠发生心肌缺血时miR-499表达水平迅速提高,又随着损伤时间的延长逐渐下降。而后为探究miR-499在心肌细胞损伤中的作用,本研究将其模拟物转染心肌细胞损伤模型中,结果发现上调miR-499能够显著提高细胞活力,降低LDH生成量减轻细胞氧化应激损伤。可见,miR-499对大鼠损伤的心肌具有保护作用。

Figure 4. The effect of miR-499 on PTEN expression. A: the mRNA expression level of PTEN was detected by RT-qPCR; B: the protein expression level of PTEN was detected by Western blot. Mean±SD.n=3.*P<0.05vsmiR-control group;#P<0.05vsanti-miR-control group.
图4 miR-499对PTEN表达的影响
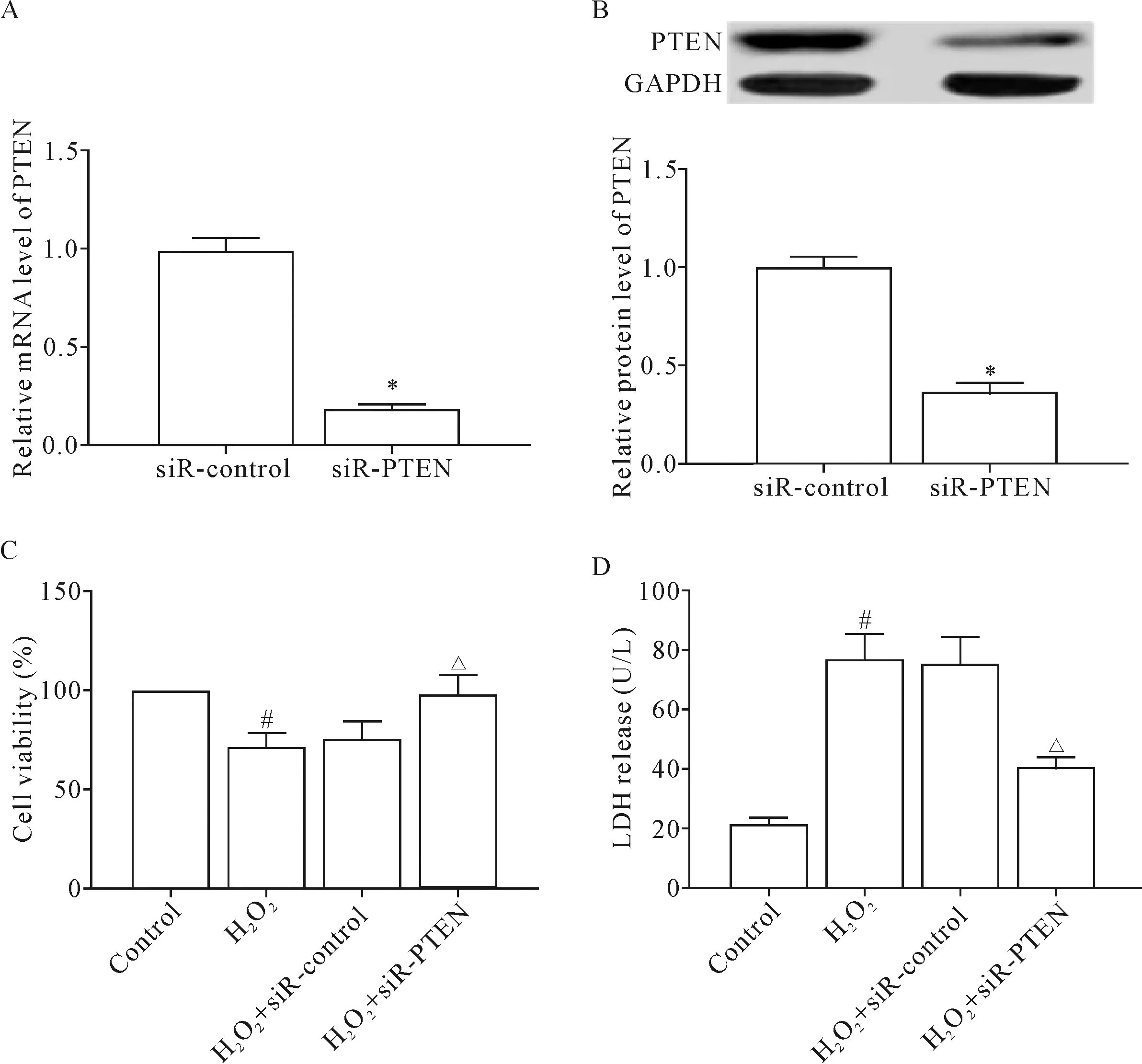
Figure 5. Protective effect of siR-PTEN on the cardiomyocytes. A: the transfection efficiency of siR-PTEN detected by RT-qPCR; B: the transfection efficiency of siR-PTEN detected by Western blot; C: the cell viability measured by CCK-8 assay; D: the detection of LDH release. Mean±SD.n=3.*P<0.05vssiR-control group;#P<0.05vscontrol group;△P<0.05vsH2O2+siR-control group.
图5 siR-PTEN对心肌细胞的保护作用
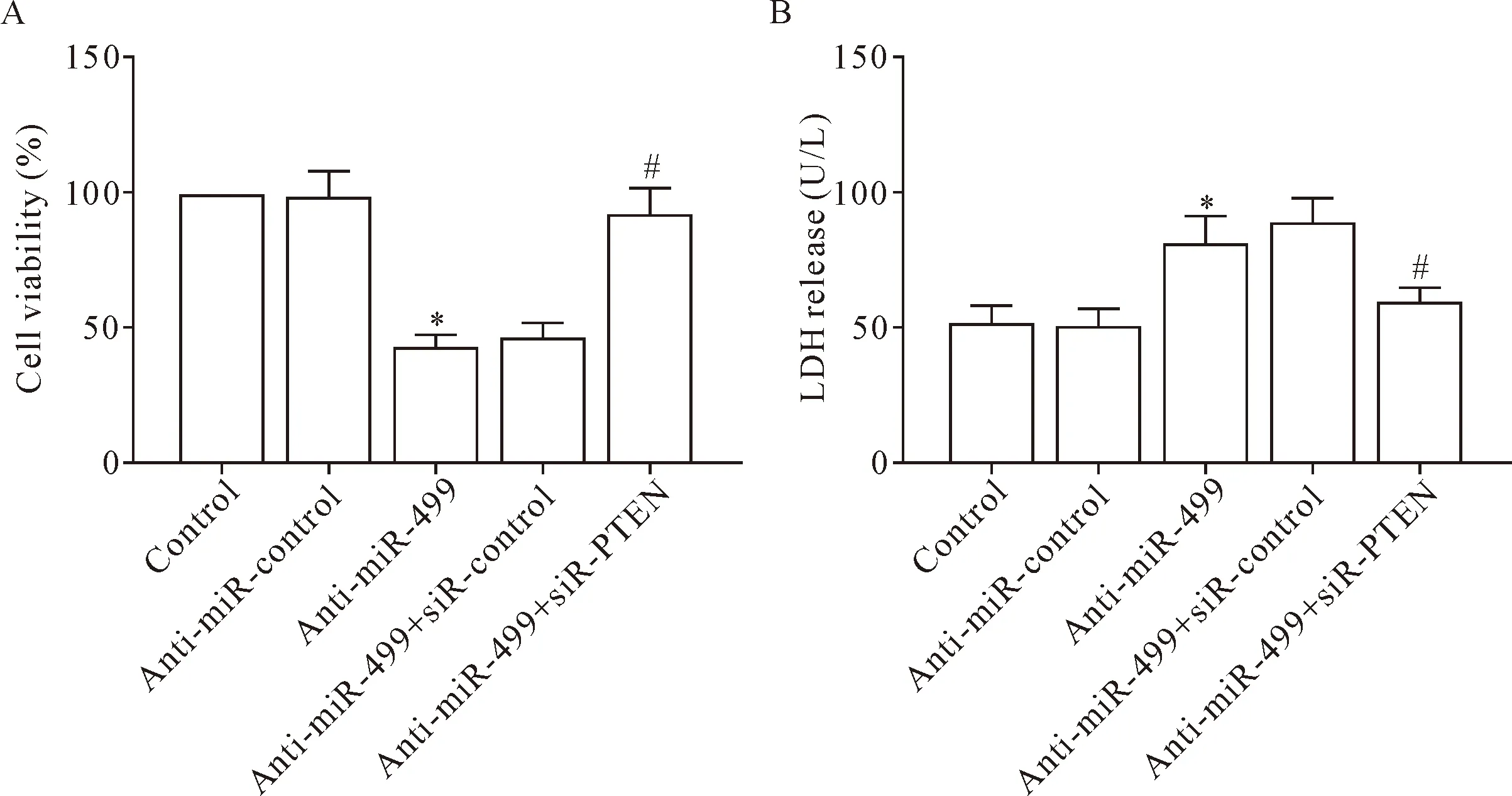
Figure 6. The effect of co-transfection of miR-499 inhibitor (anti-miR-449) and siR-PTEN on the cardiomyocytes. A: the cell viability measured by CCK-8 assay; B: the LDH release levels. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsanti-miR-499 group.
图6 miR-499抑制剂和siR-PTEN共转染对心肌细胞的影响
使用TargetScan和miRcode对miR-499的靶基因进行分析,进而探索miR-499在大鼠I/R中的作用机制。以往研究表明,miR-499可靶向MEF2C[21]、PDCD4[22]和VAV3[23]等基因的表达,进而参与调控细胞增殖、侵袭和凋亡等生物学功能。本研究发现,PTEN是为miR-499的靶基因之一,增加miR-499表达量能够显著抑制PTEN表达,而敲减miR-499表达能够促进PTEN表达上调,萤光素酶实验也证实两者具有靶向关系。同时,Zu等[24]发现PTEN能够促小鼠进线粒体发生凋亡,加重I/R损伤;江梦等[25]发现PTEN下调可有效抑制心肌细胞凋亡,减少心肌梗死面积。为了探究PTEN的作用机制,本研究转染siR-PTEN至大鼠心肌细胞损伤模型中,发现敲减PTEN表达能够提高细胞活力,降低LDH生成量,减轻细胞氧化应激,从而缓解I/R损伤,与上述文献一致。众所周知,miRNA是通过结合靶基因mRNA 3’UTR抑制其翻译过程或使发生降解,从而发挥对靶基因的负调控机制。为了探究miR-499靶向PTEN在心肌细胞损伤的分子机制,本研究将miR-499抑制剂和siR-PTEN共转染至心肌细胞损伤模型中,探究细胞存活率和氧化应激反应程度。结果显示,与对照组相比,抑制剂组的细胞活力显著下降,LDH生成量增加,细胞损伤加重;与anti-miR-499组相比,miR-499抑制剂和siR-PTEN共转染后细胞活力显著得到提升,LDH释放量显著下降。
综上所述,本研究通过构建大鼠I/R活体模型和大鼠心肌细胞损伤模型观察miR-499表达的规律,并设计实验证实了miR-499可通过靶向负调控PTEN的表达而增强心肌细胞活力,减轻细胞氧化应激反应,从而减轻大鼠心肌的病理损伤。

