基于UHPLC-MS/MS分析痕量芥子气染毒血样中血红蛋白加合物
陈 博,于惠兰,刘石磊,刘昌财,梁龙辉,杨 旸,吴姬娜,李晓森
(1.国民核生化防护国家重点实验室,北京 102205;2.防化研究院分析化学实验室,北京 102205)
芥子气,即2,2’-二氯乙基硫醚,是一种很强的糜烂性毒剂,会引起炎症、糜烂等症状[1]。芥子气在一战中被作为化学武器使用,在之后的两伊战争、中东冲突仍引起大量的伤亡[2-3]。二战后,日本在中国境内遗弃的化学武器含有大量的芥子气[4],时至今日,由芥子气引起的人员伤亡事件仍时有发生。因此,芥子气暴露后的溯源性分析十分必要。
芥子气进入人体后,可以形成芥子气-蛋白加合物、芥子气-DNA加合物等大分子加合物,这些生物标志物可以在人体内存在数月[5-8]。研究发现[5,9],芥子气-血红蛋白加合物(HD-HGB)是比较稳定的芥子气染毒生物标志物,可在人体内存在120天左右。HD-HGB的检测方法有两种:一种是通过Edman降解得到N-缬氨酸加合物(HETE-Val)[10-14],即使用酸性丙酮从血红蛋白中分离出珠蛋白,溶于甲酰胺之后与异硫氰酸五氟苯酯(PFPITC)发生Edman降解,使用甲苯萃取得到HETE-Val,经水洗、吹干、复溶后,使用七氟丁酸酐(HFBA)或七氟丁酰咪唑(HFBI)进行衍生,随后再次使用甲苯萃取,经水洗、干燥、吹干、复溶之后,使用气相色谱-负化学电离源-质谱(GC-NCI-MS)检测。该方法可获得较低的检出限(约3 μg/L(20 nmol/L))[11],但操作复杂。另一种方法是使用酸水解对HD-HGB进行处理得到芥子气-组氨酸加合物(HETE-His),经芴甲氧羰基氯(Fmoc-Cl)衍生,采用高效液相色谱-串联质谱(HPLC-MS/MS)分析[15],该方法条件苛刻,需要使用110 ℃高温和浓盐酸,且酸水解后的样品需用大量的碱进行中和,以达到衍生反应所需的pH值。该方法基于一个离子对进行检测,检出限较高(1.5 mg/L),不能满足痕量芥子气暴露染毒的定量分析要求。
本研究拟采用离心法分离芥子气染毒人全血中的血红细胞,去离子水涨裂释放血红蛋白,酸性丙酮去除血红素后得到珠蛋白,经链霉蛋白酶酶解,固相萃取柱纯化,苄氧羰基氯(Cbz-Cl)衍生,超高效液相色谱-串联质谱法(UHPLC-MS/MS)痕量溯源分析芥子气染毒全血,希望为化学武器核查分析和中毒救治等提供方法参考。
1 实验部分
1.1 主要仪器与装置
Agilent 6460 TripleQuad 液相色谱-质谱仪(配有电喷雾电离源)、Masshunter Qualitative Analysis B.05.00数据处理系统、固相萃取柱(Bond Elut-PPL:200 mg,3 mL;Bond Elut-NH2:200 mg,3 mL;Bond Elut-PlexaPAX:60 mg,3 mL;Bond Elut-ENV:100 mg,3 mL)、Zorbax Eclipse Plus C18预柱、Zorbax Eclipse Plus C18反相色谱柱:均为美国Agilent公司产品;Qasis HLB(3 mL)固相萃取柱:美国Waters公司产品;Eppendorf 5424台式离心机、Eppendorf移液枪(0.1~2.5 μL、20~200 μL、100~1 000 μL)、Eppendorf 5350振荡加热器:均为德国Eppendorf公司产品。
1.2 主要材料与试剂
甲醇(LC/MS级)、异丙醇(LC级)、水(LC/MS级):美国Honeywell Burdick & Jackson公司产品;丙酮(LC级):韩国Duksan公司产品;乙腈(LC/MS级):美国Fisher Chemical公司产品;碳酸氢铵(98%)、氯甲酸苄酯(纯度>95%)、甲酸(纯度>98%,LC/MS级):北京J&K Scientific公司产品;氯化钠(99.9%)、发烟盐酸(37%):美国Merck Millipore公司产品;链霉蛋白酶(货号:25551122):德国Roche公司产品;芥子气及其模拟剂2-氯乙基乙基硫醚(2-CEES):由本实验室合成;未经芥子气暴露的健康人全血样品:由志愿者提供。
1.3 实验条件
1.3.1色谱条件 Zorbax Eclipse Plus C18预柱(12.5 mm×2.1 mm×1.8 μm)、Zorbax Eclipse Plus C18反相色谱柱(100 mm×2.1 mm×1.8 μm);流动相:A为0.1%甲酸水溶液,B为0.1%甲酸乙腈溶液;梯度洗脱条件:0~2 min(5%B),2~2.5 min(5%~10%B),2.5~6.5 min(10%B),6.5~7 min(10%~22.5%B),7~12 min(22.5%B),12~12.1 min(22.5%~100%B),12.1~16 min(100%B);后运行3 min;流速0.3 mL/min;进样体积10 μL;柱温30 ℃。
1.3.2质谱条件 ESI正离子模式检测;毛细管电压4.0 kV;气体温度350 ℃;干燥气:氮气,流速10 L/min;雾化气:氮气,压力2.4×105Pa;扫描方式:多反应监测模式(MRM);分辨率:单位分辨。经Cbz-Cl衍生后的HETE-His(HETE-His-Cbz)和经衍生后的乙基硫乙基-组氨酸(ETE-His-Cbz)的质谱参数列于表1。
1.4 注意事项
芥子气是一种非常活泼的糜烂性毒剂,在处理芥子气溶液以及芥子气染毒全血时,需要专业人员在通风橱中进行操作。任何与芥子气直接接触的器具均需要使用漂白液进行彻底消毒。
1.5 标准曲线溶液及质量控制样品的配制
使用异丙醇对10.0 g/L芥子气乙腈溶液进行梯度稀释,得到100、70.0、30.0、20.0、10.0、5.00、3.00、1.00 mg/L一系列芥子气标准溶液。将20.0 μL上述芥子气标准溶液分别添加至2.00 mL空白血浆中,于37 ℃振荡12 h,得到8个标准曲线溶液样品的芥子气浓度分别为10.0、30.0、50.0、100、200、300、700、1 000 μg/L。使用空白全血对1.00 mg/L芥子气染毒全血进行梯度稀释,得到染毒浓度为20.0、80.0、500 μg/L的低、中、高质量控制(QCL、QCM、QCH)染毒血浆。将20.0 μL异丙醇加至2.00 mL空白血浆中作为空白样品。标准曲线样品、质量控制样品以及空白样品均置于4 ℃冰箱保存。

表1 目标物的质谱参数优化结果Table 1 Optimal parameters of mass spectrometry for analytes
注:*表示以产物离子及其前体离子为定量离子对
1.6 内标溶液的制备
将20.0 μL 2.00 mg/L 2-CEES的异丙醇溶液加入到2.00 mL血红蛋白溶液(130 g/L)中,于37 ℃振荡12 h,制备成内标溶液,于4 ℃冰箱保存。
1.7 样品制备
1.7.1珠蛋白提取 采用Bailey等[16-17]报道的方法对珠蛋白进行富集。首先,取100 μL染毒全血,以1 500 r/min离心10.0 min,弃去上层血浆,分离出红细胞,用300 μL 0.9%生理盐水清洗红细胞2次。然后,加入100 μL去离子水,剧烈振荡后静置10 min,以涨裂红细胞,释放血红蛋白,以10 000 r/min离心10 min去除细胞膜。再加入10 μL内标溶液、1.0 mL 0.12 mol/L盐酸丙酮溶液,以分离血红素与珠蛋白,弃去上层红色溶液,分别使用1.0 mL 0.12 mol/L盐酸丙酮溶液、丙酮、乙醚清洗下层沉淀。将得到的珠蛋白置于室温自然晾干,并使用400 μL 50 mmol/L NH4HCO3水溶液悬浮。
1.7.2链霉蛋白酶酶解与固相萃取 在上述珠蛋白悬浮液中,加入100 μL 15 g/L链霉蛋白酶,在700 r/min振荡下,于55 ℃保温10 h。酶解后,加入1.0 mL乙腈,振荡混匀,以13 000 r/min离心5.0 min。取上清液,真空离心浓缩至约200 μL,使用去离子水定容至500 μL。
分别用3.0 mL甲醇和3.0 mL水预先平衡PPL固相萃取柱,将上述酶解液加入平衡好的PPL柱上,先用1.0 mL 5%甲醇水溶液淋洗3次,再用1.0 mL 50%甲醇水溶液洗脱目标物。洗脱液真空浓缩至约50 μL,用去离子水定容至100 μL。
1.7.3Cbz-Cl衍生 将上述浓缩后的洗脱液置于冰水浴中冷却5 min,加入5.0 μL 1 mol/L NH4HCO3溶液,随后加入2 μL Cbz-Cl,并立即置于4 ℃剧烈振荡30 min。衍生结束后,加入1.0 μL 20%甲酸水溶液终止反应。将得到的衍生化氨基酸加合物转移至自动进样小瓶中,待UHPLC-MS/MS分析。样品制备操作步骤示于图1。
2 结果与讨论
2.1 质谱条件的优化
分别使用10 g/L芥子气溶液与2-CEES溶液对血红蛋白溶液进行染毒,经样品制备后得待测液,在正、负离子模式下全扫描,选择合适的电离方式和MRM母离子。结果表明,在ESI+模式下,HETE-His-Cbz与ETE-His-Cbz均可获得丰度较高的[M+H]+准分子离子峰,故分别选择m/z394、378作为HETE-His-Cbz、ETE-His-Cbz的母离子。由于组氨酸的侧链有两个加合位点,因此[M+H]+准分子离子峰可能有2种结构(芥子气对应N1-HETE-His-Cbz与N3-HETE-His-Cbz,2-CEES对应N1-ETE-His-Cbz与N3-ETE-His-Cbz)。
采用子离子扫描进行二级质谱分析,对子离子进行筛选。在扣除背景后,HETE-His-Cbz有2个丰度较大的子离子,分别为m/z105、61,其中m/z105的峰面积大于m/z61,故选择m/z394>105为定量离子对,m/z394>61为定性离子对。ETE-His-Cbz仅有1个丰度较大的子离子m/z89,将其作为内标定量离子。同时对碎裂电压和碰撞能量等条件进行了优化,结果列于表1。

图1 芥子气暴露染毒样品制备与分析流程图Fig.1 Preparation and analysis flow diagram of HD exposed samples

图2 酶解温度(a)与酶解时间(b)对产物峰面积的影响Fig.2 Effects of digestion temperature (a) and digestion time (b) on peak area of target object
2.2 链霉蛋白酶酶解
链霉蛋白酶在pH 8左右时的酶解效率较高,但提取后的珠蛋白在pH 8的酶解液中溶解性较差,酶解体系为悬浮液。因此,酶解过程中需对体系进行振荡,以确保酶解体系的均一性。为提高链霉蛋白酶酶解珠蛋白产生HETE-His的效率,采用1 000 μg/L芥子气染毒的血红蛋白溶液(130 g/L)优化酶解温度、酶解时间和酶的浓度等参数。酶解温度(37、45、50、55、60、70 ℃)和酶解时间(0.5、1.0、2.0、3.0、4.0、6.0、8.0、10.0、12.0、14.0 h)对产物峰面积的影响示于图2。对不同浓度、不同批次的链霉蛋白酶进行考察,结果表明,3.00 g/L链霉蛋白酶就可以进行高效酶解,不同批次的链霉蛋白酶对酶解效率无明显影响(±5%)。因此,最终选择酶解温度55 ℃,酶解时间10.0 h。
2.3 固相萃取条件的优化
在芥子气染毒生物医学样品的分析中,SPE可以有效去除基质干扰,提高液相色谱-质谱的分析灵敏度[11,18]。本研究使用固相萃取柱对经酶解后的1 000 μg/L芥子气染毒血红蛋白溶液(130 μg/L)体系进行纯化。考察了2种强度不同的阴离子交换柱(PAX,NH2)与3种非极性固相萃取柱(HLB,ENV,PPL)的纯化效果。结果表明,PPL柱保留目标物、去除杂质的效果较好,结果示于图3,图中纵坐标为经SPE纯化后目标物的峰面积。该固相萃取柱的固定相为官能化苯乙烯-二乙烯基苯,对非极性化合物的保留具有较好效果。通过对淋洗、洗脱条件进行优化,最终确定最佳的淋洗条件为3.0 mL 5%甲醇水溶液(V/V),最佳洗脱条件为1.0 mL 50%甲醇水溶液(V/V)。
2.4 Cbz-Cl衍生
由于HETE-His的质谱响应较差,按照文献报道[15],使用Fmoc-Cl对HETE-His进行衍生。结果表明, Fmoc-Cl衍生后的HETE-His质谱响应仍较差,不能满足痕量芥子气染毒样品的溯源性分析要求。因此,尝试使用Cbz-Cl对HETE-His进行衍生,以提高质谱响应,结果示于图4。

图3 5种固相萃取柱优化结果Fig.3 Optimized results of 5 kinds of SPE column

图4 100 mg/L芥子气染毒血红蛋白中未经衍生(a),经Cbz-Cl衍生(b)和经Fmoc-Cl衍生(c)后的MRM色谱图Fig.4 UHPLC-MS/MS MRM chromatograms of 100 mg/L HD-spiked hemoglobin solution after underivatization (a), Cbz-Cl derivatization (b) and Fmoc-Cl derivatization (c)
2.5 2-CEES染毒血红蛋白溶液作为内标
使用芥子气模拟剂2-CEES染毒血浆作为内标,对芥子气-白蛋白加合物酶解后产生的HETE-CPF进行检测,可得到较好的定量结果[19]。本研究使用2-CEES染毒的血红蛋白作为内标,将其加入血红蛋白溶液中,与血红蛋白的组氨酸侧链发生反应,生成乙基硫乙基-血红蛋白加合物。乙基硫乙基-血红蛋白加合物经提取、酶解、衍生后,生成ETE-His-Cbz。ETE-His-Cbz的主要碎片离子m/z89为乙基硫乙基离子([ETE]+)形成的硫鎓离子,对应HETE-His-Cbz的主要碎片离子m/z105为羟乙基硫乙基离子([HETE]+)形成的硫鎓离子。另外,HETE-His-Cbz的碎片离子m/z61为[HETE]+的羟乙基以乙烯醇的形式断裂丢失后形成的碎片,ETE-His-Cbz的碎片离子m/z61为[ETE]+的乙基以乙烯的形式断裂丢失后形成的碎片,HETE-His-Cbz与ETE-His-Cbz的产物离子质谱图示于图5。上述结果表明,二者具有相似的质谱碎裂途径。因此,2-CEES染毒的血红蛋白可以作为芥子气-血红蛋白加合物定量检测的内标。

图5 HETE-His-Cbz(a)与ETE-His-Cbz(b)的产物离子质谱图Fig.5 Mass spectra of product ion for HETE-His-Cbz (a) and ETE-His-Cbz (b)
2.6 专一性考察
通过分析来自20个不同的未经芥子气暴露染毒的人空白全血样品,发现在HETE-His-Cbz保留时间的±0.1 min之内,m/z394>105和m/z394>61这两个离子对均不存在背景干扰。通过测定目标物的两个离子对峰面积比值(CIR,即定性离子对峰面积/定量离子对峰面积)对方法的专一性进行考察。结果表明,所有芥子气染毒全血样品的CIR范围在(15.0±2.4)%之间,表明本方法具有很好的专一性。
2.7 线性曲线与检出限
通过分析8个加入内标的标准曲线溶液,表明在芥子气染毒浓度10.0~1 000 μg/L范围内,HETE-His-Cbz/ETE-His-Cbz峰面积比具有良好的线性关系,平均标准曲线的线性方程为y=0.52x-1.47,相关系数R2>0.997。对线性范围以外的高浓度样品进行分析,发现目标物峰面积的增长速度减缓。根据定性离子对的信噪比确定本方法的检出限为10.0 μg/L(信噪比≈5),结果示于图6,比Edman降解法的检出限(20 nmol/L,约3.2 μg/L)略高,且Edman降解法的线性范围略宽(0.1~120 μmol/L,约15.9~1 908 μg/L,R2>0.99)[11]。
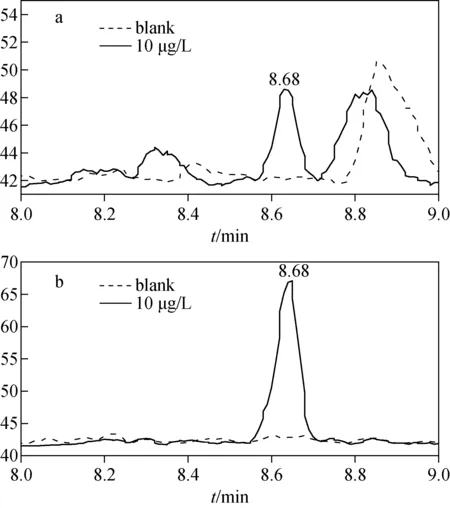
注:a.m/z 394>61;b.m/z 394>105图6 10.0 μg/L HD染毒与空白全血样品中HETE-His-Cbz加合物的色谱图Fig.6 MRM chromatograms of HETE-His-Cbz from 10.0 μg/L HD-spiked blood sample and blank sample
2.8 准确度与精密度考察
本实验分析了质量控制样品与标准曲线的日内、日间精密度和准确度,结果列于表2。日内的准确度范围是90.2%~105%,精密度≤10.3%;基于两周完成了9次分析运行数据,日间的准确度范围是89.8%~113%,精密度≤12.4%,能够满足准确度与精密度的相关要求[20]。
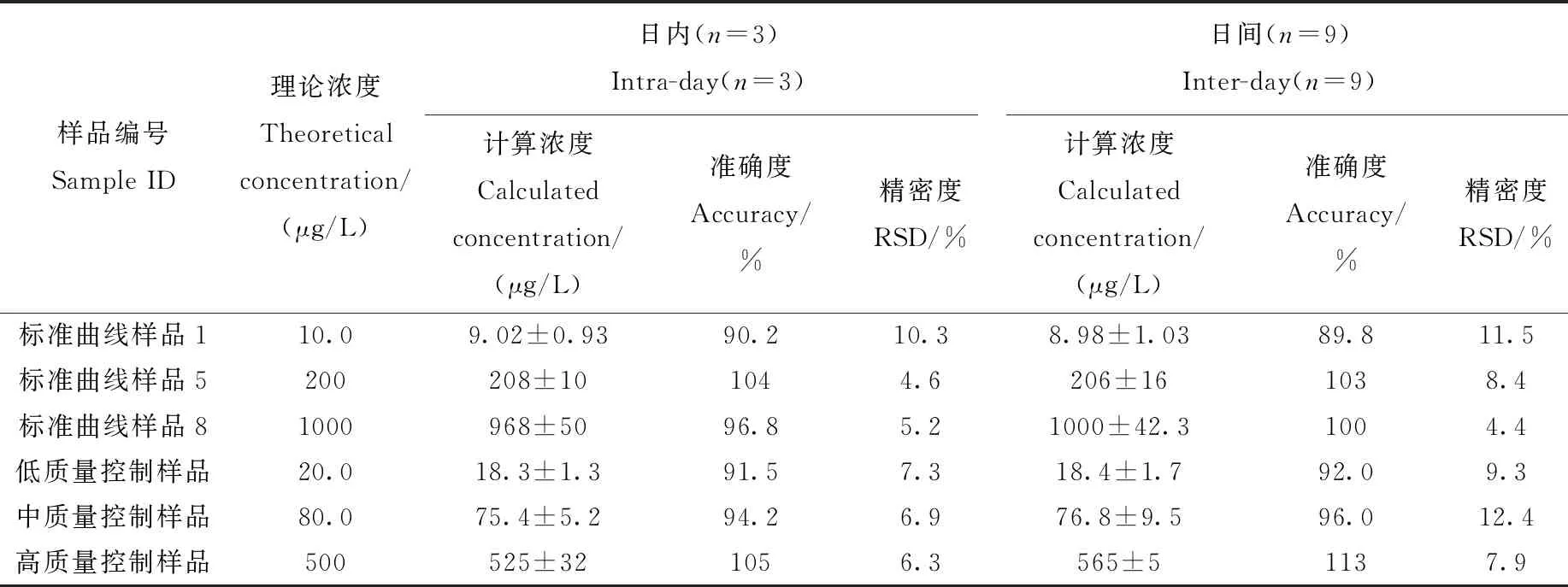
表2 方法的准确度与精密度Table 2 Accuracy and precision of this method
注:浓度均为芥子气染毒浓度
2.9 稳定性考察
将QCL、QCM、QCH全血样品等分3份,分别储存于4 ℃、室温以及37 ℃,一周后进行处理和分析,发现目标物在所有温度下放置一周的稳定性良好,测得的目标物误差为±15%。
将QCL、QCM、QCH全血样品在-20 ℃与4 ℃之间反复冻融10次,分析检测后,没有发现目标物,可能是全血样品反复冻融容易导致红细胞破裂发生溶血现象,使用生理盐水清洗红细胞时,导致血红蛋白损失。继续考察冻融次数对目标物的响应产生的影响,发现冻融1次后,仅在QCH中检测到目标化合物,且目标物峰面积与QCL初始响应相当。因此使用该方法分析检测全血样品时,需避免样品的反复冻融。
将QCL、QCM、QCH全血样品经样品制备后,对目标物在进样基质中的稳定性进行考察,发现目标物在所有温度下反复冻融后放置一周仍是稳定的,误差在±15%内,示于图7。
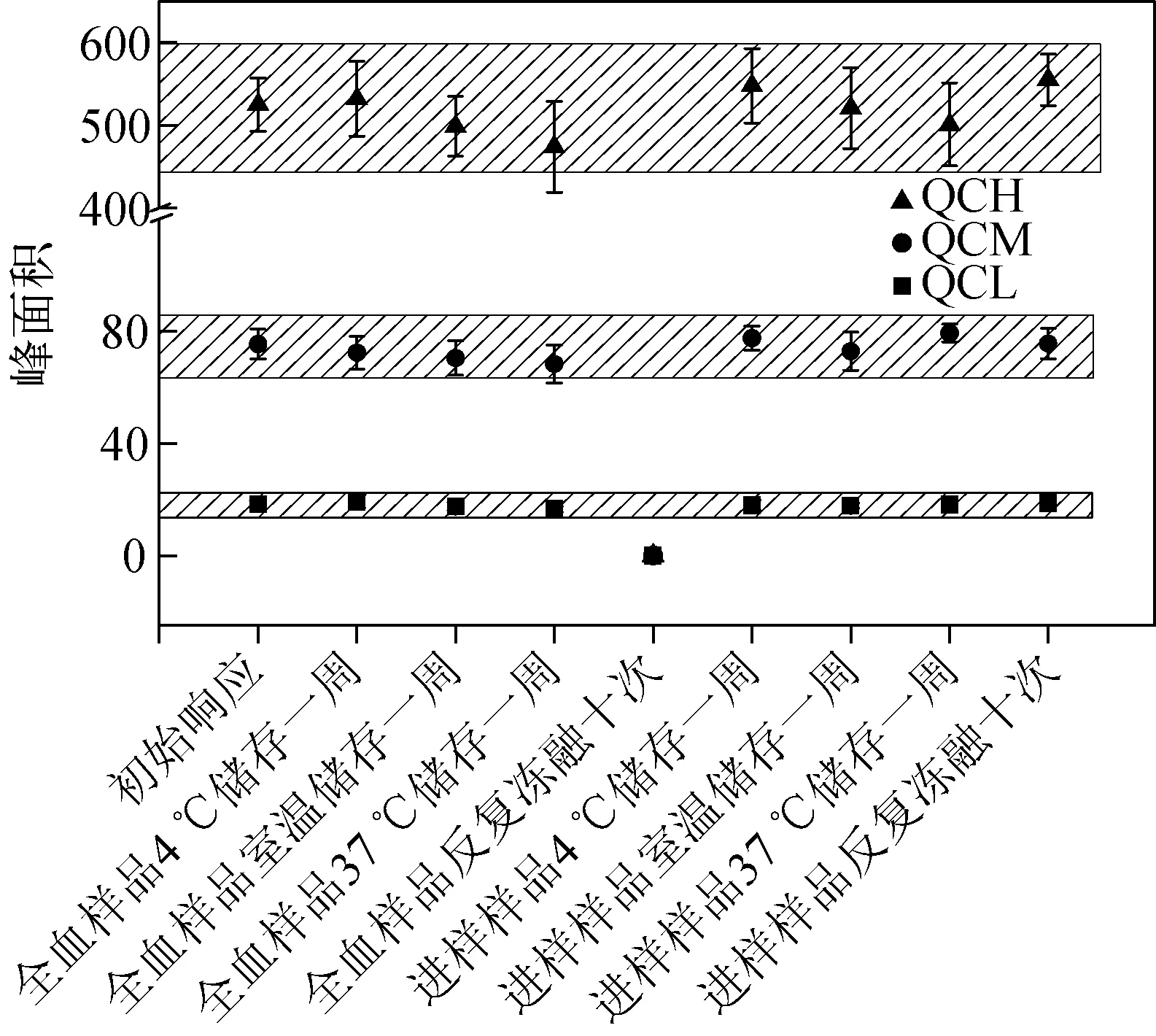
图7 稳定性考察Fig.7 Stability of this method
3 结论
本研究建立了一种高灵敏度溯源性定性、定量检测人全血中HD染毒血红蛋白加合物的方法。通过提取珠蛋白、链霉蛋白酶酶解、PPL柱纯化,将芥子气-血红蛋白加合物转化为HETE-His-Cbz,采用UHPLC-MS/MS进行分析检测。该方法仅需在55 ℃下保温10.0 h即可实现HD-HGB的完全水解,条件温和、操作简单,且检出限比传统酸解法降低大约150倍。通过考察20个空白的人全血样品,表明在目标物保留时间±0.1 min内无背景与基质干扰。对该方法的线性范围、检出限、准确度与精密度和稳定性进行考察,结果均能满足食品药品监督管理局生物分析方法验证指南[20],适用于临床样本的分析。

