食品致癌物杂环胺的生物标记物的研究进展
彭利娟
(武汉轻工大学 食品科学与工程学院,湖北 武汉 430023)
食品致癌物杂环胺的生物标记物的研究进展
彭利娟
(武汉轻工大学 食品科学与工程学院,湖北 武汉 430023)
摘要:高温烹调加工肉类食品过程中所产生的杂环胺(HAAs)是一类具有致突变,致癌作用的物质。相关流行病研究显示,长期摄入高温烹调的、富含HAAs的肉类食物,提升了前列腺癌、乳腺癌、肠癌的患病风险。但现有研究成果尚不能对HAAs的摄入与相关癌症风险的关系进行有效评估。寻找长效、稳定的生物标记物并建立高选择性、高灵敏度的检测方法是该项研究的关键所在。本综述着重讨论了可能应用于分子流行病学研究中HAAs的生物标记物,包括HAAs、HAA的代谢物、DNA加合物和蛋白质加合物。同时也对用于HAAs生物监控的分析方法进行了讨论。
关键词:杂环胺;致癌物;生物标记物;代谢物;加合物
1引言
在鱼肉、红肉、禽肉的高温烹饪处理过程中所产生的杂环胺(heterocyclic aromatic amines, HAAs)是一类之于人类及锯齿类动物具有致突变、致癌变作用的多环芳香族化合物。上世纪七十年代末,科学家Sugimura最先在熟鱼肉中发现了致突变物[1-2]。而迄今为止已有20余种HAAs在烹制后的肉食里被发现和研究。这些HAAs分为两大类(见图1)。第一类HAAs是分子结构中含有N-甲基-2-氨基咪唑基团,包括喹啉类(如:2-氨基-3-甲基咪唑并[4,5-f]喹啉,IQ)),喹喔类(如:2-氨基-3-甲基咪唑并[4,5-f]喹喔啉,IQx))和2-氨基-1-甲基-6-苯基咪唑并[4,5-b]吡啶(PhIP)等,被认为是氨基酸热降解产物吡啶或吡嗪与糖类及肌酸的反应产物,通常是在150―250℃的加工温度下产生[3];第二类HAAs包括2-氨基-9H-吡啶[2,3-b]吲哚(AαC)和2-氨基3-甲基-9H-吡啶[2,3-b]吲哚(MeAαC)等,一般在250℃以上的高温下生成,是蛋白质中谷氨酸和色氨酸的热分解产物[4]。HAAs产生的多寡取决于肉的品种,烹制的时间和温度等。PhIP和2-氨基-3,8-二甲基咪唑并[ 4 , 5 -f〗喹喔啉(MeIQx)是煎烤红肉时产生最多的两种HAAs[5-7]。有研究显示每克完全煮熟的猪肉里所含的PhIP可以高达480ng[6]。基于对国际上HAAs毒理数据的采集与汇总,国际癌症研究机构(International Agency for Research on Cancer, IARC)已将IQ归类为很可疑致癌物(2A级),而其他几种包括PhIP和MeIQx在内的HAAs则被定义为潜在类致癌物(2B级)[8]。而美国国家毒理学项目(National Toxicology Program)也在第11期致癌物报告(Report on Carcinogenesis, ROC)中将常见的HAAs合理地预测为人类致癌物[9]。
早期对于肉制品中HAAs的定性和定量分析是使用多级层析法将HAAs从公斤级的熟肉中分离提纯出来。每一步的纯化均用Ames细菌致突变测试法对突变物进行监控,最后使用NMR和质谱对分离出的致突变物进行结构定性[1]。但是这类研究方法非常耗费人力。1992年,Gross使用硅基树脂和混合阳离子交换/疏水树脂发展了多级固相萃取的方法对肉制品中的HAAs进行提取,提取出的HAAs经HPLC进一步分离后进行UV或荧光定量[10]。这一方法样品用量少、分析速度快、检测灵敏度高。近年来多级固相萃取方法已被广泛运用于各类肉制品中HAAs的提取。在结合使用液相色谱-多级质谱联用技术(LC-MS/MS)后,实现了对熟肉中超微量的HAAs(pg/g)进行定量检测[11]。

图1 HAAs的化学结构
目前国际上对HAAs的研究全面且深入,包括生物毒理的研究、分离提纯方法的优化、在各种肉食制品中含量的测定、不同加工方式和条件的影响、生物代谢方式、摄入量与致癌风险的关系等。
2HAAs的生物毒性和致癌机理
早期HAAs的生物毒性是使用Ames细菌致突变测试法进行致突变性测定。Ames细菌致突变测试法中,鼠伤寒沙门氏杆菌TA98菌株用于检测移码突变,而TAl00 菌株是检测碱基对改变突变。Ames鼠伤寒沙门氏杆菌试验显示HAAs更易导致移码突变,不同HAAs的致突变能力可相差上千倍。其中IQ和MeIQ是非常强的致突变物。但使用Ames测试法评估HAAs的致癌风险并不准确。例如,Ames测试显示MeIQx的致突变能力强过PhIP约100倍。但它们对于锯齿动物来说都是非常强的致癌物。长期喂食同等剂量的MeIQx和PhIP均诱发锯齿动物多部位的肿瘤[1]。
动物实验发现长期摄入HAAs可诱发锯齿动物口腔、肝脏、胃、肺、结直肠、膀胱、前列腺和乳腺等多种靶器官的肿瘤。各种HAA诱发肿瘤的总投喂量(TD50)差异很大,同种HAA对于不同种类动物的TD50也有差别。已有报道显示各HAA对锯齿动物的TD50在0.1―64.6 mg/kg/day[1]。
在研究HAAs对人类的风险时发现,HAAs会引发姐妹染色单体交换,微核形成和非常规DNA合成;同时锯齿动物体内实验及人细胞和锯齿动物细胞体外实验显示有些HAA可引发DNA的损伤和染色体的畸变[8,12]。人体内的HAAs在酶细胞色素P450的作用下N-羟基化,N-羟基化的HAA代谢物(HONH-HAA)再经二期酶N-乙酰转移酶(N-acetyltransferases, NATs)或硫转移酶(sulfotransferases, SULTs)的进一步激活产生nitrenium离子与DNA反应,诱发变异[13]。以PhIP为例示意如图2。
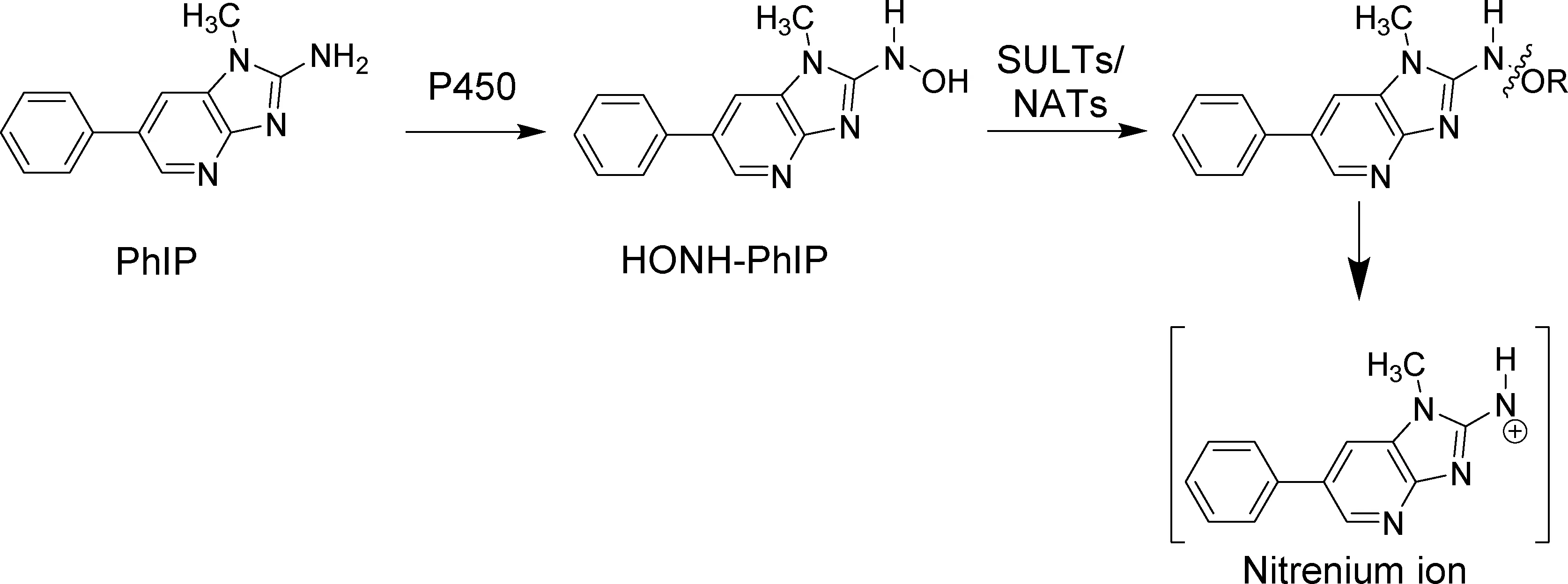
图2 PhIP在人体内的主要代谢途径
3生物标记物
现有流行病学研究的数据尚不足以对癌症和HAAs摄取之间的关系进行有效评估。有研究报告证实长期食用煮熟的肉类(含HAAs的肉制品)提高了患胃癌,结肠癌,胰腺癌,前列腺癌和乳腺癌的风险;但也有研究表明熟肉与癌症风险之间并不存在直接关联[14-20]。熟肉中产生的HAAs与癌症风险之间的联系之所以一直难以确定,一个最大的制约因素在于无法对长期摄入的HAAs做定量评估。因而确立稳定的、长期的生物标记物对于研究HAAs摄取与癌症风险关系的至关重要。
3.1HAAs在尿液中的代谢物
尿液样品通常可获取量较其他生物样本(如组织,血液,毛发等)多,其中所携带的致癌物及其代谢产物可在提取富集后用于对短期内相关致癌物摄入情况的评估。同时通过对致癌物的尿代谢物组成和结构的分析,可进一步了解致癌物在人体内的相关生物活化程度。
HAAs在尿液中主要是以其代谢物的形式存在。因为煎烤烹制的红肉中PhIP和MeIQx含量最多,所以早期对尿液代谢物的研究主要集中于这两种HAAs。PhIP在人尿中的主要代谢物是PhIP的N2-和N3-葡萄糖苷酸聚合物(PhIP-N2-Gl, PhIP-N3-Gl)和HONH-PhIP的N-葡萄糖苷酸聚合物(HON-PhIP-N2-Gl,HON-PhIP-N3-Gl)[21-22]。MeIQx的主要尿代谢物是MeIQx的氨基磺酸盐(MeIQx-N2-SO3H)、IQx-8-COOH, MeIQx的N2-葡萄糖苷酸聚合物(MeIQx-N2-Gl),和HONH-MeIQx的N3-葡萄糖苷酸聚合物(HON-MeIQx-N3-Gl)[23-24](见图3)。这些代谢物主要是在葡糖醛酸基转移酶(UDP-glucuronosyltransferases,UGTs)、酶细胞色素P450和SULTs的作用下产生。
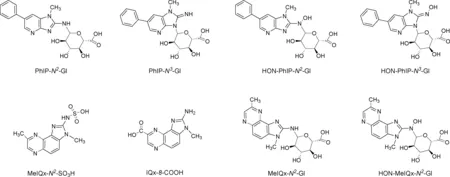
图3 PhIP和MeIQx的主要代谢物
目前从尿液中分离HAAs及其代谢物的分析方法包括:溶剂萃取[25],固相萃取(SPE)[26],免疫亲和[27]等。分离好的相关代谢物配合使用荧光,气相色谱-质谱联用(GC-MS)或LC-MS/MS进行定性定量分析。Gu等人使用SPE分离方法与超高效液相色谱-质谱联用技术(UPLC-MS)所建立的快速、高灵敏度的分析方法在测量PhIP和MeIQx的代谢物时,定量限低至10―40 pg/mL[28]。通常情况下人们摄入的HAAs大部分在24―48h内随尿液排出,所以尿液中所检测到的HAAs含量只能反映短期内HAAs的摄入情况。对比相关研究,不同个体的尿液中所检测到的HAAs含量差异特别大,这很可能是因为人们的吃食中所含HAAs的量存在差异[29-31]。
3.2毛发中HAAs
人和动物的毛发中已发现多种药物和污染物累积。人和动物的毛发已用于对尼古丁、麻醉剂和荷尔蒙等化合物的生物监控。动物实验发现PhIP在黑色素多的组织里沉积,标记的PhIP在摄入后4周还可以在毛发中检测到[25]。在6个月期间对两个杂食者的头发样本进行定期采集和分析发现,头发中PhIP的含量分别是407―545和669―855pg/g期[32]。不同时间测量的偏差小于24%,这说明PhIP的摄入与其在头发中的累积相对稳定。因而毛发里HAAs可用作生物标记物对长期的HAAs摄入情况进行评估。
PhIP是在头发中沉积最多的HAA,通常含量在60―7 500 pg/g。目前对于这么微量的HAAs的检测主要是选用高灵敏度的质谱手段结合各类萃取技术来进行。Alexander等人使用GC-MS对人发中的PhIP进行检测[25];而Kobayashi建立了LC-MS方法对人发中的PhIP进行定量[33]。这两种方法都需要上百毫克的头发样品。近期的研究通过同时使用溶剂萃取和固相萃取方法对头发中的HAAs进行分离,然后使用LC-MS/MS定量。该方法的头发样本用量只需50 mg, 定量限为50 pg/g[32]。使用该方法所检测到的PhIP含量与前两种方法相近。但是发现所测样本的AaC和MeIQx均低于定量限。
在检测人发中的PhIP时发现色素对PhIP有很强的亲和性,色素含量高的头发(深色头发)更利于PhIP的沉积。所以定量不同颜色头发中的PhIP来评估PhIP的长期摄入情况时应考虑这一因素。现代社会越来越多的人热衷于染发。使用染发剂进行染发的过程中,头发中累积的PhIP很可能会发生化学反应变化,导致其含量减少;同时染发剂中大量的化学物质可能进入头发中,这些化合物的存在会对PhIP的分离和检测产生极大的干扰,从而影响检测的灵敏度。近期高分辨率的Orbitrap质谱技术被用于对染色头发中的PhIP分析。该方法采用多级质谱手段消减染色剂化合物对PhIP检测的干扰。在对染色头发中的PhIP进行测量时,定量限达到84 pg/g[34]。
3.3DNA-HAA 加合物
HAAs与DNA的反应主要是通过HAAs的N-羟基化代谢物(HONH-HAAs)酯化后所产生的中间体nitrenium离子与脱氧鸟苷(dG)上C-8原子反应生成dG-C8-HAA加合物。实验室合成DNA-HAA加合物是使用乙烯酮或者乙酸酐作为酰化剂与HONH-HAA反应生成易形成nitrenium离子的活性N-乙酰化-HAA中间体[35-37]。N-乙酰化-HAA非常不稳定,目前只有N-乙酰化-PhIP通过质谱确定了分子结构[36]。体内和体外实验现已合成及检测到包括PhIP[36], IQ[37],MeIQ[38], MeIQx[39],2-氨基-3,4,8-三甲基咪唑[4,5-f]喹喔啉(4,8-DiMeIQx)[40], AαC和MeAαC[41]的dG-C8加合物(见图4)。
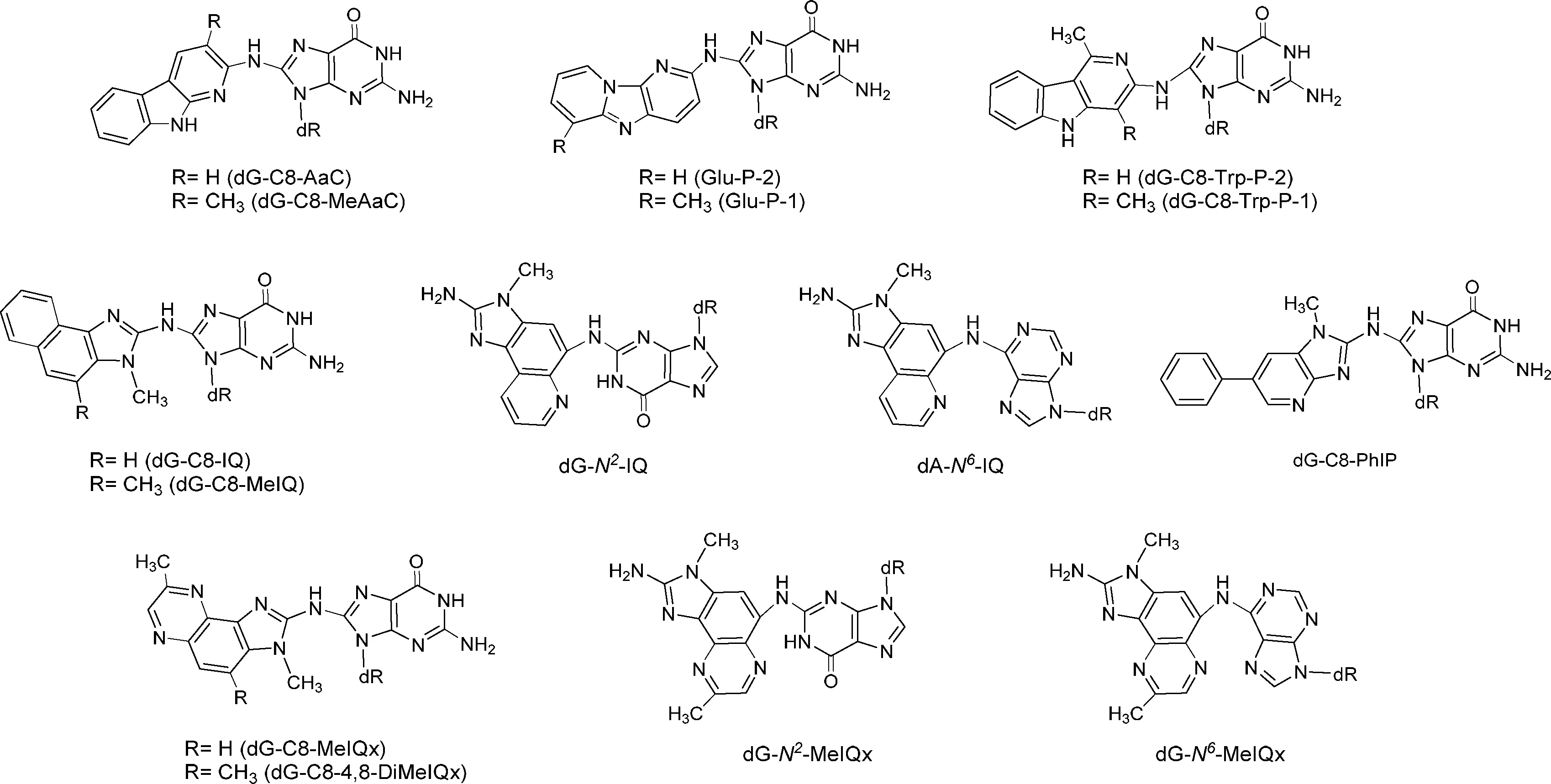
图4 DNA-HAA加合物的结构
体内和体外实验发现IQ与MeIQx杂环上的C-5原子也会与dG上的N2基团反应形成dG-N2加合物[39]。在使用dG或脱氧腺苷(dA)与N-乙酰化-IQ进行反应时生成了dG-N7-IQ和dA-N6-IQ加合物[42]。动物实验中发现老鼠的肝脏里有dA-N6-MeIQx加合物的存在[43]。
从理论上来说,选择标靶组织中DNA加合物作为生物标记物去评估HAAs的致癌风险最为直接、合理。目前研究所用到的人体组织样本经常是临床诊断过程中从患者体内所切除的病变组织。在进行检测分析时,一般假定病变组织中加合物的含量可反映癌变形成初期组织里加合物的含量。对于人体组织样本中DNA-HAA加合物含量的测定, 目前主要运用的技术手段包括32P-postlabeling, 免疫组织化技术(IHC)和质谱技术。
32P-postlabeling技术在检测DNA-HAA加合物方面非常灵敏。Totsuka等人使用该方法在人的直肠、结肠和肾脏中分别检测到含量为14,18和1.8个dG-C8-MeIQx加合物/1010核苷酸[44]。大部分乳腺癌产生于导管上皮细胞。Gorlewska-Roberts等人使用32P-postlabeling技术方法对剥落在人乳里面的导管上皮细胞中的DNA加合物进行了分析,64个来自于健康、不吸烟母亲的样本中有31个样本里检测到了DNA-PhIP加合物,平均含量在4.7个加合物/107核苷酸[45]。数据证实人们对熟肉的消耗量和NAT2都对DNA-PhIP的形成有潜在的影响。
人的乳腺组织中也发现了DNA-PhIP加合物。这一研究应用了IHC手段对乳腺癌患者和非乳腺癌患者的正常乳腺组织进行了分析检测,分别在82%的乳腺癌患者和71%非乳腺癌患者的组织样本中发现了DNA-PhIP加合物,含量高于1个加合物/107碱基[46]。
GC-MS方法检测DNA-HAA加合物是通过对在碱性环境下不稳定的dG-C8-HAA加合物水解后产生的HAAs进行定量。使用该方法对肠粘膜样本和肠癌患者的淋巴细胞样本进行分析发现每108个DNA碱基中的加合物在几个范围以内。其中30%的淋巴细胞样本中检测到dG-C8-PhIP加合物。比较吸烟者、食肉多的人、和食肉少的人的淋巴样本,并未发现前二者加合物的含量明显高过后者[47]。由于该项研究没有个体的实际PhIP摄入量信息,因而无法确定DNA-PhIP加合物形成与PhIP摄入之间的关系。
上述的几种检测方法都不能准确提供DNA加合物的结构信息。近年来高选择性,高灵敏度液相色谱质谱联用技术(LC-MS)发展迅猛,可以对人组织样本中的DNA加合物进行准确结构定性和含量分析。Gu等人使用该方法对乳腺癌患者的乳腺组织中的DNA-PhIP加合物进行了分析,数据显示70个组织样本中,只有一个样本检测到了dG-C8-PhIP加合物,其含量为3个加合物/109核苷酸[48]。这一含量远低于32P-postlabeling和IHC方法检测到的含量(差两个数量级)。这表明非选择性的32P-postlabeling和IHC方法可能检测到了除dG-C8-PhIP加合物以外的DNA损伤。因此,对dG-C8-HAA或其他已知结构的加合物应选用LC-MS进行有选择性的定量分析。
3.4蛋白质-HAA 加合物
由于检测人体组织中的DNA加合物需要大批量的活检标本通常难以获得;同时DNA加合物在形成后经常会被修复,因此人体组织中DNA加合物的含量可能极低,即使运用现今高灵敏度的检测手段也可能难以进行有效的定量分析。近年来已有研究采用血红蛋白(Hb)及血清白蛋白(SA)与致癌物形成的加合物取代DNA加合物作为生物标记物对几类致癌物质进行生物监控[49-52]。相较于DNA加合物,蛋白质加合物作为生物标记物的优势在于:(1)血液中能提取的蛋白质量远大于DNA的量。10 mL人血中可提取DNA的量只有100 μg左右,而Hb或SA的提取量高达几百毫克。相应地,能获取到的蛋白质加合物也就更多。(2)蛋白质加合物不会被修复。在蛋白质加合物稳定的情况下,长期摄入致癌物所形成的蛋白质加合物将在蛋白质的生命周期内进行积累。人Hb的生命周期为120天,如果长期摄入致癌物,人体内蛋白质加合物含量将是单次摄入的60倍。这将大大提高加合物检测的灵敏度[49]。但在选用蛋白质加合物作为生物标记物研究癌症风险时,需要考虑蛋白质加合物并不表征基因损伤情况,也不是产生于标靶位置。
在过去的三十年中,Hb和SA与多类不同的人体致癌物所形成的加合物已替代DNA加合物,被用作人体生物标记物对相关致癌物进行生物监控。多种芳香胺在人和实验室动物体内与Hb形成了Hb-芳香胺加合物。通过对吸烟和不吸烟人群体内Hb-芳香胺加合物进行检测,发现这种生物标记物与膀胱癌有很强的关联性[53-54]。HAAs与Hb加合物的形成是通过其N-氧化代谢物先与氧合血红蛋白(HbO2)反应生成N-亚硝化代谢物和高铁血红蛋白(met-Hb),然后该N-亚硝化代谢物与Hb的β链上第93位的半胱氨酸(Cys93)反应形成加合物。近期有体外实验研究显示AαC的N-羟基化代谢物(HONH-AαC)可引发高铁血红蛋白症,并产生Hb-AαC加合物。但PhIP和MeIOx的N-羟基化代谢物HONH-PhIP和HONH-MeIOx并没有与HbO2反应产生加合物[55]。 Glu-P-1的N-羟基化代谢物和N-亚硝化代谢物也证实与Hb上的巯基反应[56]。而动物实验显示包括IQ、 MeIQx和PhIP在内的几种HAAs在摄入后,只有很少的一部分(约摄入量的0.01%)与动物体内的Hb反应产生蛋白质加合物[57-59]。这些Hb-HAA加合物在人体内含量过低,无法进行定量检测[60]。因而选用人体内的Hb-HAA加合物作为致癌物HAAs的生物标记物可能并不理想。
SA具有结合和运输内源性与外源性物质,维持血液胶体渗透压,清除自由基,抑制血小板聚集和抗凝血等生理功能,在生命过程中有极其重要的意义。SA的肽链包含585个氨基酸,是血浆中含量最高的蛋白质,约占血浆总蛋白的60%。研究显示SA与氰化物,氮芥,神经毒素双鞭甲藻毒素B等多种有毒、致癌试剂生成蛋白质加合物[61-63]。SA的Cys34上拥有整个蛋白质肽链上唯一的自由巯基(-SH)。大量研究证实这一自由巯基对各种毒性化合物的代谢产物具有反应活性。包括IQ、MeIOx和PhIP在内的几种HAAs与锯齿类动物的SA或人血清白蛋白(HSA)上的Cys34发生反应形成SA-HAA加合物[60, 64-65]。这类SA-HAA加合物在酸性环境下不稳定,易水解释放HAAs。近期的体外实验证实了这些加合物是HAA的代谢物通过亚磺酰胺形式链接于SA的Cys34上而形成[66]。SA-HAA加合物在体内形成的过程以PhIP为例: 首先PhIP的N-氧化代谢物HONH-PhIP在细胞色素P450酶或过渡金属的作用下氧化生成N-亚硝化代谢物(NO-PhIP), NO-PhIP能与SA上的Cys34结合形成蛋白质加合物(图5)。
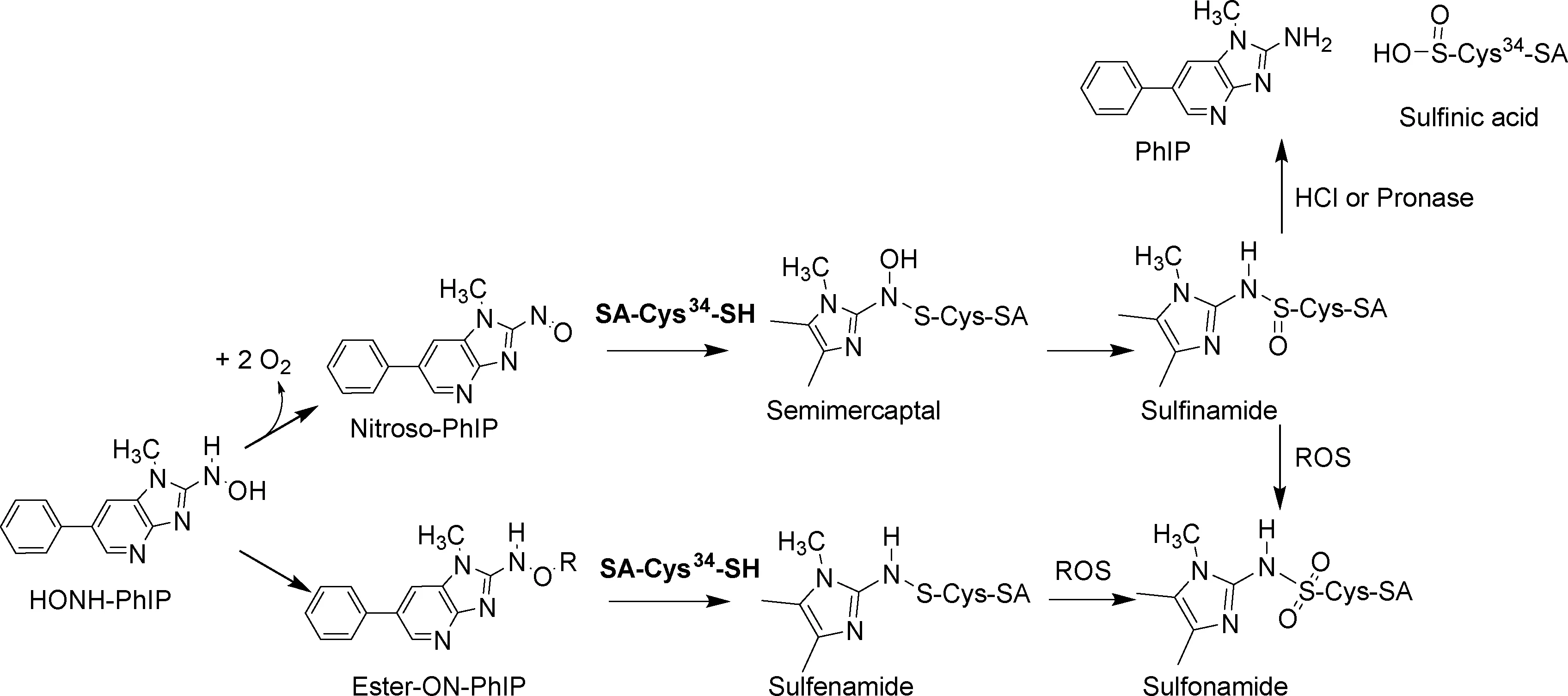
图5 PhIP代谢物与SA反应形成的SA-PhIP加合物 (ROS:活性氧化物)
加速器质谱(Accelerated Mass Spectrometry, AMS)检测方法发现人血中HSA-PhIP加合物的含量远高于HSA-MeIQx加合物。人血中每毫克HSA所含的HSA-PhIP加合物量在飞摩尔级(fmol), 食肉人群血液中的加合物的含量是素食人群的10倍[60]。UPLC-MS检测方法对HSA-PhIP加合物的检测定量限可达300 fmol /mg HSA[67]。但对于临床血样的检测, 这一方法还需要进一步优化。
4结束语
近年来高分辨率,高灵敏度LC-MS技术的迅速发展,实现了对人体内HAAs的代谢产物、DNA加合物和蛋白质加合物的定性和定量分析。通过检测尿液中HAAs代谢物可了解HAAs在人体内的活化程度和短期内个体对HAAs的摄入情况。头发中沉积的HAAs可提供个体在长时间内对HAAs的摄入情况。相关实验显示HAAs与血浆中的SA及白细胞中的DNA所形成的加合物可用做生物标记物研究HAAs的摄入与相关癌症风险之间的关系。在流行病学研究中,对这些HAAs的生物标记物进行监控,有助于对HAAs的致癌风险进行合理评估。
参考文献:
[1]Sugimura T, Wakabayashi K, Nakagama H, et al. Heterocyclic amines: Mutagens/carcinogens produced during cooking of meat and fish[J]. Cancer Sci, 2004,95: 290-299.
[2]Turesky R J. The role of genetic polymorphisms in metabolism of carcinogenic heterocyclic aromatic amines[J]. Current drug metabolism, 2004,5: 169-180.
[3]Skog K I, Johansson M A, Jagerstad M I. Carcinogenic heterocyclic amines in model systems and cooked foods: a review on formation, occurrence and intake[J]. Food Chem Toxicol, 1998,36: 879-896.
[4]Matsumoto T, Yoshida D, Tomita H. Determination of mutagens, amino-alphacarbolines in grilled foods and cigarette smoke condensate[J]. Cancer Lett, 1981, 12: 105-110.
[5]Guy P A, Gremaud E, Richoz J, et al. Quantitative analysis of mutagenic heterocyclic aromatic amines in cooked meat using liquid chromatography-atmospheric pressure chemical ionisation tandem mass spectrometry[J]. J Chromatogr A ,2000, 883: 89-102.
[6]Felton J S,Jagerstad M,Knize M G,et al. Food Borne Carcinogens Heterocyclic Amines [M]. Chichester, England: John Wiley & Sons Ltd., 2000:31-71.
[7]Turesky R J, Taylor J, Schnackenberg L, et al. Quantitation of carcinogenic heterocyclic aromatic amines and detection of novel heterocyclic aromatic amines in cooked meats and grill scrapings by HPLC/ESI-MS[J]. J Agric Food Chem, 2005, 53:3248-3258.
[8]International Agency for Research on Cancer. IARC Monographs on the Evaluation of Carcinogenic Risk of Chemicals to Humans[R]. Lyon, France: IARC, 1993:165-242.
[9]National Toxicology Program. Report on Carcinogenesis(Eleventh Edition)[R]. Research Triangle Park, N.C.: U.S. Department of Health and Human Services, Public Health Service, 2005.
[10]Gross G A, Gruter A. Quantitation of mutagenic/carcinogenic heterocyclic aromatic amines in food products[J]. J Chromatogr,1992, 592: 271-278.
[11]Ni W, McNaughton L, LeMaster D M, et al. Quantitation of 13 heterocyclic aromatic amines in cooked beef, pork, and chicken by liquid chromatography-electrospray ionization/tandem mass spectrometry[J]. J Agric Food Chem,2008, 56(1):68-78.
[12]National Toxicology Program. Report on Carcinogenesis Background Document for Heterocyclic Amines: PhIP, MeIQ and MeIQx[R]. Research Triangle Park, N.C.: U.S. Department of Health and Human Services, Public Health Service, 2002.
[13]Turesky R J, Le Marchand L. Metabolism and biomarkers of heterocyclic aromatic amines in molecular epidemiology studies: lessons learned from aromatic amines[J]. Chem Res Toxicol, 2011, 24:1169-1214.
[14]Augustsson K, Skog K, Jagerstad M, et al. Dietary heterocyclic amines and cancer of the colon, rectum, bladder, and kidney: a population-based study[J].Lancet, 1999, 353(9154): 703-707.
[15]Alaejos M S, Gonzalez V, Afonso A M. Exposure to heterocyclic aromatic amines from the consumption of cooked red meat and its effect on human cancer risk: a review[J]. Food Addit Contam Part A Chem Anal Control Expo Risk Assess,2008, 25: 2-24.
[16]De Stefani E, Ronco A, Mendilaharsu M, et al. Meat intake, heterocyclic amines, and risk of breast cancer: a case-control study in Uruguay[J]. Cancer Epidemiol Biomarkers Prev ,1997, 6(8), 573-581.
[17]Delfino R J, Sinha R, Smith C, et al. Breast cancer, heterocyclic aromatic amines from meat and N-acetyltransferase 2 genotype[J]. Carcinogenesis ,2000, 21(4):607-615.
[18]Sinha R. An epidemiologic approach to studying heterocyclic amines[J]. Mutat Res,2002, 506-507:197-204.
[19]Knize M G, Felton J S. Formation and human risk of carcinogenic heterocyclic amines formed from natural precursors in meat[J]. Nutr Rev,2005,63(5):158-165.
[20]Zheng W, Lee S A. (2009) Well-done meat intake, heterocyclic amine exposure, and cancer risk[J]. Nutr Cancer, 2005, 61:437-446.
[21]Kulp K S,Knize M G,Fowler N D,et al. PhIP metabolites in human urine after consumption of wellcooked chicken[J]. J Chromatogr B Analyt Technol Biomed Life Sci,2004, 802:143-153.
[22]Walters D G,Young P J, Agus C,et al. Cruciferous vegetable consumption alters the metabolism of the dietary carcinogen 2-amino-1-methyl-6-phenylimidazo[4,5-b]pyridine (PhIP) in humans [J]. Carcinogenesis ,2004, 25:1659-1669.
[23]Turesky R J, Garner R C, Welti D H, et al.Metabolism of the food-borne mutagen 2-amino-3,8-dimethylimidazo[4,5-f]quinoxaline in humans[J]. Chem Res Toxicol,1998, 11: 217-225.
[24]Turesky R J,Guengerich F P,Guillouzo A, et al. Metabolism of heterocyclic aromatic amines by human hepatocytes and cytochrome P4501A2[J]. Mutat Res,2002, 506-507:187-195.
[25]Alexander J, Reistad R, Hegstad S, et al. Biomarkers of exposure to heterocyclic amines: approaches to improve the exposure assessment[J]. Food Chem Toxicol,2002, 40: 1131-1137.
[26]Holland R D, Taylor J, Schoenbachler L, et al. Rapid biomonitoring of heterocyclic aromatic amines in human urine by tandem solvent solid phase extraction liquid chromatography electrospray ionization mass spectrometry[J]. Chem Res Toxicol, 2004, 17:1121-1136.
[27]Stillwell W G, Kidd L C,Wishnok J S,et al. Urinary excretion of unmetabolized and phase II conjugates of 2-amino-1-methyl-6-phenylimidazo[4,5-b]pyridine and 2-amino-3,8-dimethylimidazo[4,5-f]quinoxaline in humans: Relationship to cytochrome P450 1A2 and N-acetyltransferase actvity[J]. Cancer Res,1997, 57: 3457-3464.
[28]Gu D, Raymundo M M, Kadlubar F F,et al. Ultraperformance liquid chromatography-tandem mass spectrometry method for biomonitoring cooked meat carcinogens and their metabolites in human urine[J]. Anal Chem,2011, 83(3):1093-101.
[29]Ushiyama H, Wakabayashi K, Hirose M, et al. Presence of carcinogenic heterocyclic amines in urine of healthy volunteers eating normal diet, but not of inpatients receiving parenteral alimentation[J]. Carcinogenesis ,1991, 12: 1417-1422.
[30]Ji H,Yu M C, Stillwell W G, et al. Urinary excretion of 2-amino-3,8-dimethylimidazo[4,5-f]quinoxaline in white, black, and Asian men in Los Angeles County[J]. Cancer Epidemiol Biomarkers Prev,1994, 3: 407-411.
[31]Kidd L C, Stillwell W G., Yu M C, et al. Urinary excretion of 2-amino-1-methyl-6-phenylimidazo[4,5-b]pyridine(PhIP) in White, African-American, and Asian-Americanmen in Los Angeles County[J]. Cancer Epidemiol Biomarkers Prev,1999, 8: 439-445.
[32]Bessette E E, Yasa I, Dunbar D, et al. Biomonitoring of carcinogenic heterocyclic aromatic amines in hair: a validation study[J]. Chem Res Toxicol,2009, 22(8):1454-63.
[33]Kobayashi M, Hanaoka T, Hashimoto H,et al. 2-Amino-1-methyl-6-phenylimidazo[4,5-b]pyridine(PhIP) level in human hair as biomarkers for dietary grilled/stir-fried meat and fish intake[J]. Mutat Res,2005, 588:136-142.
[34]Guo J, Yonemori K, Le Marchand L,et al. Method to Biomonitor the Cooked Meat Carcinogen 2-Amino-1-methyl-6-phenylimidazo[4,5-b]pyridine in Dyed Hair by Ultra-Performance Liquid Chromatography-Orbitrap High Resolution Multistage Mass Spectrometry[J]. Anal Chem,2015, 87(12):5872-5877.
[35]Turesky R J, Lang N P, Butler M A, et al. Metabolic activation of carcinogenic heterocyclic aromatic amines by human liver and colon[J]. Carcinogenesis,1991, 12:1839-1845.
[36]Frandsen H, Grivas S, Andersson R, et al. Reaction of the N2-acetoxy derivative of 2-amino-1-methyl-6-phenylimidazo[4,5-b]pyridine(PhIP) with 20-deoxyguanosine and DNA. Synthesis and identification of N2-(20-deoxyguanosin-8-yl)-PhIP[J]. Carcinogenesis ,1992, 13: 629-635.
[37]Snyderwine E G., Roller P P, Adamson R Het al. Reaction of the N-hydroxylamine and N-acetoxy derivatives of 2-amino-3-methylimidazo[4,5-f]quinoline with DNA. Synthesis and identification of N-(deoxyguanosin-8-yl)-IQ[J]. Carcinogenesis,1988, 9:1061-1065.
[38]Tada A,Ochiai M,Wakabayashi K,et al. Identification of N-(deoxyguanosin-8-yl)-2-amino-3,4-dimethylimidazo[4,5-f]quinoline(dG-C8-MeIQ) as a major adduct formed by MeIQ with nucleotides in vitro with DNA in vivo[J]. Carcinogenesis ,1994, 15:1275-1278.
[39]Turesky R J, Rossi S C, Welti D H, et al. Characterization of DNA adducts formed in vitro by reaction of N-hydroxy-2-amino-3-methylimidazo[4,5-f]quinoline and N-hydroxy-2-amino-3,8-dimethylimidazo[4,5-f]quinoxaline at the C-8 and N2atoms of guanine[J]. Chem Res Toxicol,1992, 5: 479-490.
[40]Frandsen H,Grivas S,Turesky R J,et al. Formation of DNA adducts by the food mutagen 2-amino-3,4,8-trimethyl-3H-imidazo[4,5-f]quinoxaline in vitro and in vivo. Identification of a N2-(2’-deoxyguanosin-8-yl)-4,8-DiMeIQx adduct[J]. Carcinogenesis,1994, 15: 2553-2558.
[41]Frederiksen H,Frandsen H, Pfau W. Syntheses of DNA-adducts of two heterocyclic amines, 2-amino-3-methyl-9Hpyrido[2,3-b]indole(MeAαC) and 2-amino-9H-pyrido[2,3-b]indole-(AαC) and identification of DNA-adducts in organs from rats dosed with MeAαC[J]. Carcinogenesis,2004, 25: 1525-1533.
[42]Jamin E L,Arquier D, Canlet C, et al. New insights in the formation of deoxynucleoside adducts with the heterocyclic aromatic amines PhIP and IQ by means of ion trap MSn and accurate mass measurement of fragment ions[J]. J Am Soc Mass Spectrom,2007, 18:2107-2118.
[43]Bessette E E, Goodenough A K,Langouet S,et al. Screening for DNA adducts by data-dependent constant neutral loss-triple stage mass spectrometry with a linear quadrupole ion trap mass spectrometer[J]. Anal Chem,2009, 81:809-819.
[44]Totsuka Y,Fukutome K,Takahashi M,et al. Presence of N2-(deoxyguanosin-8-yl)-2-amino-3,8-dimethylimidazo[4,5-f] quinoxaline (dG-C8-MeIQx) in human tissues[J]. Carcinogenesis,1996, 17: 1029-1034.
[45]Gorlewska Roberts K,Green B,Fares M,et al.Carcinogen-DNA adducts in human breast epithelial cells[J]. Environ Mol Mutagen,2002, 39: 184-192.
[46]Zhu J, Chang P,Bondy M L,et al. Detection of 2-amino-1-methyl-6-phenylimidazo[4,5-b]pyridine-DNA adducts in normal breast tissues and risk of breast cancer[J].Cancer Epidemiol Biomarkers Prev,2003, 12:830-837.
[47]Friesen M D,Kaderlik K,Lin D,et al.Analysis of DNA adducts of 2-amino-1-methyl-6-phenylimidazo[4,5-b]pyridine in rat and humantissues by alkaline hydrolysis and gas chromatography/electroncapture mass spectrometry: validation by comparison with32Ppostlabeling[J]. Chem Res Toxicol,1994, 7:733-739.
[48]Gu D, Turesky R J, Tao Y, et al. DNA adducts of 2-amino-1-methyl-6-phenylimidazo[4,5-b]pyridine and 4-aminobiphenyl are infrequently detected in human mammary tissue by liquid chromatography/tandem mass spectrometry[J]. Carcinogenesis,2012, 33(1):124-130.
[49]Skipper P L,Tannenbaum S R. Protein adducts in the molecular dosimetry of chemical carcinogens[J]. Carcinogenesis, 1990, 11:507-518.
[50]Skipper P L,Peng X,SooHoo C K, et al. Protein adducts as biomarkers of human carcinogen exposure[J]. Drug Metab Rev,1994, 26:111-124.
[51]Liebler D C. Proteomic approaches to characterize protein modifications: new tools to study the effects of environmental exposures[J]. Environ Health Perspect,2002,110 (Suppl 1):3-9.
[52]Tornqvist M,Fred C,Haglund J,et al. Protein adducts: quantitative and qualitative aspects of their formation, analysis and applications[J]. J Chromatogr B Analyt Technol Biomed Life Sci,2002, 778:279-308.
[53]Skipper P L,Tannenbaum S R,Ross R K,et al.Nonsmoking-related arylamine exposure and bladder cancer risk[J]. Cancer Epidemiol Biomarkers Prev,2003, 12: 503-507.
[54]Gan J,Skipper P L,Gago Dominguez M,et al.Alkylaniline-hemoglobin adducts and risk of non-smoking-related bladder cancer[J].J Natl Cancer Inst,2004, 96: 1425-1431.
[55]Pathak K V, Chiu T L, Amin E A,et al. Methemoglobin Formation and Characterization of Hemoglobin Adducts of Carcinogenic Aromatic Amines and Heterocyclic Aromatic Amines[J]. Chem Res Toxicol,2016, 29(3):255-69.
[56]Umemoto A,Monden Y,Tsuda M,et al. Oxidation of the 2-hydroxyamino derivative of 2-amino-6-methyl-dipyrido[1,2-a: 30,20-d] imidazole(Glu-P-1) to its 2-nitroso form, an ultimate form reacting with hemoglobin thiol groups[J]. Biochem Biophys Res Commun, 1988, 151: 1326-1331.
[57]Turesky R J,Skipper P L,Tannenbaum S R.Binding of 2-amino-3-methylimidazo[4,5-f]quinoline to hemoglobin and albumin in vivo in the rat. Identification of an adduct suitable for dosimetry[J]. Carcinogenesis, 1987, 8: 1537-1542.
[58]Lynch A M,Murray S, Boobis A R,et al. The measurement of MeIQx adducts with mouse haemoglobin in vitro and in vivo: implications for human dosimetry[J]. Carcinogenesis,1991, 12:1067-1072.
[59]Dingley K H,Freeman S P,Nelson D O,et al. Covalent binding of 2-amino-3,8-dimethylimidazo[4,5-f]quinoxaline to albumin and hemoglobin at environmentally relevant doses. Comparison of human subjects and F344 rats[J]. Drug Metab Dispos,1998, 26:825-828.
[60]Dingley K H,Curtis K D,Nowell S,et al. DNA and protein adduct formation in the colon and blood of humans after exposure to a dietary-relevant dose of 2-amino-1-methyl-6-phenylimidazo[4,5-b]pyridine[J]. Cancer Epidemiol Biomarkers Prev, 1999, 8: 507-512.
[61]Fasco M J,Iii C R,Stack R F,et al. Cyanide adducts with human plasma proteins: albumin as a potential exposure surrogate[J]. Chem Res Toxicol,2007, 20: 677-684.
[62]Noort D,Hulst A G., Jansen R. Covalent binding of nitrogen mustards to the cysteine-34 residue in human serum albumin[J]. Arch Toxicol,2002,76: 83-88.
[63]Wang Z, Ramsdell J S.Analysis of interactions of brevetoxin-B and human serum albumin by liquid chromatography/mass spectrometry[J]. Chem Res Toxicol,2011, 24:54-64.
[64]Green L C,Skipper P L,Turesky R J,et al. In vivo dosimetry of 4-aminobiphenyl in rats via a cysteine adduct in hemoglobin[J]. Cancer Res,1984, 44: 4254-4259.
[65]Lynch A M,Murray S,Zhao Ket al. Molecular dosimetry of the food-borne carcinogen MeIQx using adducts of serum albumin[J]. Carcinogenesis, 1993, 14:191-194.
[66]Peng L, Turesky R J. Mass spectrometric characterization of 2-amino-1-methyl-6-phenylimidazo[4,5-b]pyridine N-oxidized metabolites bound at Cys34of human serum albumin[J]. Chem Res Toxicol,2011, 24(11):2004-2017.
[67]Peng L, Turesky R J. Optimizing proteolytic digestion conditions for the analysis of serum albumin adducts of 2-amino-1-methyl-6-phenylimidazo[4,5-b]pyridine, a potential human carcinogen formed in cooked meat[J]. J Proteomics,2014, 103:267-78.
Biomarkers of food-borne carcinogen heterocyclic aromatic amines
PENGLi-juan
(School of Food Science and Engineering, Wuhan Polytechnic University, Wuhan 430023, China)
Abstract:Heterocyclic aromatic amines (HAAs) are carcinogens and mutagens that are formed during the high-temperature cooking of meats. A number of studies have reported a positive association between well-done meat consumption and cancer risks of the human prostate, mammary and colon. However, the association of HAAs formed in cooked meat and cancer risks has been difficult to establish. There is a critical need to establish stable, long-term biomarkers of HAAs, and develop corresponding methods with high selectivity and sensitivity. In this review, we highlight the biomarkers of HAAs that may be implemented in molecular epidemiology studies, including HAAs, their metabolites, DNA adducts and protein adducts. The advanced analytical approaches that have been successfully developed to biomonitor biological effects of these chemicals are also discussed.
Key words:heterocyclic aromatic amine (HAA); carcinogen; biomarker;metabolite; adduct
收稿日期:2016-03-30.
作者简介:彭利娟(1974-),女,博士,副教授, E-mail: lijuan_peng@hotmail.com.
基金项目:国家自然科学基金项目(21405118).
文章编号:2095-7386(2016)02-0001-11
DOI:10.3969/j.issn.2095-7386.2016.02.001
中图分类号:TS 201.2;TS 201.6
文献标识码:A

