苯并[a]芘及其代谢产物与DNA加合物检测方法的研究进展
王珠琳,袁莉,张萌
(陕西师范大学 食品工程与营养科学学院,陕西 西安,710119)
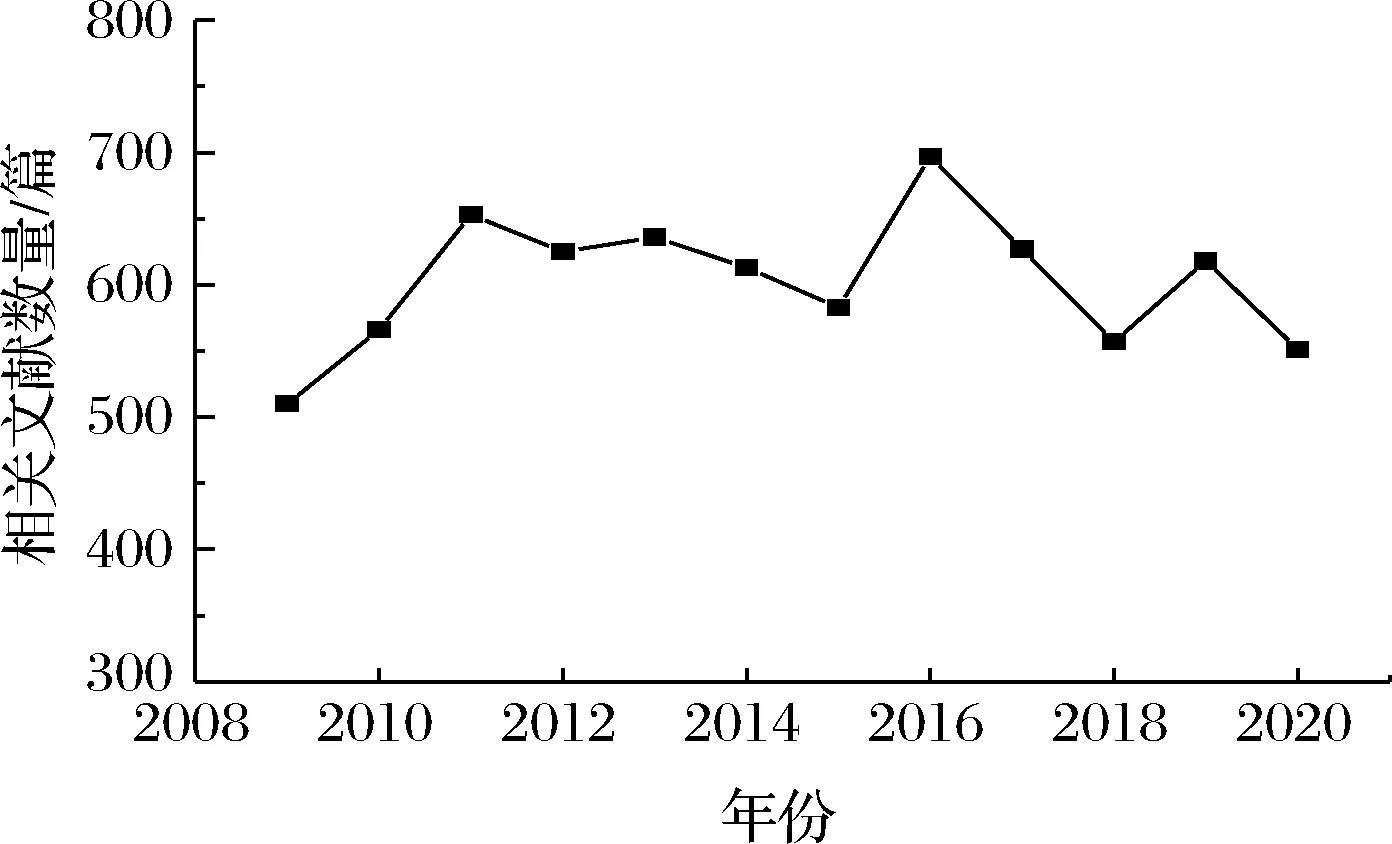
近几年,关于苯并[a]芘及其代谢产物与DNA加合物的相关研究文献数量变化如图1所示,由图1可知关于苯并[a]芘及其代谢产物与DNA加合物的研究一直处于备受关注的状态。随着科技水平的提高,苯并[a]芘及其代谢产物与DNA加合物的检测技术有待进一步突破,从而加深对苯并[a]芘及其代谢产物与DNA加合物毒性作用的研究,为保障人体健康作出贡献。
1 苯并[a]芘概述
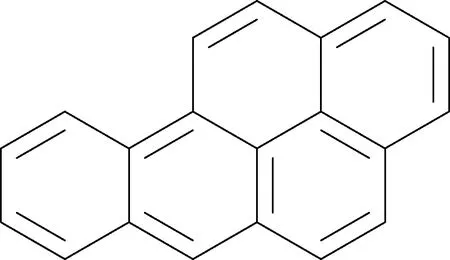
苯并芘(benzopyrene)是由芘和苯稠合而成的一类多环芳香烃类化合物[1],主要有1,2-苯并芘、3,4-苯并芘、4,5-苯并芘等[2]。苯并[a]芘(benzo[a]pyrene,B[a]P)又称3,4-苯并芘,分子式为C20H12,相对分子质量为252.31,在常温条件下,为晶状固体,呈浅黄色,沸点为312 ℃,熔点为179 ℃[3],其化学结构式如图2所示。B[a]P是苯并芘中毒性(致癌性、致畸性和致突变性)最强且难降解的一种化合物[4],同时也是多环芳烃的指标化合物。
2 B[a]P检测时样品前处理方法
为了提高检测方法的灵敏度、精确度,减少非待测组分的干扰,通常要对食品或环境中的B[a]P进行前处理。可根据待测样品的特性选择最佳的前处理方法,有助于待测物的检测。检测B[a]P的前处理方法主要有固相萃取法、固相微萃取法、液液萃取法、浊点萃取法、凝胶渗透色谱法、分子印迹固相萃取等,如表1所示。

表1 苯并[a]芘检测时样品前处理方法Table 1 Methods of sample pretreatment for detection of B[a]P
3 B[a]P的检测方法
由于B[a]P对人体健康危害较大,快速检测出食品或环境中的B[a]P尤为重要。为了进一步提高检测的灵敏度、精确度,时常将2种或多种方法进行联用。目前检测B[a]P的方法有高效液相色谱-荧光法、气相色谱-质谱联用法、液相色谱-质谱联用法、气相色谱-串联质谱法、液相色谱-串联质谱法、表面增强拉曼光谱检测法等[14-26];此外,还可通过免疫分析法来检测B[a]P,如ELISA试剂盒法、电化学免疫传感器、金标免疫层析技术[6],如表2所示。

表2 B[a]P的检测方法Table 2 Detection methods of B[a]P
4 B[a]P代谢产物的种类
B[a]P在机体中可通过酶促反应(细胞色素P450酶、环氧还原酶和环氧水解酶等)或非酶促反应被代谢为多种产物,一般分为二醇类、酚类、环氧类和醌类[24]。环氧化物主要有B[a]P 2,3-,4,5-,7,8-和9,10-环氧异构体,这些环氧化物可被环氧水解酶转化为反式二氢二醇异构体[25]。此外,环氧化合物还可以通过非酶促反应转化为酚类化合物如1-OH B[a]P、3-OH B[a]P、6-OH B[a]P、7-OH B[a]P、9-OH B[a]P等[26],B[a]P的代谢产物结构式如图3所示。

5 B[a]P代谢物与DNA加合物种类及其检测方法
B[a]P不与DNA直接发生反应,当通过二醇-环氧途径、邻醌途径和自由基阳离子途径被代谢活化后才与DNA形成加合物。而DNA加合物是B[a]P危害机体的一类重要生物标志物,若其造成的DNA损伤不能被及时修复,则会导致基因突变诱发癌症,因此DNA加合物可为癌症风险评估提供重要的参考信息,对于发展相关疾病预防和治疗手段具有重要意义[33]。目前,DNA加合物常用的方法有32P后标记法、免疫分析法、色谱-质谱联用法、毛细管电泳法等,但由于生物体中DNA加合物含量极低,对其分析和鉴定仍然存在较大困难,有待进一步发展[28]。
5.1 B[a]P-7,8-氢二醇-9,10-环氧化物dG加合物
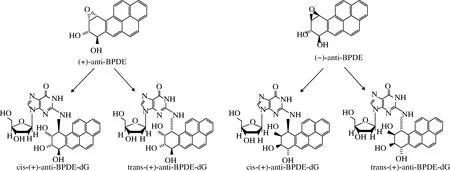
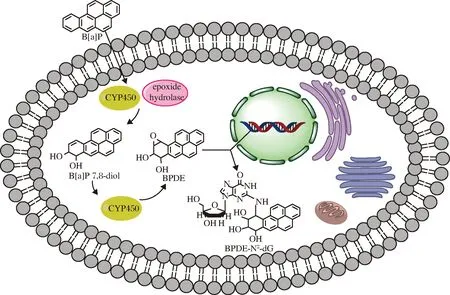
在细胞色素P450(CYP450)酶、环氧水解酶以及其他酶的作用下,B[a]P被代谢为B[a]P-7, 8-二氢二醇-9, 10-环氧化物(B[a]P-7,8-dihydrodiol-9,10-epoxide,BPDE),是B[a]P的最终致癌代谢物[29]。BPDE会与细胞DNA发生结合,在脱氧鸟苷的N2位形成BPDE-N2-dG 4种立体异构体加合物[30]如图4所示,其形成过程如图5所示,从而造成DNA损伤,但通常可以通过核苷酸切除修复和碱基切除修复2个通路进行修复,而当核苷酸切除修复和碱基切除修复2个通路中相关基因受到损伤时,细胞DNA修复能力丧失[31], 则由BPDE引起的DNA损伤不能被修复,从而诱发癌症以及其他疾病。此外,BPDE-DNA加合物与DNA甲基化呈正相关,原因可能是BPDE与DNA的结合会通过影响DNA甲基转移酶的活性而促进DNA的甲基化,或者由于BPDE-DNA加合物的位点甲基化增加所致[32],由BPDE-DNA加合物引起的DNA甲基化异常也会导致许多复杂的疾病。
BPDE-N2-dG加合物既是接触(暴露)生物标志,又是一种效应标志物[33],对其定性或定量分析是开展相关研究的一个重要基础,可进一步揭示人类重大疾病的分子机制。目前,对于BPDE-N2-dG的检测方法越来越多,其中常用的方法包括32P后标记法、免疫分析法、液相色谱串联质谱法、毛细管电泳-激光诱导荧光法等,其检测方法及其应用如表3所示[34-41]。

表3 BPDE-N2-dG的检测方法及应用Table 3 Detection method and application of BPDE-N2-dG
5.2 B[a]P-7,8-二酮-DNA加合物
B[a]P-7,8-二酮(B[a]P-7,8-dione,BPQ)是由(±)-B[a]P-7,8-反式二醇经醛酮还原酶(aldehyde ketone reductase,AKR)催化形成的[42]。它既具有亲电性,又具有氧化还原活性,亲电性使得BPQ能与DNA通过加成反应生成BPQ-DNA加合物[43]。而这些BPQ-DNA加合物在体内不稳定,不易被检测到,如NESNOW等[33]对A/J雄性小鼠进行BPQ和B[a]P-7,8-腹腔注射后,通过32P后标记分析小鼠肺和肝脏中的DNA,未检测到BPQ-DNA加合物,但小鼠体重随时间显着下降,表明这2种药物均可引起全身毒性。
多项研究通过体外实验,对BPQ-DNA加合物进行了研究,为体内BPQ介导的遗传毒性和致癌作用奠定基础。HUANG等[44]通过液相色谱串联质谱对经过BPQ处理后的人肺腺癌A549细胞,人支气管肺泡H358细胞,永生化人支气管上皮HBEC-KT细胞中BPQ与DNA加合物进行检测,在A549细胞和HBEC-KT细胞中发现了BPQ-DNA加合物。BALU等[45]在生理PH条件下合成4个BPQ与dG、2个BPQ与dA加合物,并通过高效液相色谱/电喷雾-质谱进行了鉴定和表征。BALU等[46]还制备了dGMP(3′)、dAMP(3′)和dCMP(3′)与BPQ加合物,并通过UV、LC/MS以及一维和二维核磁共振技术对制备的加成物进行了表征。
5.3 自由基阳离子-DNA加合物
B[a]P经CYP450酶催化后会生成自由基阳离子[47],该阳离子与DNA相互作用,主要是在B[a]P的C6位置与鸟嘌呤的N7和C8位置以及腺嘌呤的N7位置形成脱嘌呤的加合物[48]。CHEN等[49]在雌性瑞士小鼠局部皮肤上用B[a]P处理4 h后处死小鼠,对处理过的皮肤进行前处理,然后通过HPLC和荧光线窄光谱法分析出5种DNA加合物分别是:B[a]P-6-C8-Gua、B[a]P-6-N7-Ade,B[a]P-C6-N7-Gua和少量BPDE-C10-N7-Ade和BPDE-C10-N7-Gua,其中自由基阳离子与DNA加合物占总DNA加合物的66%。由于自由基阳离子的寿命短,SEN等[50]通过检测自由阳离子下游产物B[a]P-1,6-二酮和B[a]P-3,6-二酮来确定经B[a]P处理后酵母菌株中自由阳离子水平,研究发现自由阳离子水平随B[a]P剂量的增加而增加,而自由基阳离子会与DNA形成加合物,但不稳定迅速被分解,会造成DNA突变,通过对P53基因进行测序,发现BPQ的诱变性比自由基阳离子强,且大多数突变都在鸟嘌呤残基处,表明加合物大多在鸟嘌呤上形成。
6 总结与展望
本文详细综述了检测B[a]P时样品前处理方法及其检测方法、代谢产物的种类以及B[a]P经过二醇-环氧途径、邻醌途径和自由基阳离子途径被代谢活化后的产物与DNA加合物的形成过程和检测方法,为分析检测B[a]P和预防其毒性提供参考。DNA加合物作为B[a]P危害机体的一类重要生物标志物,对其检测具有重要意义,但其检测方法还存在一些问题,应对DNA加合物的检测方法进行进一步探索,提高检测方法的精确度、灵敏度,为更好地探究各种有害物质的毒性机理提供参考依据,同时为发展相关疾病预防和治疗手段做出贡献。

